Содержание
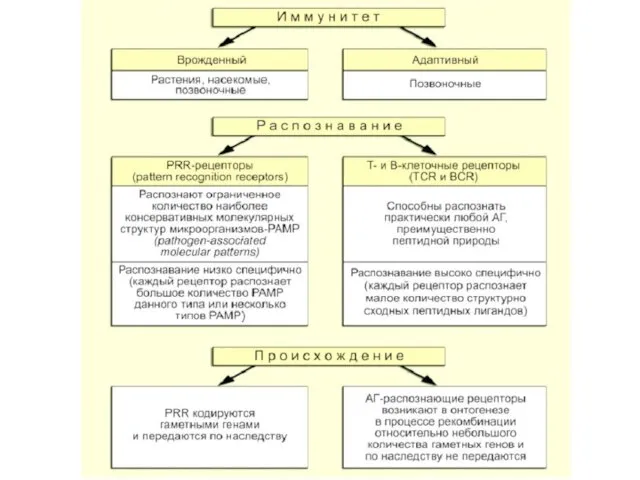
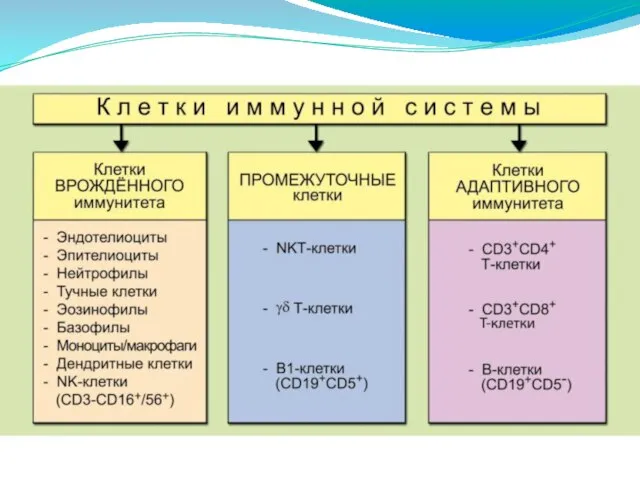
- 2. Иммунитет– это биологическое свойство многоклеточных организмов, обеспечивающее постоянство внутренней среды, по средствам: -распознавания -ослабления /деструкции -эллиминации
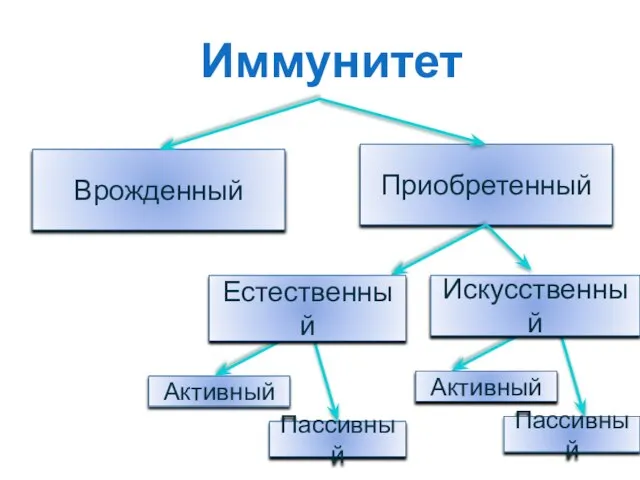
- 3. Врожденный Приобретенный Иммунитет Активный Пассивный Пассивный Активный Искусственный Естественный
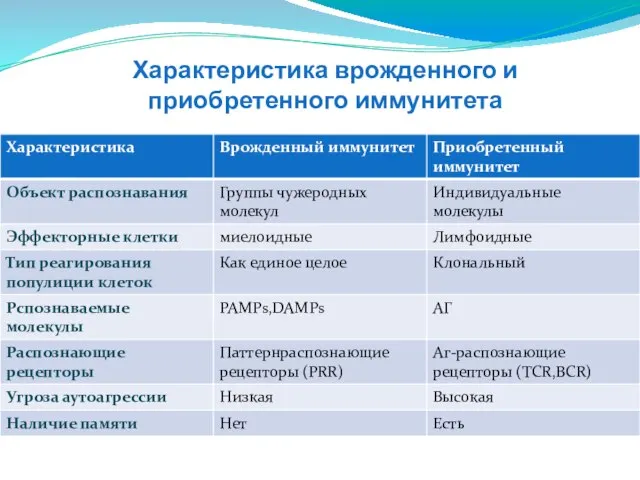
- 5. Характеристика врожденного и приобретенного иммунитета
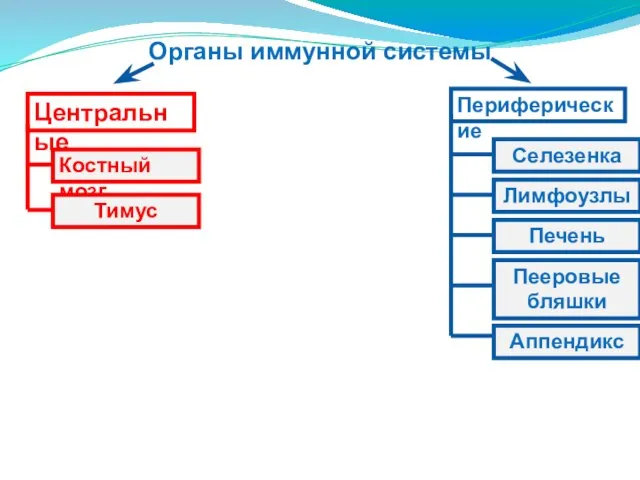
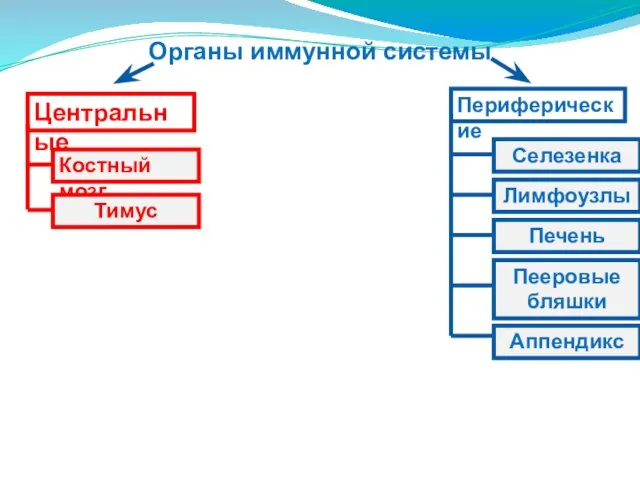
- 6. Органы иммунной системы Центральные Периферические Костный мозг Тимус Селезенка Аппендикс Пееровые бляшки Печень Лимфоузлы
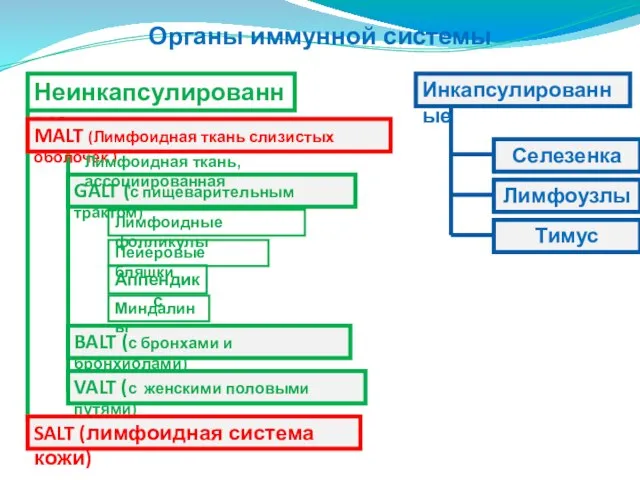
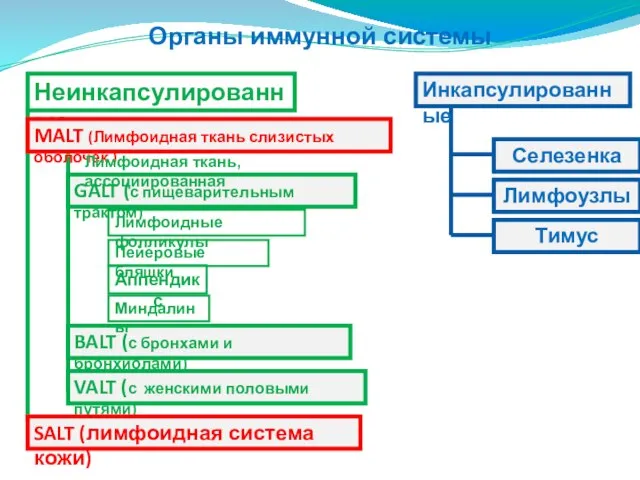
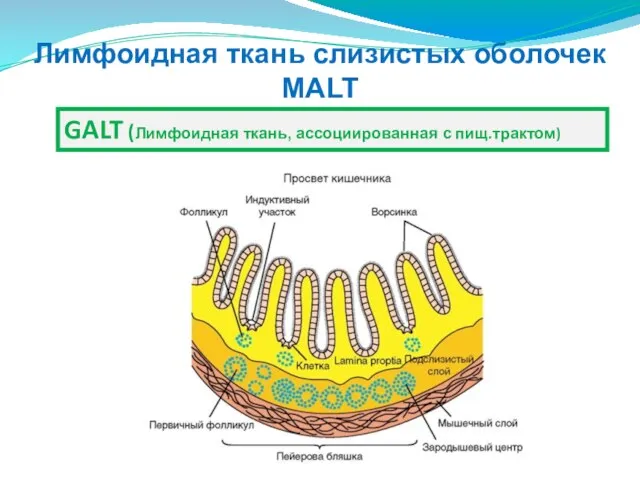
- 7. Органы иммунной системы Неинкапсулированные MALT (Лимфоидная ткань слизистых оболочек ) GALT (с пищеварительным трактом) Селезенка Тимус
- 9. Неспецифическая резистентность организма - устойчивость организма к любым патогенным воздействиям, независимо от их природы. 1.Механические барьеры
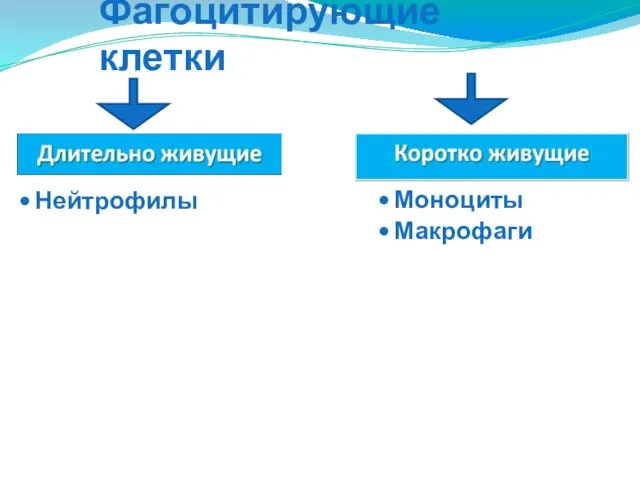
- 10. Эффекторные механизмы защиты организма 1.Фагоцитоз -Нейтрофиллы -Моноциты -Макрофаги 2.Экзоцитоз -эозинофилы -базофилы -мастоциты 3.Цитолиз -Комплемент -NK-клетки -ЦТЛ
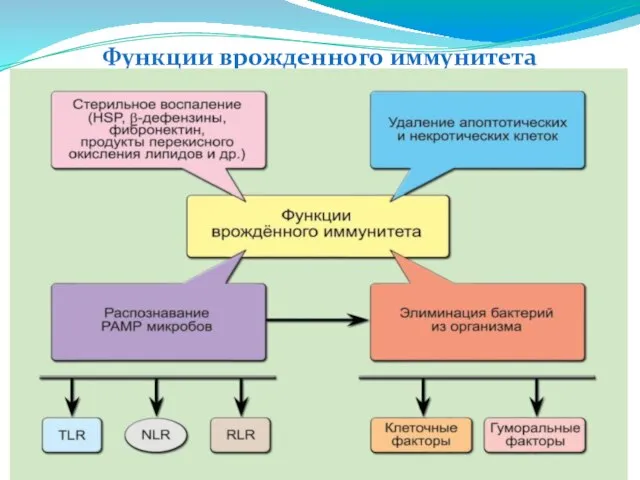
- 11. Функции врожденного иммунитета
- 12. Основные факторы врожденного иммунитета Клеточные факторы
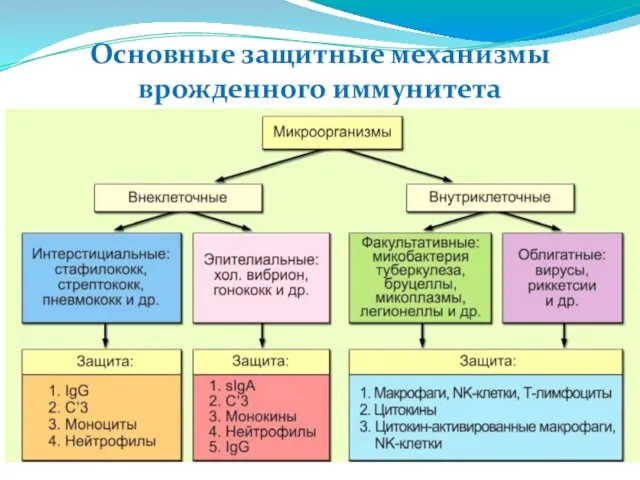
- 13. Основные защитные механизмы врожденного иммунитета
- 14. Фазы ответной реакции врожденного иммунитета
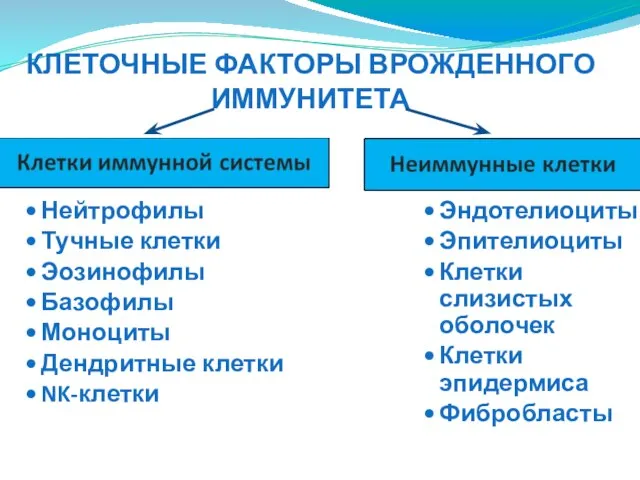
- 15. КЛЕТОЧНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА
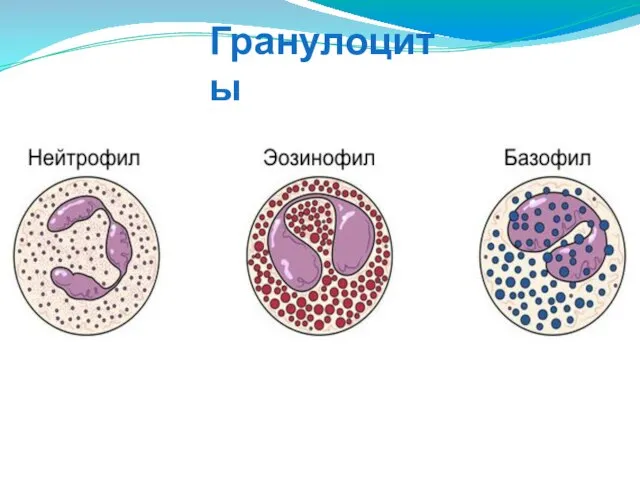
- 16. КЛЕТОЧНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА Нейтрофилы Тучные клетки Эозинофилы Базофилы Моноциты Дендритные клетки NK-клетки Эндотелиоциты Эпителиоциты Клетки
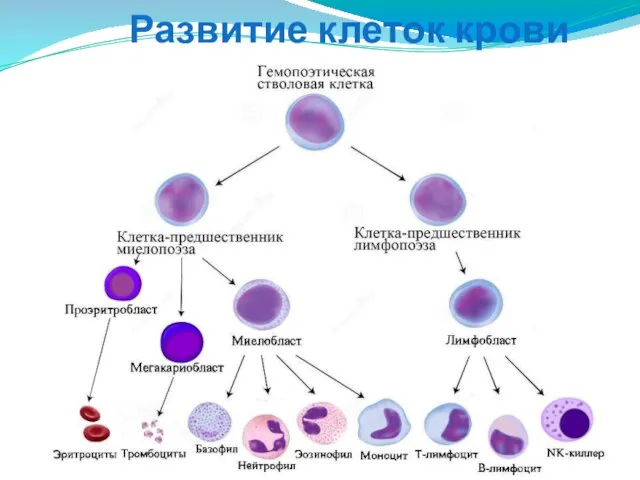
- 17. Развитие клеток крови
- 18. Гранулоциты
- 19. Фагоцитирующие клетки Моноциты Макрофаги Нейтрофилы
- 20. 1.Развитие нейтрофилов 2.Морфология клетки 3. Гранулы нейтрофилов и их свойства 4. Кластерные молекулы и их функции
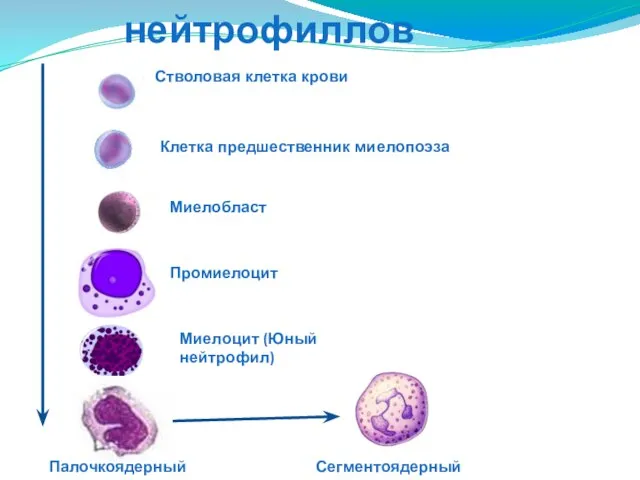
- 21. Развитие нейтрофиллов Стволовая клетка крови Клетка предшественник миелопоэза Миелобласт Промиелоцит Миелоцит (Юный нейтрофил) Палочкоядерный нейтрофил Сегментоядерный
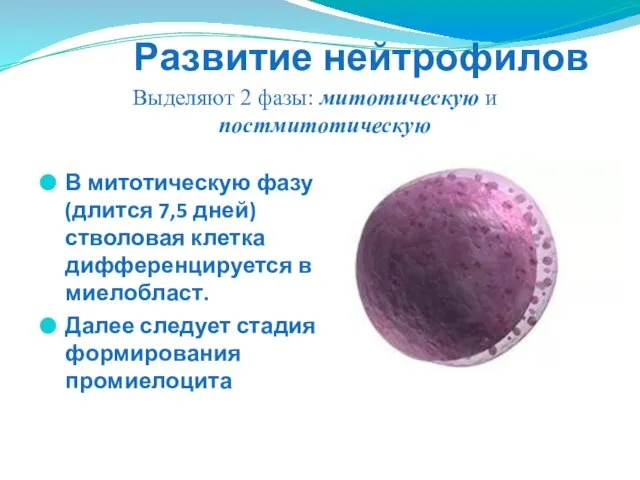
- 22. Развитие нейтрофилов В митотическую фазу (длится 7,5 дней) стволовая клетка дифференцируется в миелобласт. Далее следует стадия
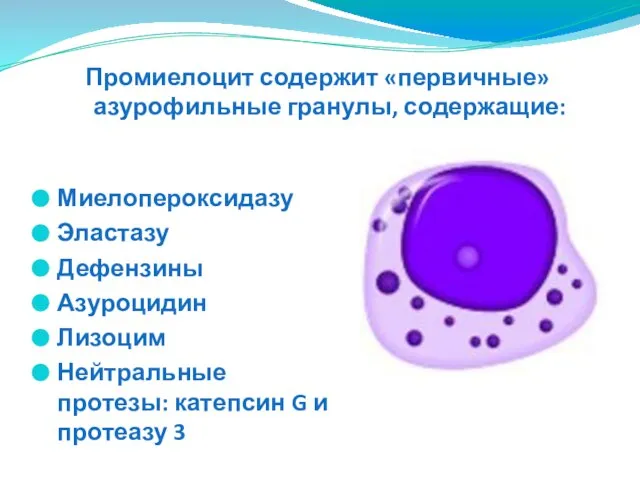
- 23. Миелопероксидазу Эластазу Дефензины Азуроцидин Лизоцим Нейтральные протезы: катепсин G и протеазу 3 Промиелоцит содержит «первичные» азурофильные
- 24. Лактоферрин Лизоцим Фосфолипазу Ф2 Белок, повышающий проницаемость микробной стенки Белок NGAI Липокартин Кателицидин В12 связывающий протеин
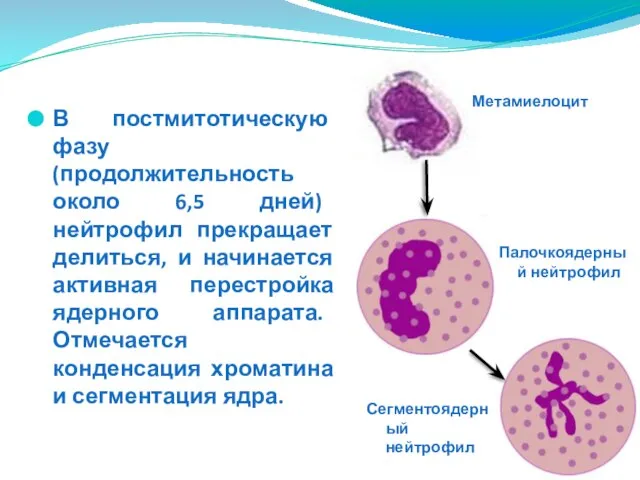
- 25. В постмитотическую фазу (продолжительность около 6,5 дней) нейтрофил прекращает делиться, и начинается активная перестройка ядерного аппарата.
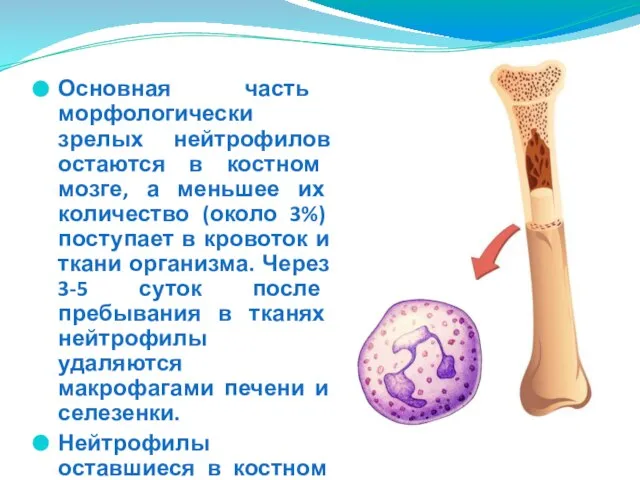
- 26. Основная часть морфологически зрелых нейтрофилов остаются в костном мозге, а меньшее их количество (около 3%) поступает
- 27. Морфология Нейтрофильные сегментоядерные лейкоциты - преобладающая популяция белых клеток крови. Клетки диаметром 9-12мкм, имеют сегментированное ядро
- 28. Гранулы нейтрофилов При дегрануляции азурофильные гранулы первыми сливаются с фагосомами, затем - специфические. Мембрана специфических и
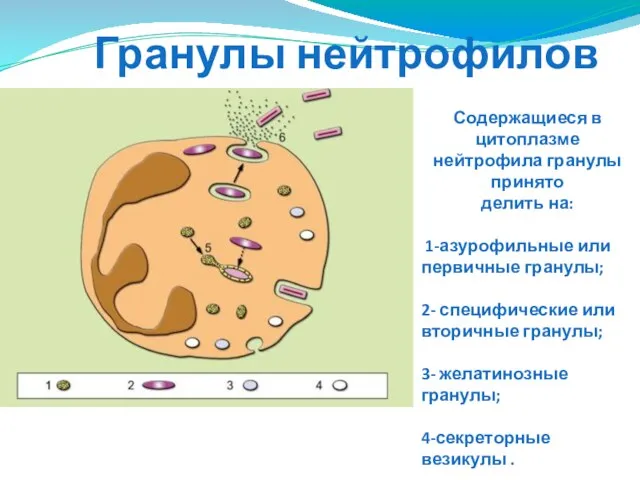
- 29. Гранулы нейтрофилов Содержащиеся в цитоплазме нейтрофила гранулы принято делить на: 1-азурофильные или первичные гранулы; 2- специфические
- 30. Свойства и состав гранул нейтрофилов
- 31. Все указанные вещества обладают антимикробным действием Миелопероксидаза (MPO) составляет 2–4% массы нейтрофила, катализирует образование хлорноватистой кислоты
- 32. Катепсин G при нейтральном рН убивает грамположительные и грамотрицательные бактерии. Дефицит катепсина G и связанное с
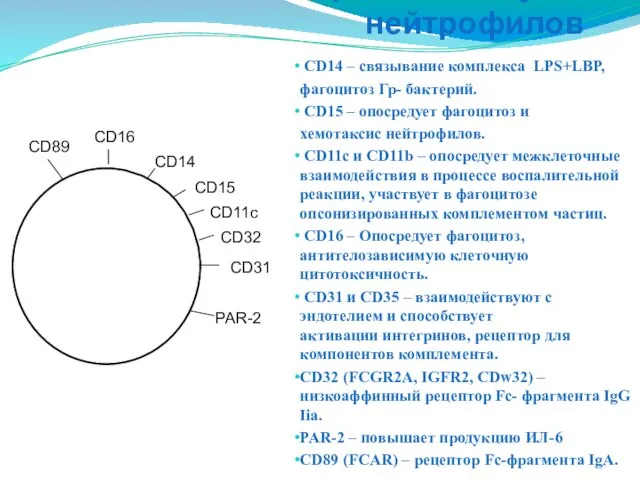
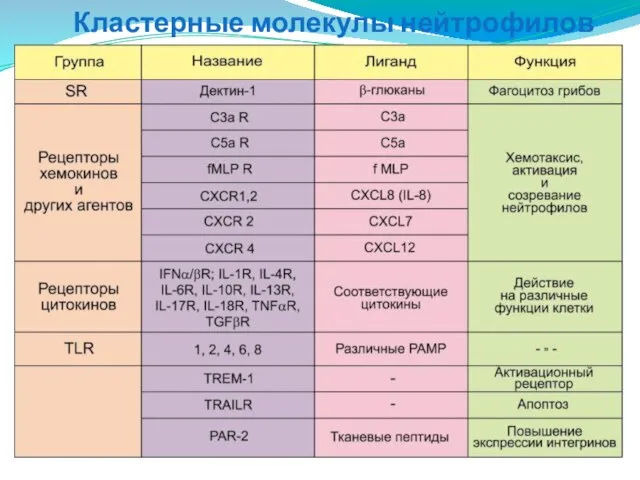
- 33. СD14 – связывание комплекса LPS+LBP, фагоцитоз Гр- бактерий. CD15 – опосредует фагоцитоз и хемотаксис нейтрофилов. CD11c
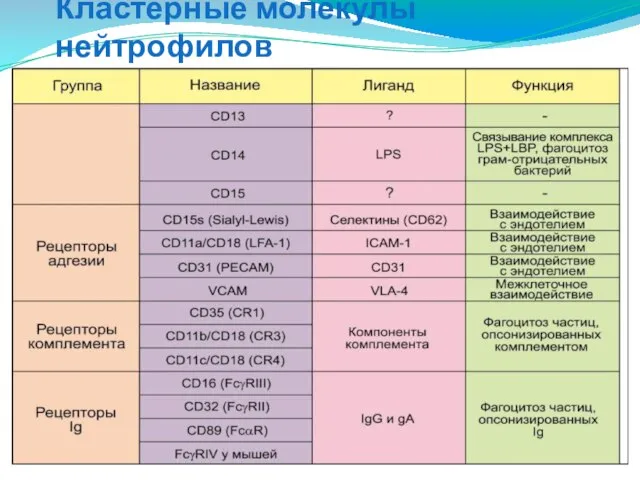
- 34. Кластерные молекулы нейтрофилов
- 35. Кластерные молекулы нейтрофилов
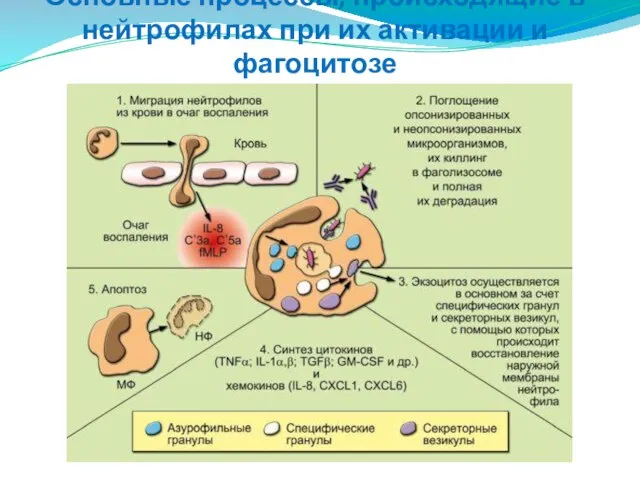
- 36. Основные процессы, происходящие в нейтрофилах при их активации и фагоцитозе
- 37. На рисунке отражены участие НФ в фагоцитозе (миграция, поглощение, дегрануляция, внутриклеточный киллинг, деградация, экзоцитоз и апоптоз)
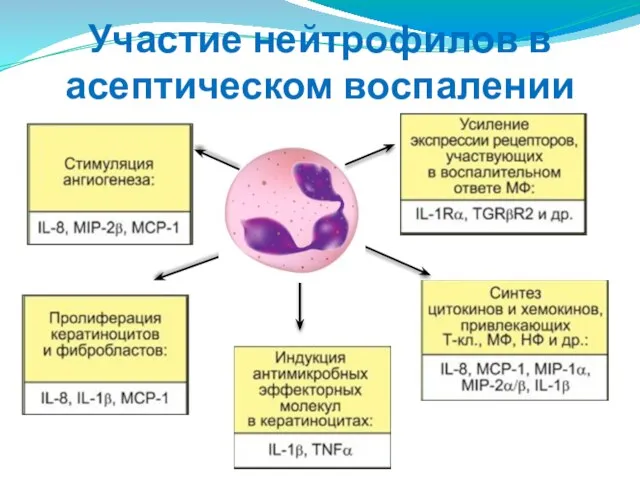
- 38. Участие нейтрофилов в асептическом воспалении
- 39. 1.Развитие моноцитов 2.Морфология моноцитов 3. Моноциты периферической крови 4. Развитие макрофагов 5. Морфология макрофагов 6.Кластерные молекулы
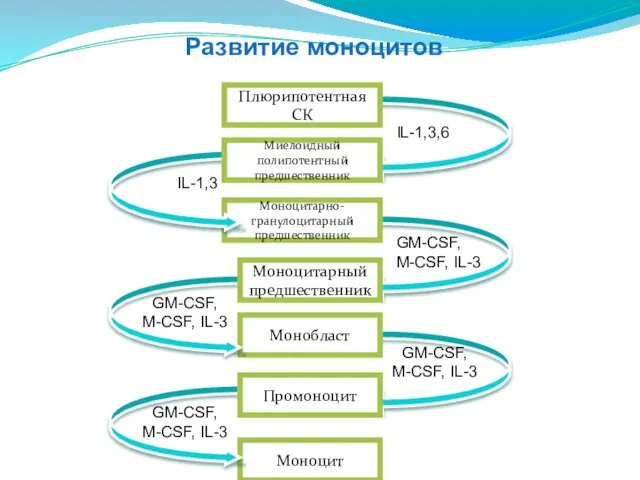
- 40. Моноцит Монобласт Моноцитарно-гранулоцитарный предшественник Плюрипотентная СК Моноцитарный предшественник Промоноцит Миелоидный полипотентный предшественник IL-1,3,6 IL-1,3 GM-CSF, M-CSF,
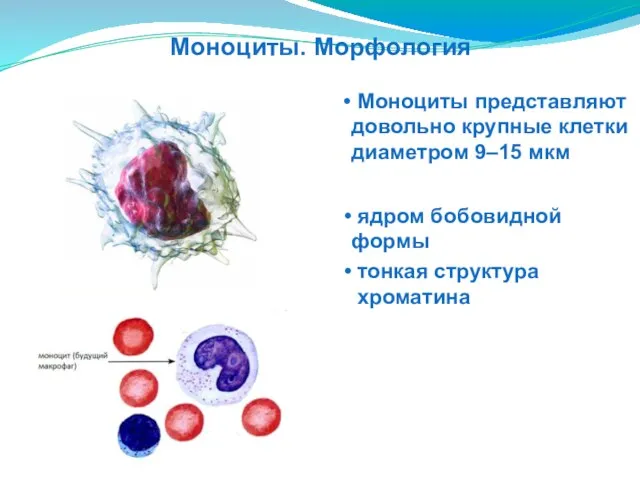
- 41. тонкая структура хроматина Моноциты представляют довольно крупные клетки диаметром 9–15 мкм ядром бобовидной формы Моноциты. Морфология
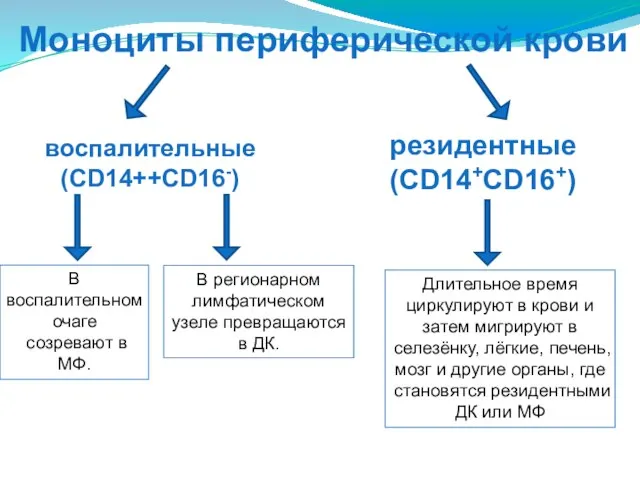
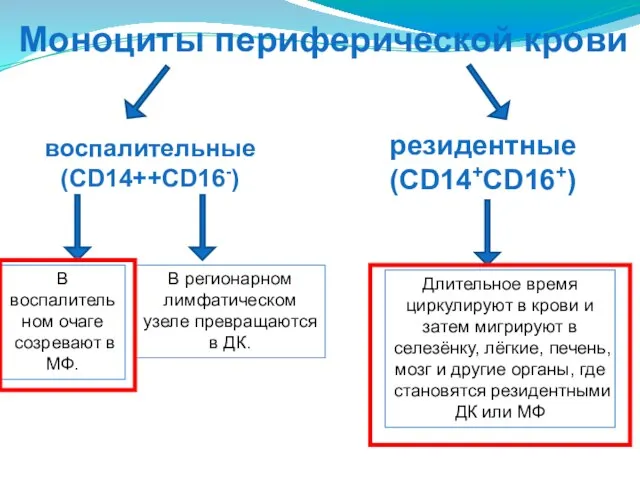
- 42. Моноциты периферической крови воспалительные (CD14++CD16-) резидентные (CD14+CD16+) В воспалительном очаге созревают в МФ. В регионарном лимфатическом
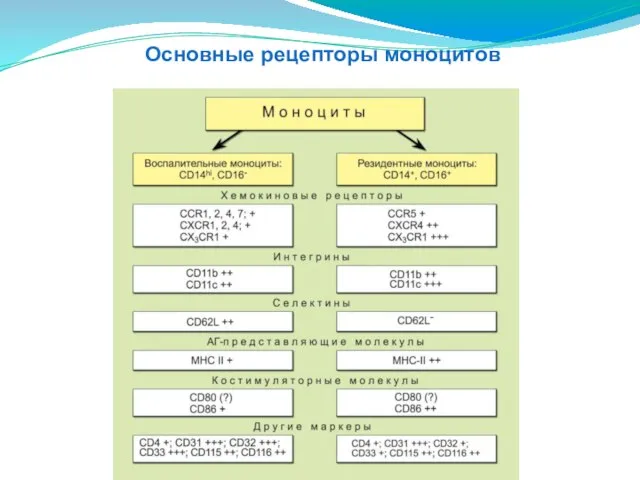
- 43. Основные рецепторы моноцитов
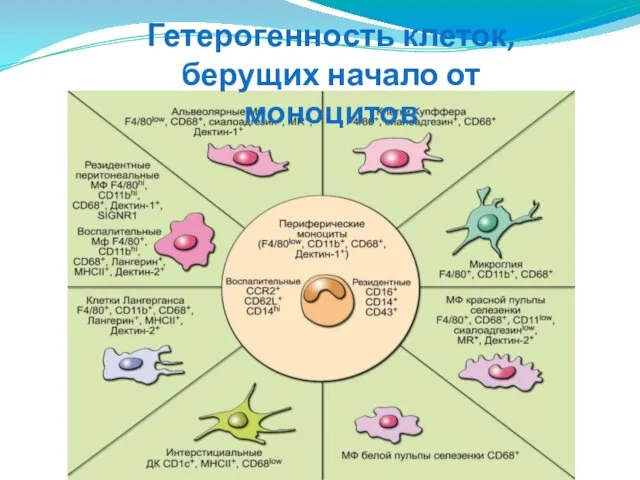
- 44. Гетерогенность клеток, берущих начало от моноцитов
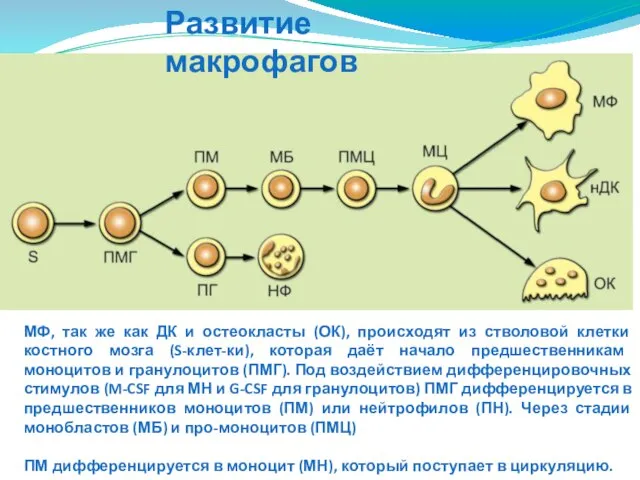
- 45. Развитие макрофагов МФ, так же как ДК и остеокласты (ОК), происходят из стволовой клетки костного мозга
- 46. изменяется экспрессии некоторых мембранных молекул (ослабевает экспрессия CD13, CD14, CD15, β1-интегринов, FcγRI, усиливается экспрессия CD16). Это
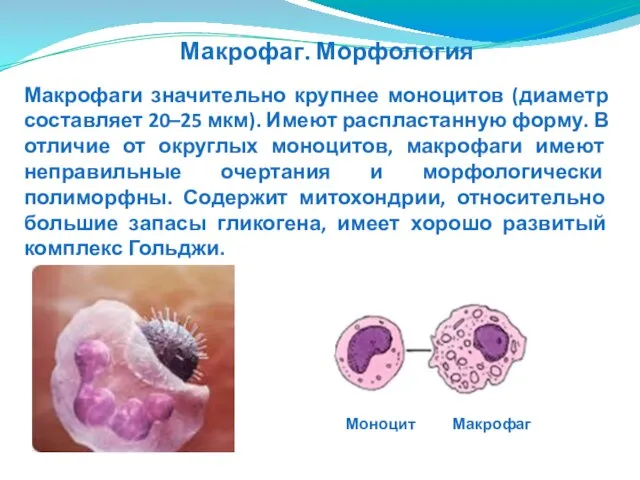
- 47. Макрофаги значительно крупнее моноцитов (диаметр составляет 20–25 мкм). Имеют распластанную форму. В отличие от округлых моноцитов,
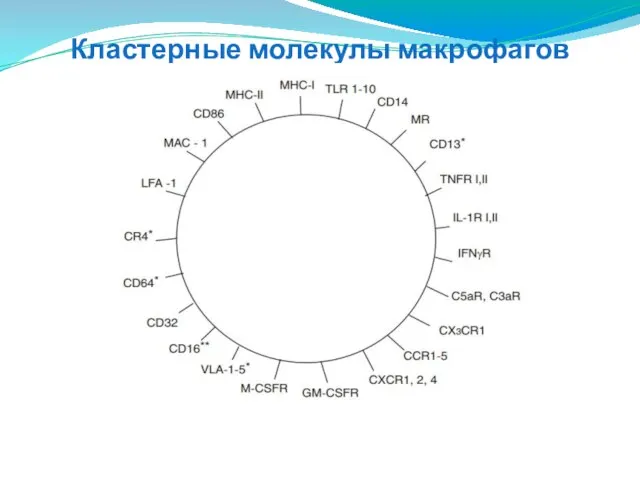
- 48. Кластерные молекулы макрофагов
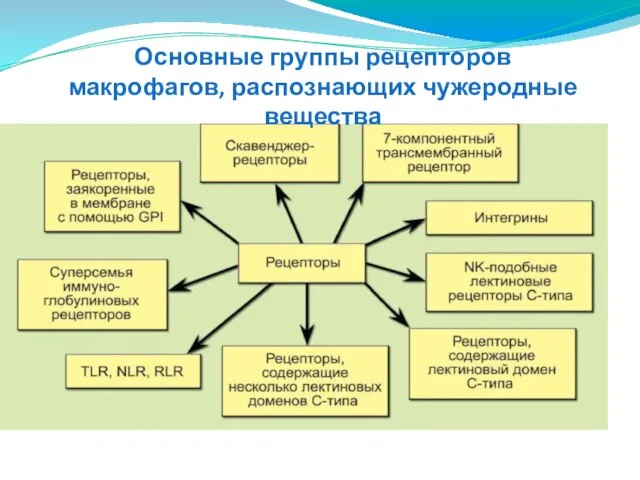
- 49. Основные группы рецепторов макрофагов, распознающих чужеродные вещества
- 50. Моноциты периферической крови воспалительные (CD14++CD16-) резидентные (CD14+CD16+) В воспалительном очаге созревают в МФ. В регионарном лимфатическом
- 51. Моноциты воспалительные (CD14++CD16-) В первые часы острого воспаления моноциты для проникновения используют те же интегрины, что
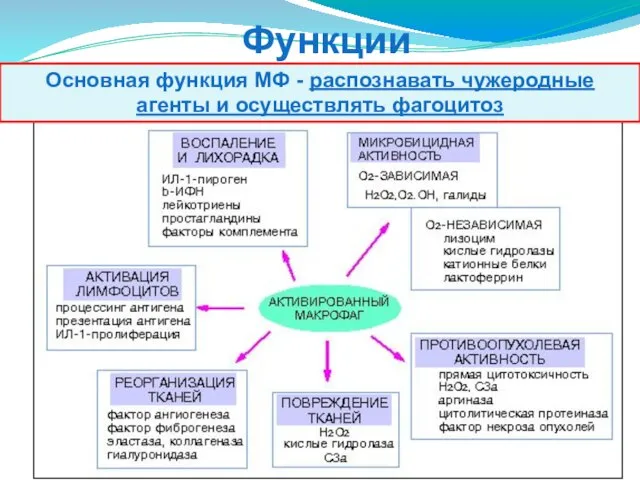
- 52. Функции макрофагов Основная функция МФ - распознавать чужеродные агенты и осуществлять фагоцитоз
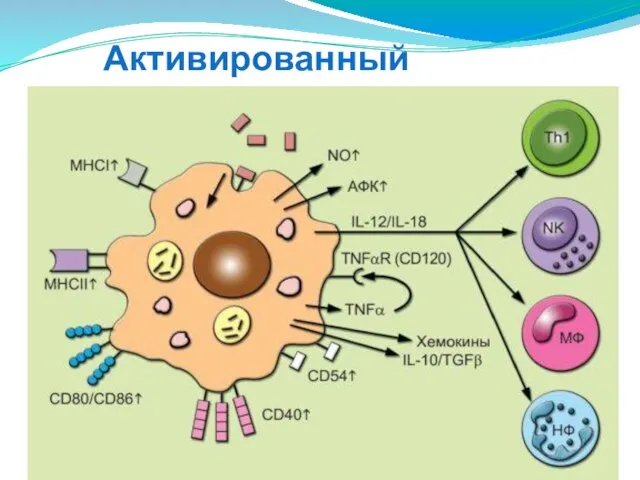
- 53. Активированный макрофаг
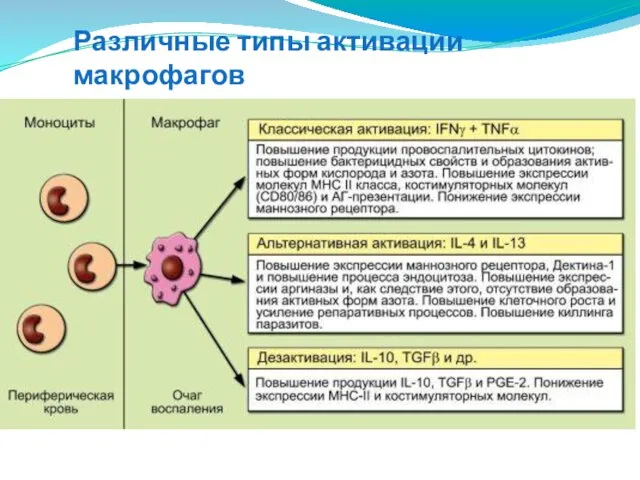
- 54. Различные типы активации макрофагов
- 55. Различные типы активации макрофагов В классическом виде процесс запускается ΙΚΝγ и TNF, индуцируемыми микроорганизмами и РАМР,
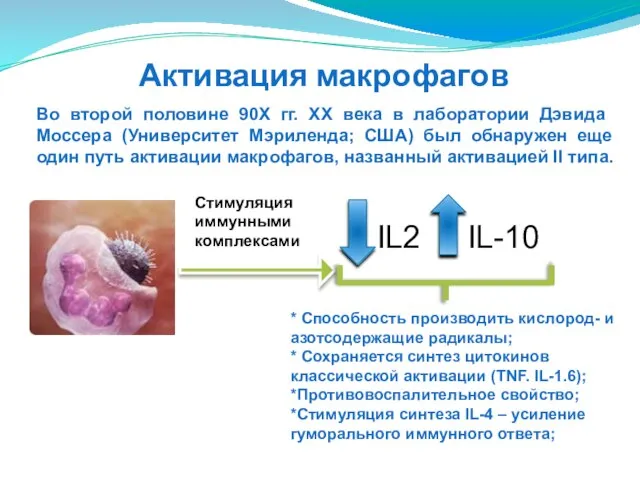
- 56. Активация макрофагов Во второй половине 90X гг. XX века в лаборатории Дэвида Моссера (Университет Мэриленда; США)
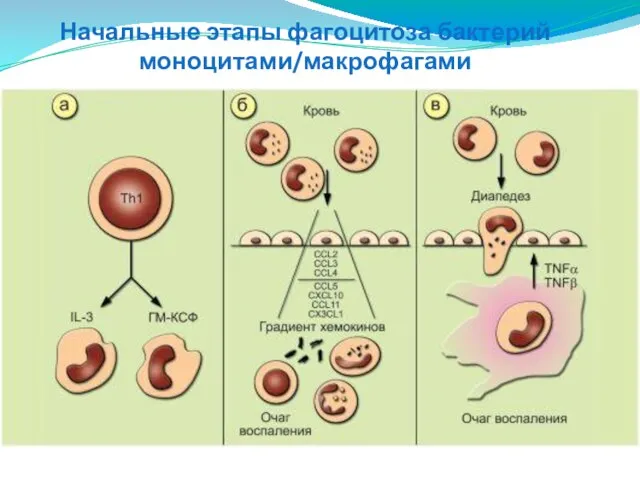
- 57. Начальные этапы фагоцитоза бактерий моноцитами/макрофагами
- 58. Фагоцитоз Явление фагоцитоза было открыто И.И. Мечниковым (1882). Он показал фундаментальную роль фагоцитоза как способа питания
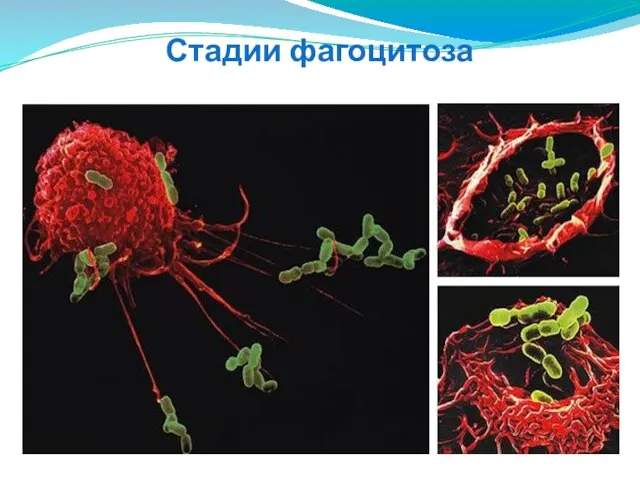
- 59. Стадии фагоцитоза 1. Хемотаксис 2. Адгезия 3. Активация мембраны 4. Погружение; 5.Образование фагосомы; 6.Слияние фагосомы и
- 60. Стадии фагоцитоза
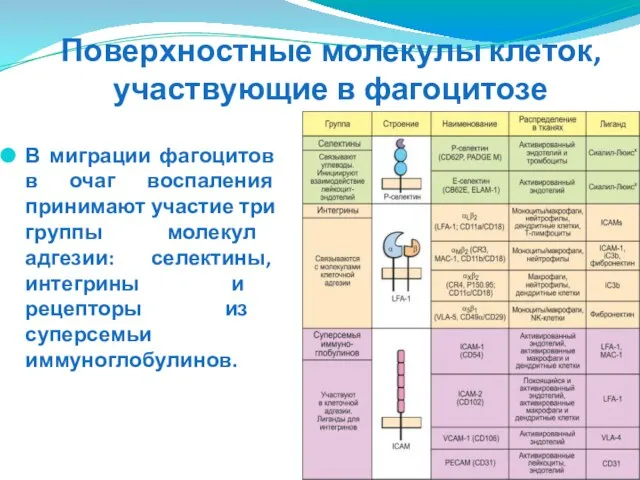
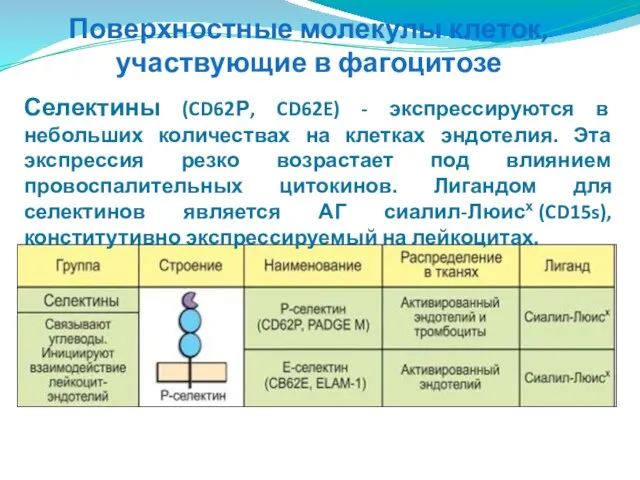
- 61. Поверхностные молекулы клеток, участвующие в фагоцитозе В миграции фагоцитов в очаг воспаления принимают участие три группы
- 62. Поверхностные молекулы клеток, участвующие в фагоцитозе Селектины (CD62Р, CD62E) - экспрессируются в небольших количествах на клетках
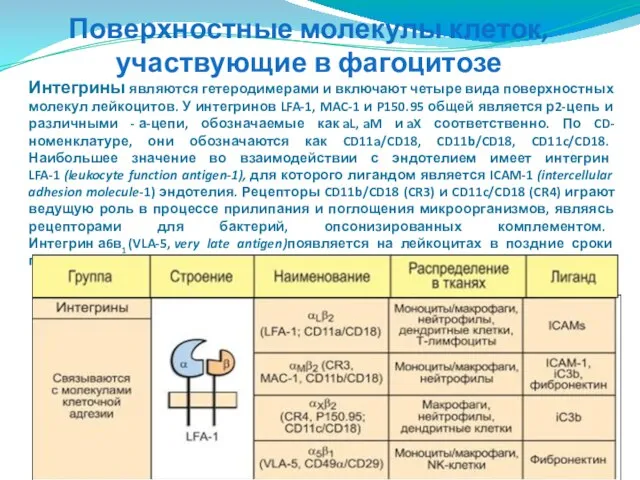
- 63. Поверхностные молекулы клеток, участвующие в фагоцитозе Интегрины являются гетеродимерами и включают четыре вида поверхностных молекул лейкоцитов.
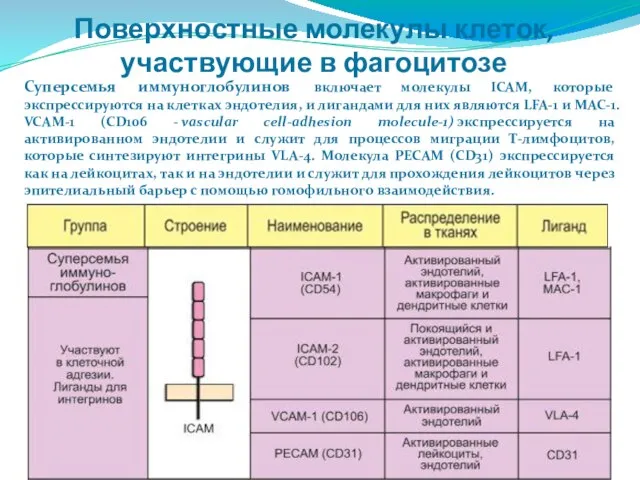
- 64. Поверхностные молекулы клеток, участвующие в фагоцитозе Суперсемья иммуноглобулинов включает молекулы ICAM, которые экспрессируются на клетках эндотелия,
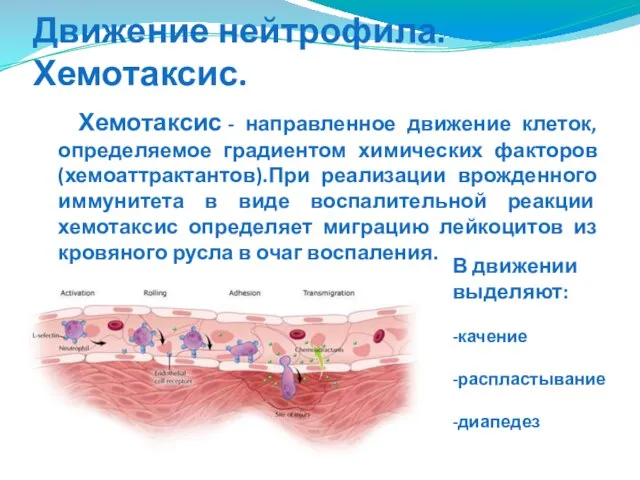
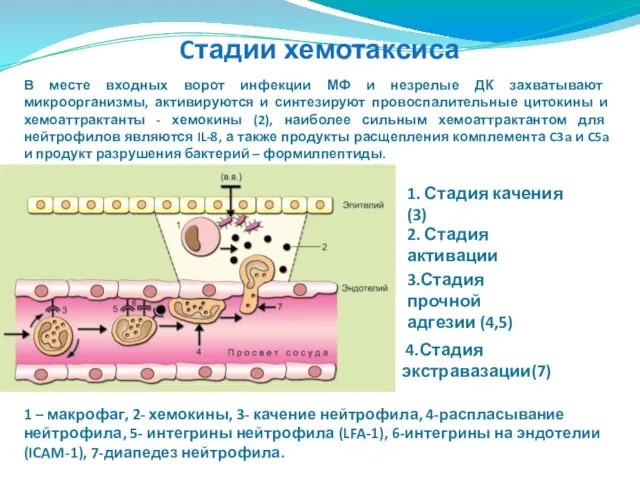
- 65. Движение нейтрофила. Хемотаксис. Хемотаксис - направленное движение клеток, определяемое градиентом химических факторов (хемоаттрактантов).При реализации врожденного иммунитета
- 66. Cтадии хемотаксиса 1. Стадия качения (3) 2. Стадия активации 3.Стадия прочной адгезии (4,5) 4.Стадия экстравазации(7) 1
- 67. Адгезия Обязательным условием адгезии фагоцита служит распознавание объекта фагоцитоза. Механизмы распознавания разнообразны и принципиально различаются в
- 68. Scavenger-рецепторы (рецепторы-мусорщики). Эти рецепторы экспрессированы на макрофагах и некоторых дендритных клетках. Лигандами для scavenger-рецепторов служат компоненты
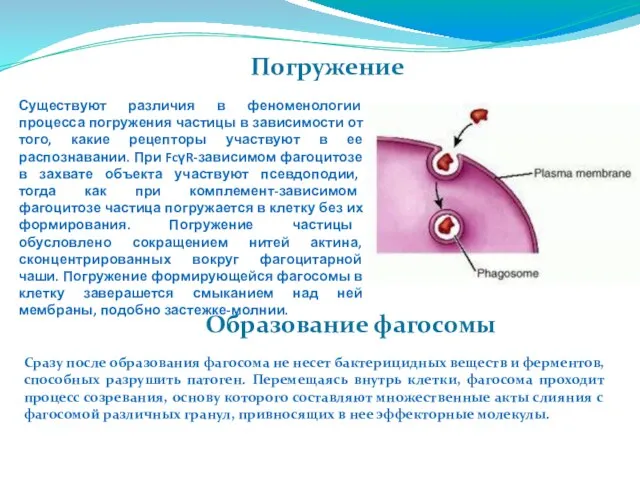
- 69. Погружение Существуют различия в феноменологии процесса погружения частицы в зависимости от того, какие рецепторы участвуют в
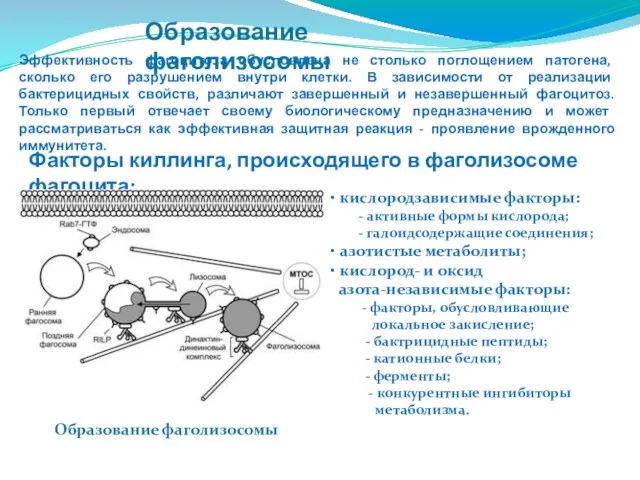
- 70. Образование фаголизосомы Образование фаголизосомы Эффективность фагоцитоза обусловлена не столько поглощением патогена, сколько его разрушением внутри клетки.
- 71. Эозинофилы 1.Развитие эозинофилов 2. Морфология клетки 3. Гранулы эозинофилов и их свойства 4. Кластерные молекулы эозинофилов
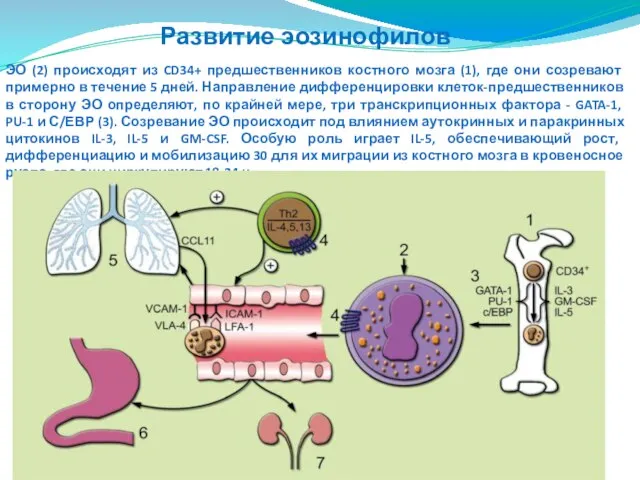
- 72. ЭО (2) происходят из CD34+ предшественников костного мозга (1), где они созревают примерно в течение 5
- 73. МОРФОЛОГИЯ Эозинофилы составляют 1–5% лейкоцитов, циркулирующих в крови. Эозинофилы в течение нескольких дней после образования остаются
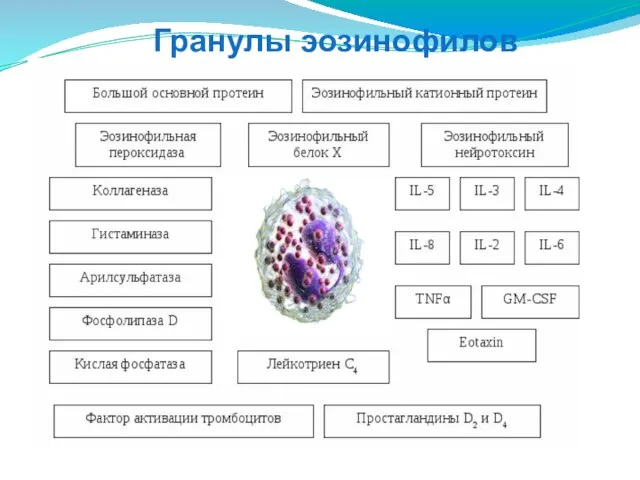
- 74. Гранулы эозинофилов
- 75. Гранулы эозинофилов
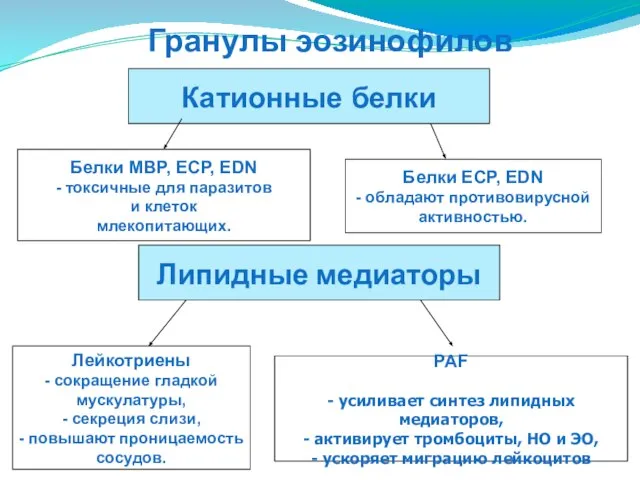
- 76. Белки MBP, ECP, EDN - токсичные для паразитов и клеток млекопитающих. Белки ECP, EDN - обладают
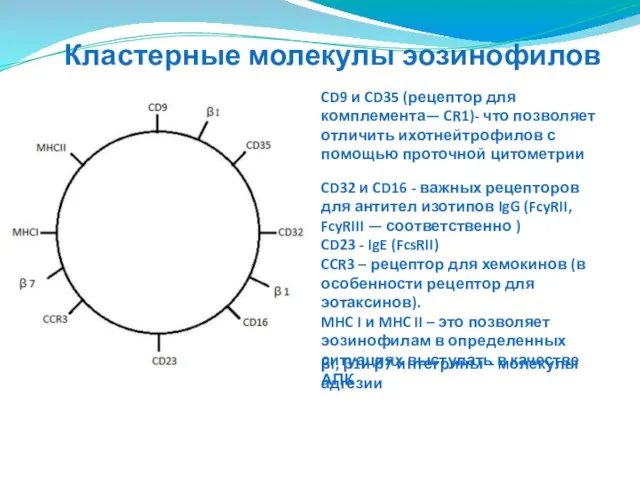
- 77. Кластерные молекулы эозинофилов CD9 и CD35 (рецептор для комплемента— CR1)- что позволяет отличить ихотнейтрофилов с помощью
- 78. 1. Повышение чувствительности рецепторов к иммуноглобулинам класса Е. За счет этого активизируется противопаразитарный иммунитет, и происходит
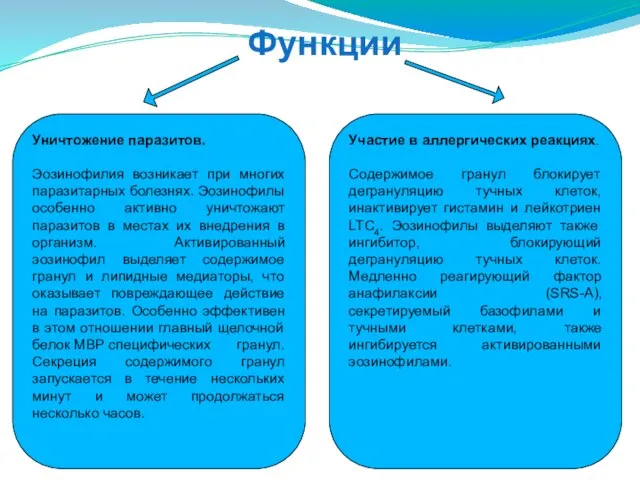
- 79. Функции Уничтожение паразитов. Эозинофилия возникает при многих паразитарных болезнях. Эозинофилы особенно активно уничтожают паразитов в местах
- 80. Побочные эффекты Секретируемые эозинофилом вещества могут повреждать нормальные ткани. Так, при постоянном высоком содержании эозинофилов в
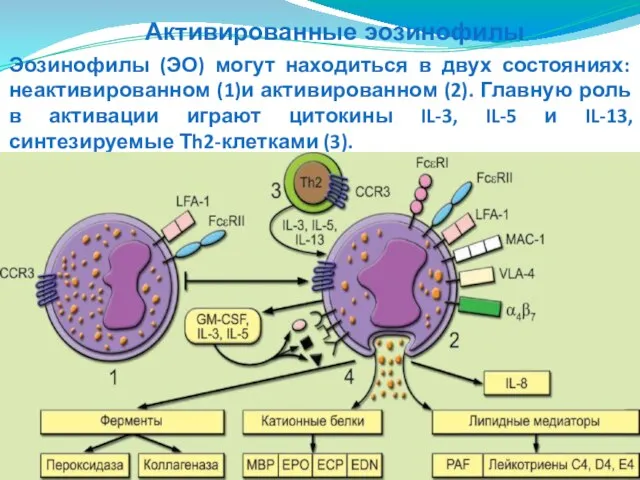
- 81. Эозинофилы (ЭО) могут находиться в двух состояниях: неактивированном (1)и активированном (2). Главную роль в активации играют
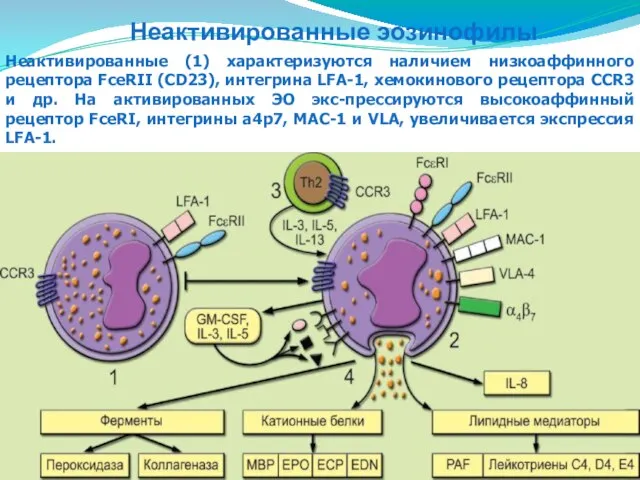
- 82. Неактивированные эозинофилы Неактивированные (1) характеризуются наличием низкоаффинного рецептора FceRII (CD23), интегрина LFA-1, хемокинового рецептора CCR3 и
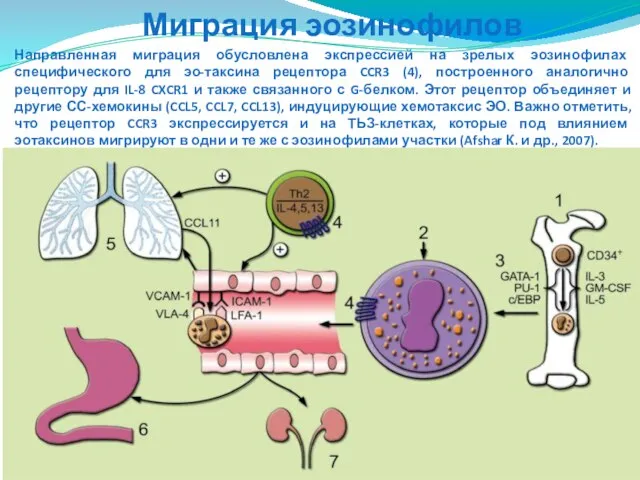
- 83. Направленная миграция обусловлена экспрессией на зрелых эозинофилах специфического для эо-таксина рецептора CCR3 (4), построенного аналогично рецептору
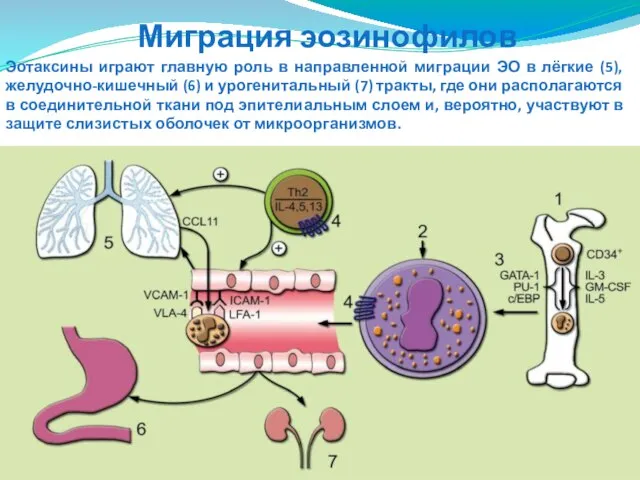
- 84. Эотаксины играют главную роль в направленной миграции ЭО в лёгкие (5), желудочно-кишечный (6) и урогенитальный (7)
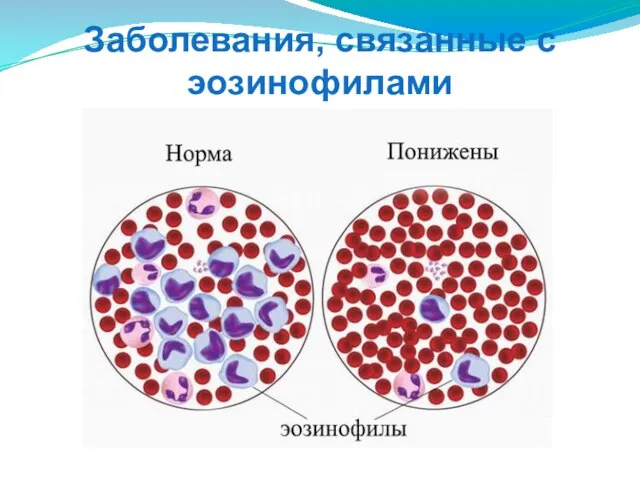
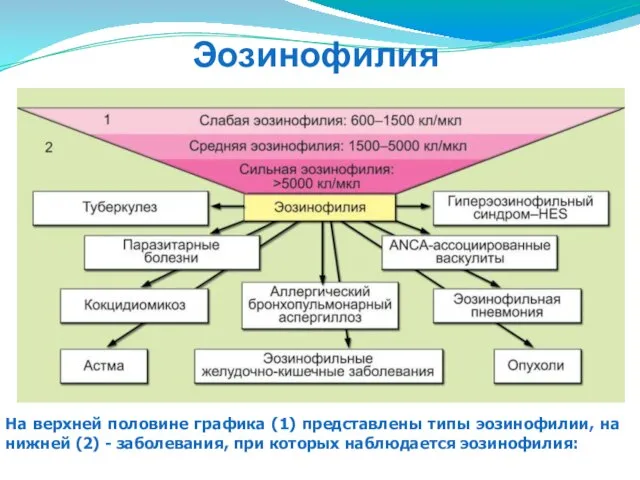
- 85. Заболевания, связанные с эозинофилами
- 86. На верхней половине графика (1) представлены типы эозинофилии, на нижней (2) - заболевания, при которых наблюдается
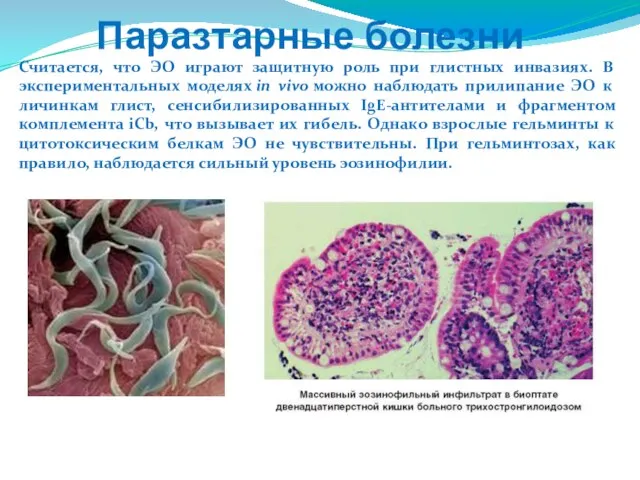
- 87. Считается, что ЭО играют защитную роль при глистных инвазиях. В экспериментальных моделях in vivo можно наблюдать
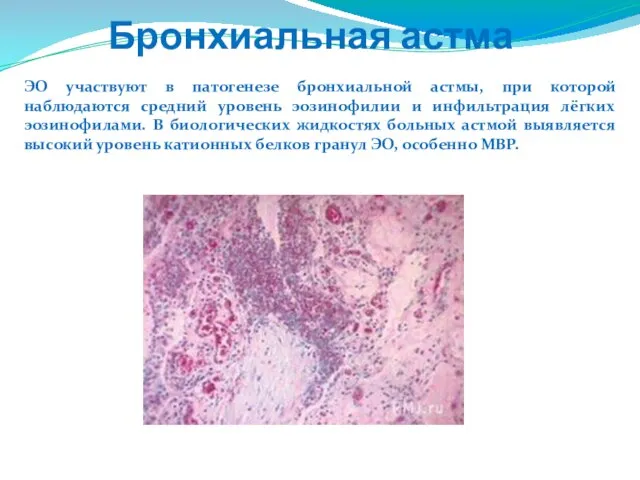
- 88. ЭО участвуют в патогенезе бронхиальной астмы, при которой наблюдаются средний уровень эозинофилии и инфильтрация лёгких эозинофилами.
- 89. Особняком от этих заболеваний стоит идиопатический гиперэозинофильный синдром (HES), который характеризуется наличием в течение 6 мес
- 90. К гиперэозинофильным синдромам относится эозинофильный фибропластический эндокардит, характеризующийся стойкой эозинофилией в течение не менее 6 мес
- 91. 1.Развитие базофилов и тучных клеток 2. Гранулы базофилов и тучных клеток, их свойства Базофилы. Тучные клетки
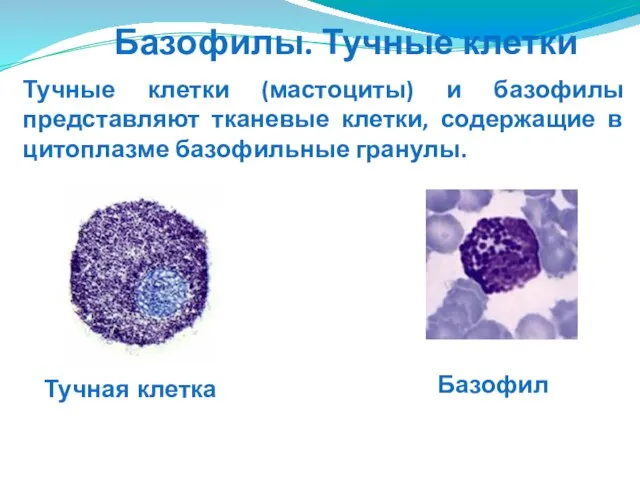
- 92. Тучные клетки (мастоциты) и базофилы представляют тканевые клетки, содержащие в цитоплазме базофильные гранулы. Тучная клетка Базофил
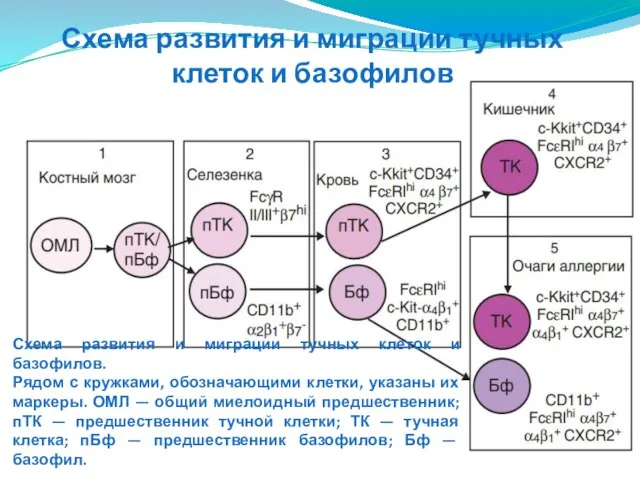
- 93. Схема развития и миграции тучных клеток и базофилов. Рядом с кружками, обозначающими клетки, указаны их маркеры.
- 94. Оба типа клеток имеют костномозговое происхождение и принадлежат к миелоидному ряду. Предполагают, что у тучных клеток
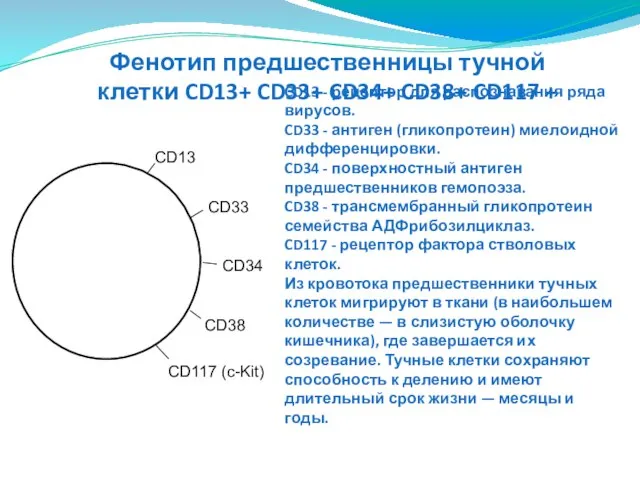
- 95. CD13 - рецептор для распознавания ряда вирусов. CD33 - антиген (гликопротеин) миелоидной дифференцировки. CD34 - поверхностный
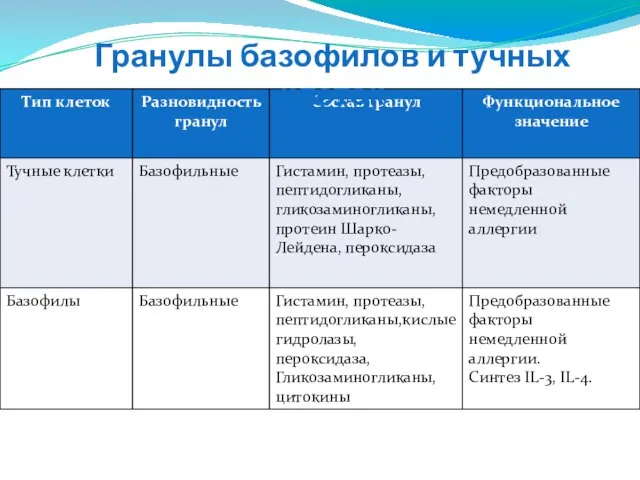
- 96. Гранулы базофилов и тучных клеток
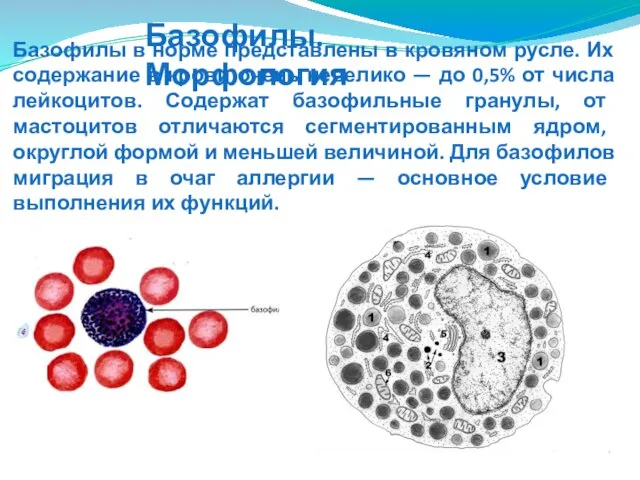
- 97. Базофилы в норме представлены в кровяном русле. Их содержание в крови очень невелико — до 0,5%
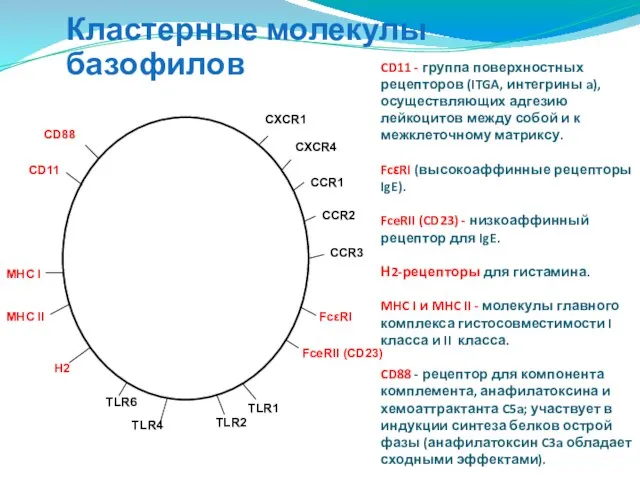
- 98. CD11 - группа поверхностных рецепторов (ITGA, интегрины a), осуществляющих адгезию лейкоцитов между собой и к межклеточному
- 99. Спектр активных веществ, секретируемых базофилами, ограничен: лейкотриен C4, IL-4, IL-13, тромбоксаны простогландины, фактор хемотаксиса эозинофилов и
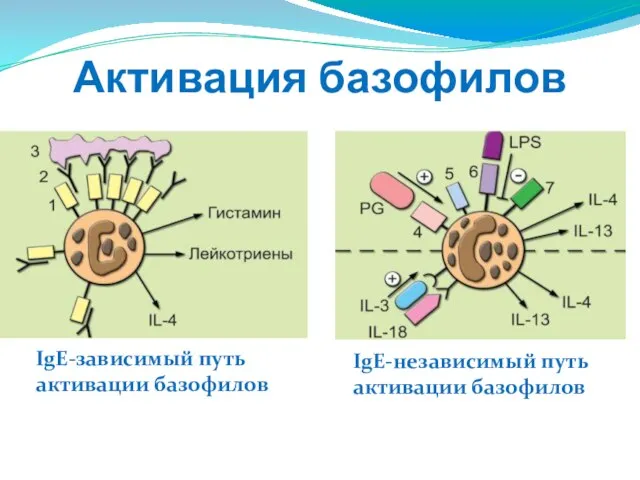
- 100. Активация базофилов IgE-зависимый путь активации базофилов IgE-независимый путь активации базофилов
- 101. IgE-зависимый путь активации базофилов Базофилы экспрессируют высокоаффинный рецептор FcsRI (1), который без участия АГ связывается с
- 102. IgE-независимый путь активации базофила Первый этап - индукция образования IL-4 фактором созревания базофилов цитокином IL-3. При
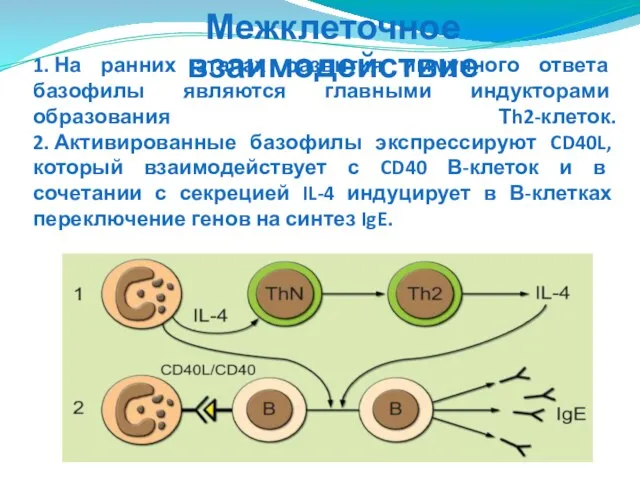
- 103. 1. На ранних этапах развития иммунного ответа базофилы являются главными индукторами образования Тh2-клеток. 2. Активированные базофилы
- 104. -регуляция процессов свертывания крови и проницаемости сосудов -базофилы, как и эозинофилы, участвуют в иммунных воспалительных реакциях
- 105. 1.Развитие базофилов и тучных клеток 2. Гранулы базофилов и тучных клеток, их свойства Базофилы. Тучные клетки
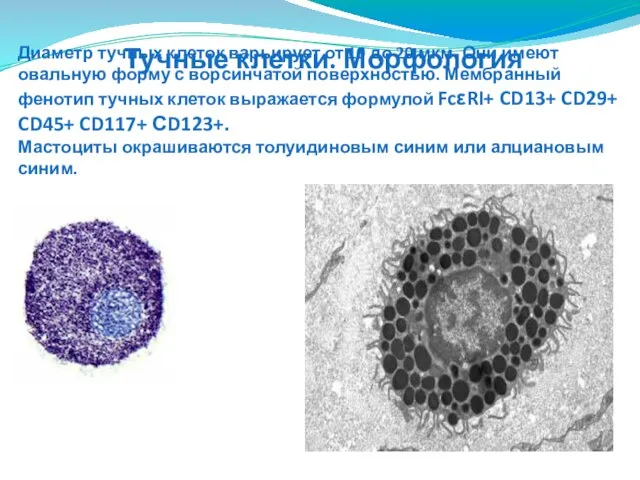
- 106. Диаметр тучных клеток варьирует от 10 до 20 мкм. Они имеют овальную форму с ворсинчатой поверхностью.
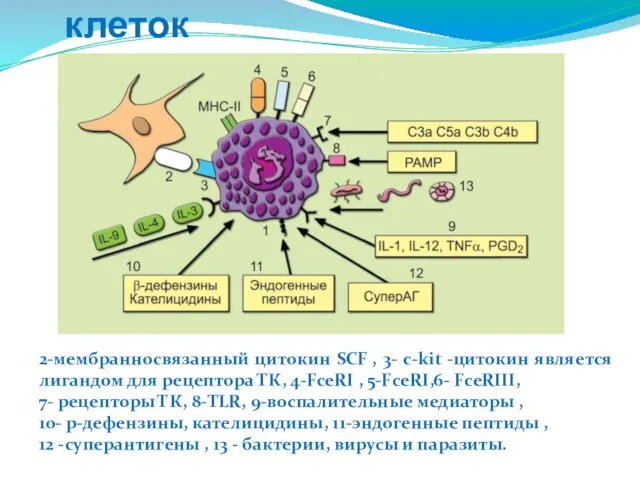
- 107. Характеристика тучных клеток 2-мембранносвязанный цитокин SCF , 3- c-kit -цитокин является лигандом для рецептора ТК, 4-FceRI
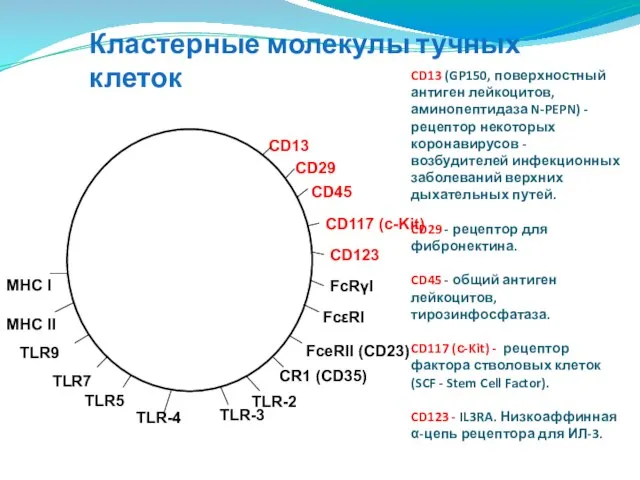
- 108. CD13 (GP150, поверхностный антиген лейкоцитов, аминопептидаза N-PEPN) - рецептор некоторых коронавирусов - возбудителей инфекционных заболеваний верхних
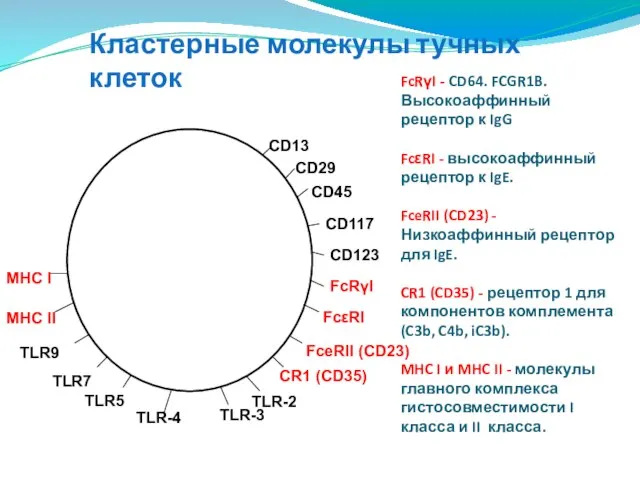
- 109. Кластерные молекулы тучных клеток FcRγI - CD64. FCGR1B. Высокоаффинный рецептор к IgG FcεRI - высокоаффинный рецептор
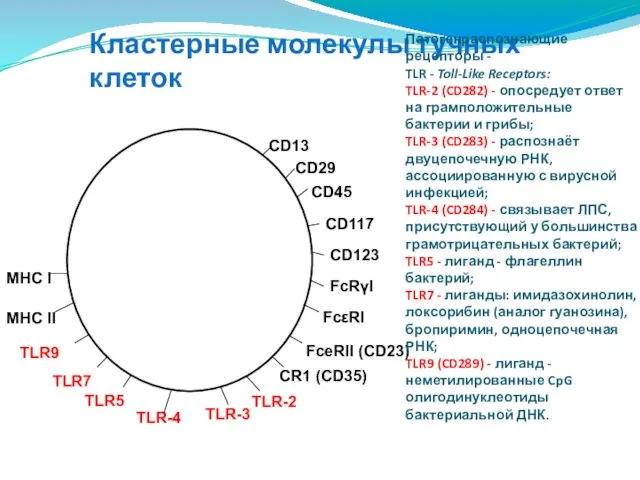
- 110. Кластерные молекулы тучных клеток Патогенраспознающие рецепторы - TLR - Toll-Like Receptors: TLR-2 (CD282) - опосредует ответ
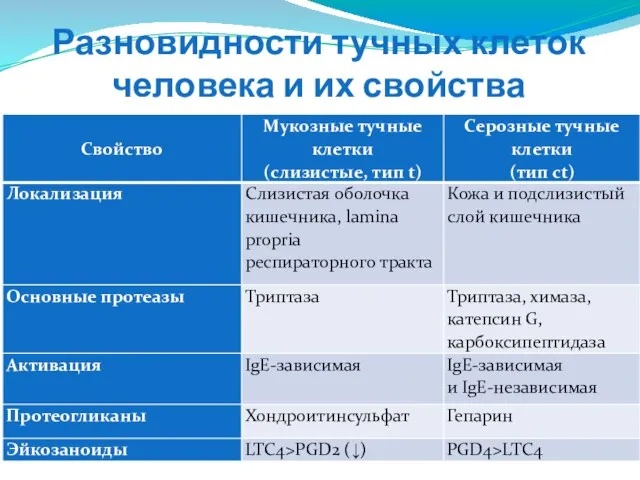
- 111. Разновидности тучных клеток человека и их свойства
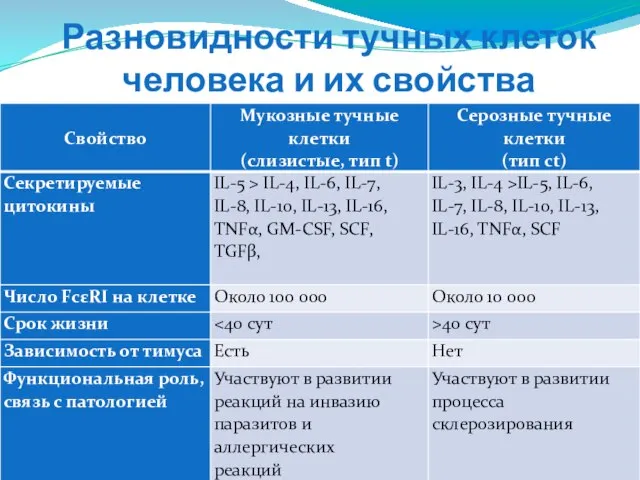
- 112. Разновидности тучных клеток человека и их свойства
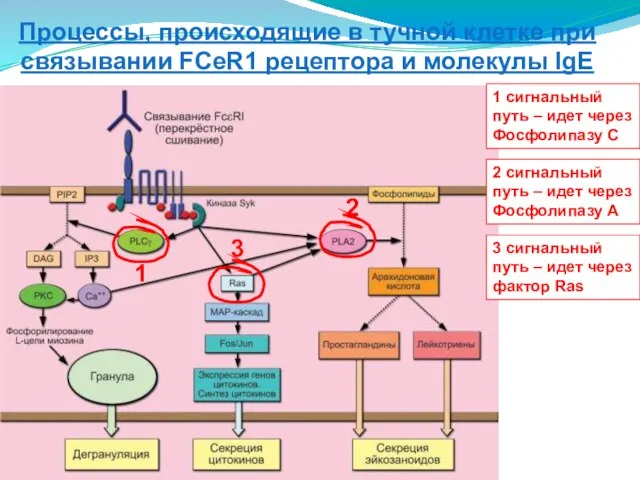
- 113. 1 2 3 1 сигнальный путь – идет через Фосфолипазу С 2 сигнальный путь – идет
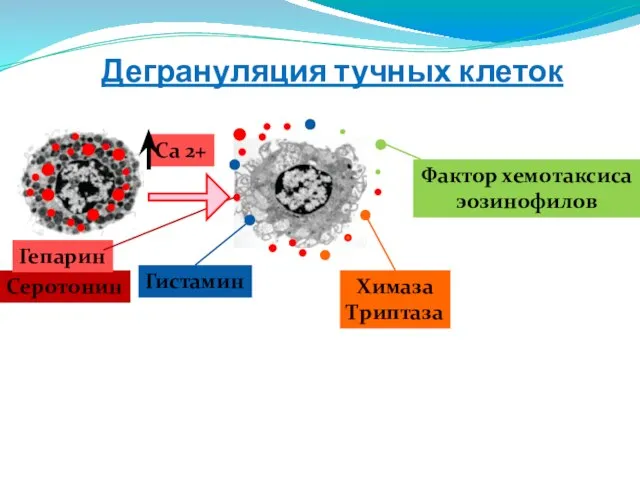
- 114. Дегрануляция тучных клеток Гистамин Химаза Триптаза Са 2+ Серотонин Гепарин Фактор хемотаксиса эозинофилов
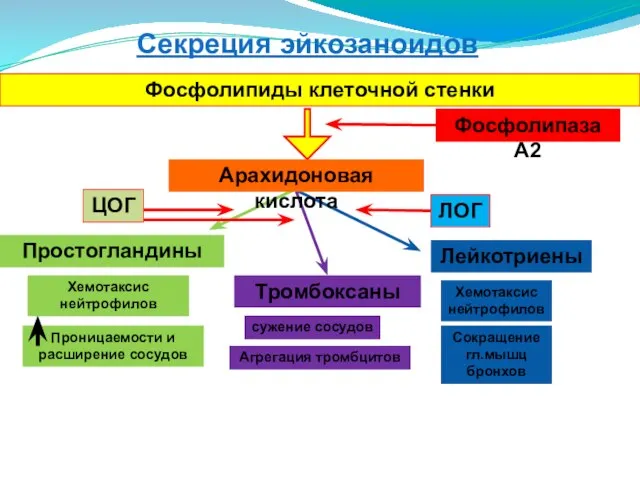
- 115. Секреция эйкозаноидов Фосфолипиды клеточной стенки Фосфолипаза А2 Простогландины Лейкотриены Арахидоновая кислота ЦОГ ЛОГ Тромбоксаны Проницаемости и
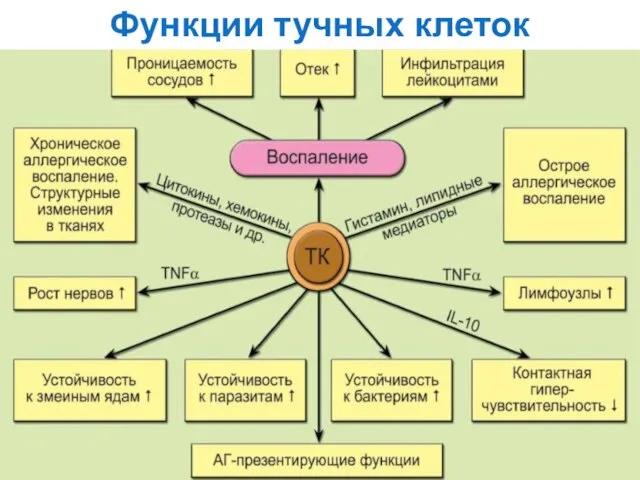
- 116. 1) Участие в реакциях воспаления (гистамин, гепарин): повышение проницаемости сосудов, образование отёка; 2) Участие в аллергических
- 117. Функции тучных клеток
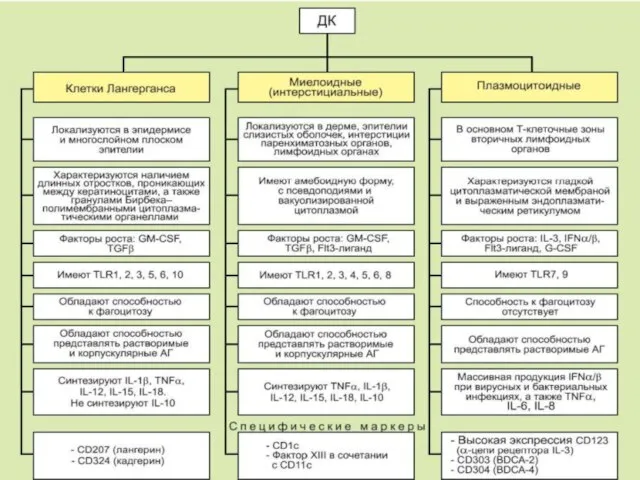
- 118. Дендритные клетки (ДК) Это специализированные антигенпрезентирующие лейкоциты, способные активировать как наивные Т-клетки, так и Т-клетки памяти
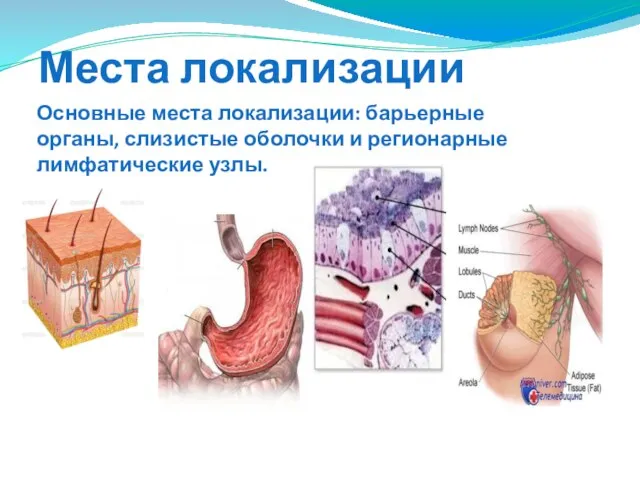
- 119. Места локализации Основные места локализации: барьерные органы, слизистые оболочки и регионарные лимфатические узлы.
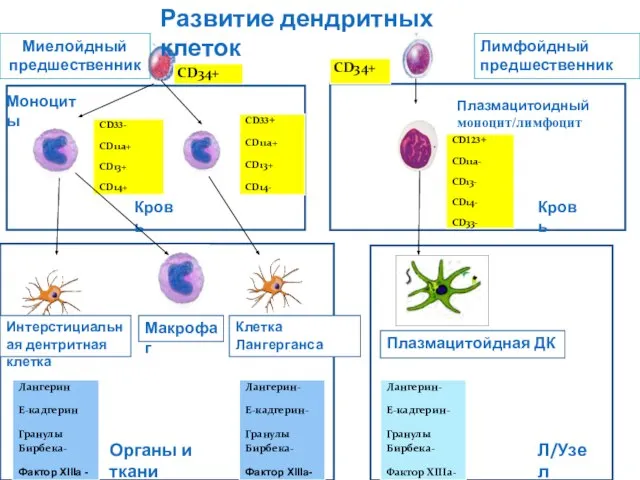
- 120. Макрофаг Лимфойдный предшественник Моноциты Плазмацитоидный моноцит/лимфоцит Кровь Кровь Интерстициальная дентритная клетка Макрофаг Клетка Лангерганса Плазмацитойдная ДК
- 121. Миелоидные ДК и макрофаги Миелоидные ДК и макрофаги имеют общего костномозгового предшественника, несущего маркер CD34 (молекула
- 122. Плазмацитоидные ДК Плазмацитоидные ДК также происходят из CD34 позитивного предшественника. Внешне походи на плазматические клетки. У
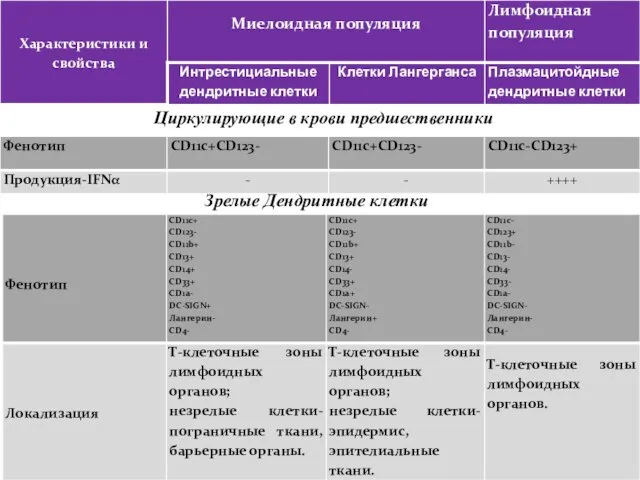
- 123. Циркулирующие в крови предшественники Зрелые Дендритные клетки
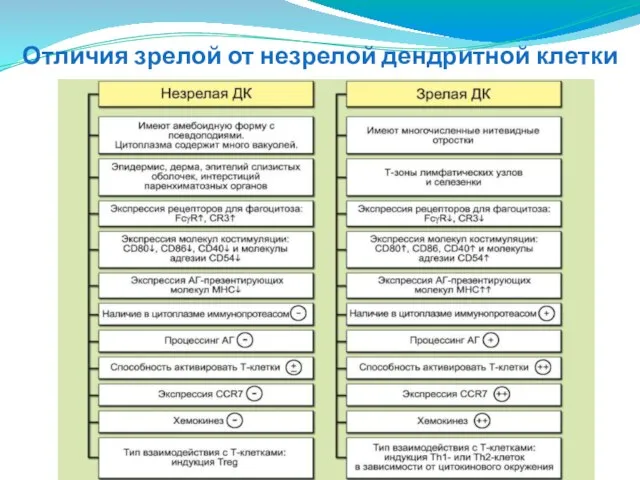
- 125. Отличия зрелой от незрелой дендритной клетки
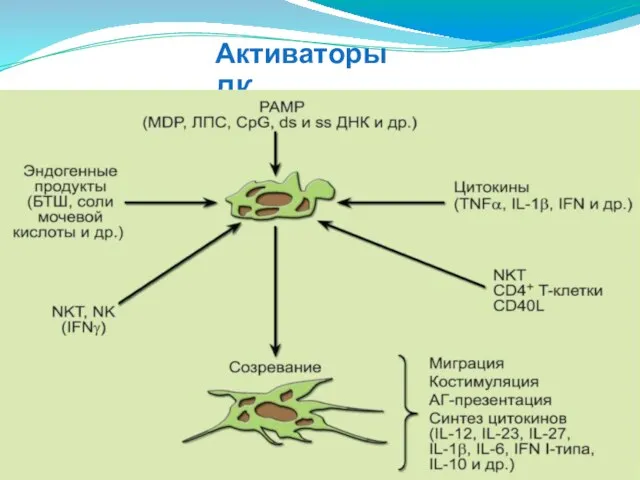
- 126. Активаторы ДК
- 127. Миграция ДК В зависимости от степени созревания, ДК клетки будут проявлять различную фагоцитарную активность. Незрелые ДК
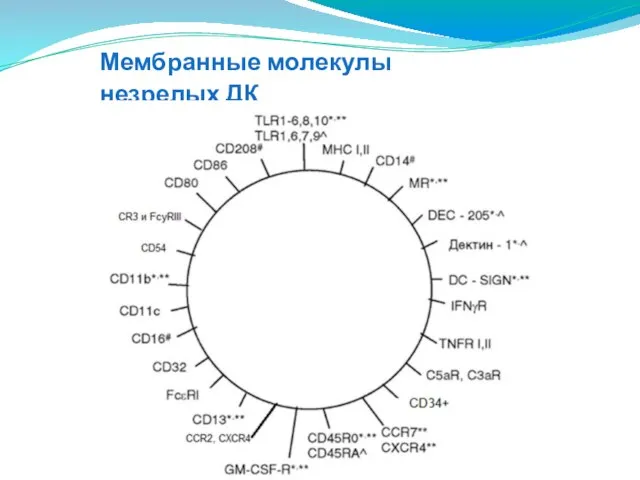
- 128. Мембранные молекулы незрелых ДК
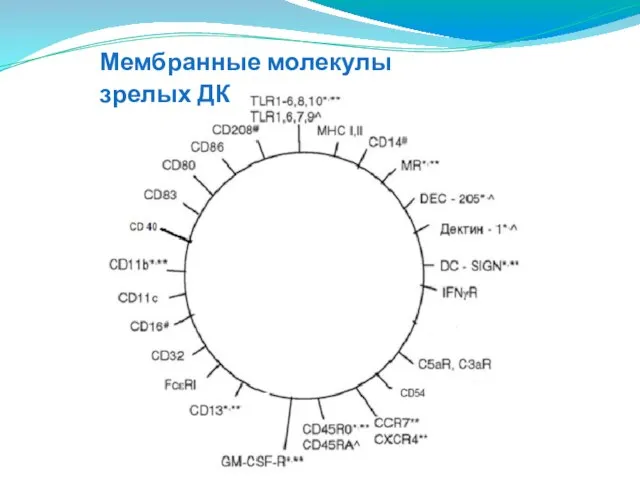
- 129. Мембранные молекулы зрелых ДК
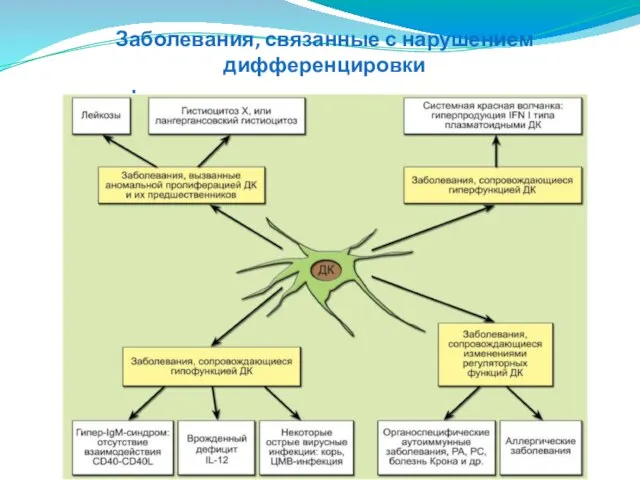
- 130. Заболевания, связанные с нарушением дифференцировки и функционирования дендритных клеток
- 131. NK-клетки 1.Развитие NK-клеток 2.Морфология NK-клеток 3.Гранулы NK-клеток 4.Кластерные молекулы NK-клеток 5.Функции NK-клеток 6. Эффекторные функции NK-клеток.
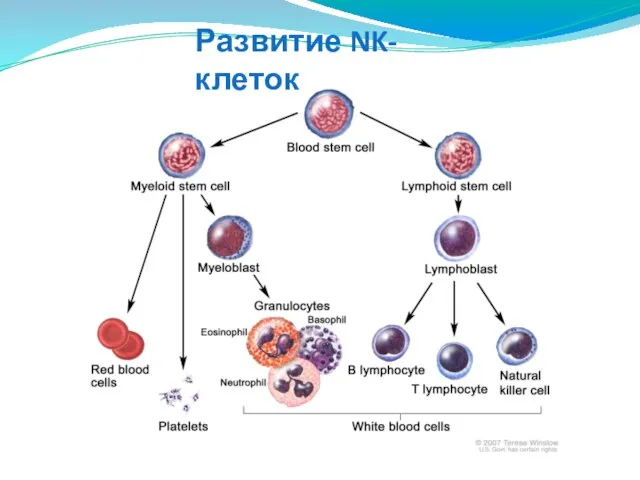
- 132. Развитие NK-клеток
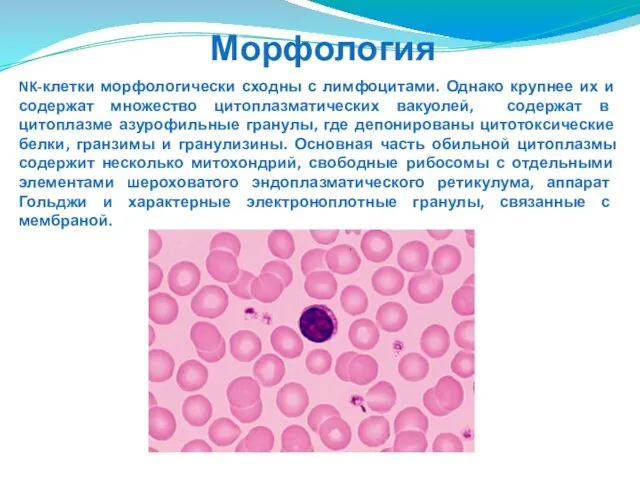
- 133. NK-клетки морфологически сходны с лимфоцитами. Однако крупнее их и содержат множество цитоплазматических вакуолей, содержат в цитоплазме
- 134. Гранулы Перфорин представляет собой белок с высокой молекулярной массой. На поверхности клетки мишени образуется гомополимер, повышающий
- 135. Гранулы Гранулизин - апсониноподобный положительно заряженный белок с молекулярной массой 9 kDa. Положительно заряженный гранулизин внедряется
- 136. Гранулы Гранзимы - протеазы химотрипсинового типа основной эффект гранзимов В активация протеазы – каспазы, нарушение целостности
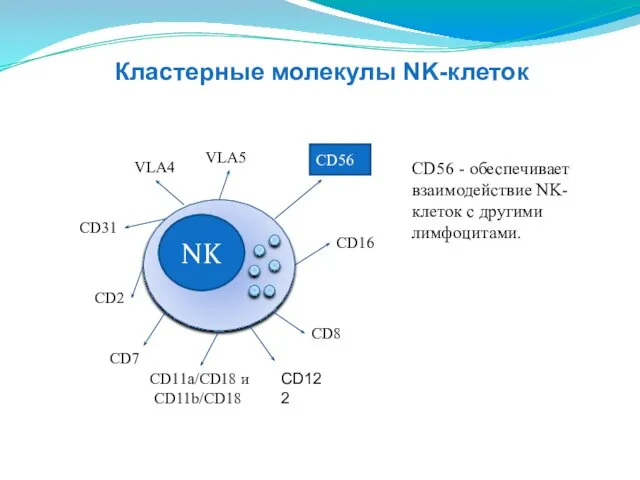
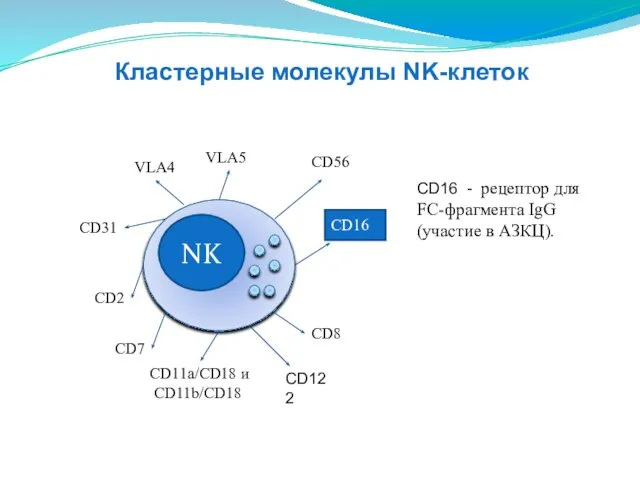
- 137. NK CD16 CD8 CD2 CD11a/CD18 и CD11b/CD18 СD31 VLA4 VLA5 СD56 СD56 - обеспечивает взаимодействие NK-клеток
- 138. NK CD8 CD2 CD11a/CD18 и CD11b/CD18 СD31 VLA4 VLA5 СD56 CD16 CD16 - рецептор для FC-фрагмента
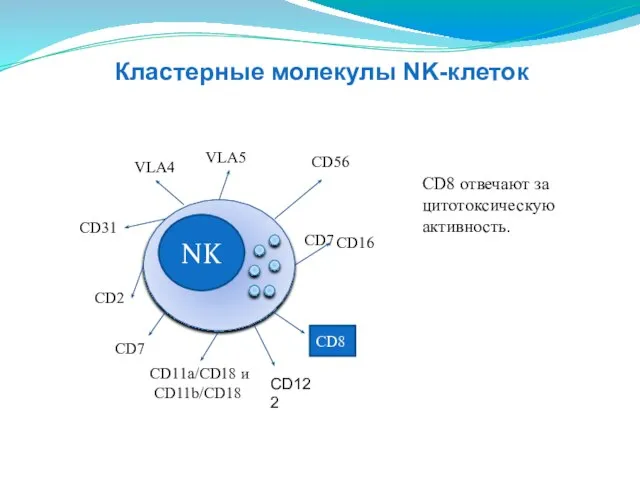
- 139. NK CD16 CD2 CD11a/CD18 и CD11b/CD18 СD31 VLA4 VLA5 СD56 CD8 CD8 отвечают за цитотоксическую активность.
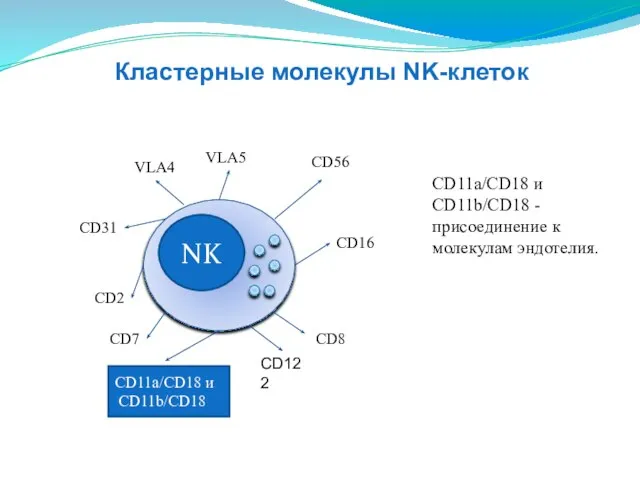
- 140. NK CD16 CD2 СD31 VLA4 VLA5 СD56 CD8 CD11a/CD18 и CD11b/CD18 CD11a/CD18 и CD11b/CD18 - присоединение
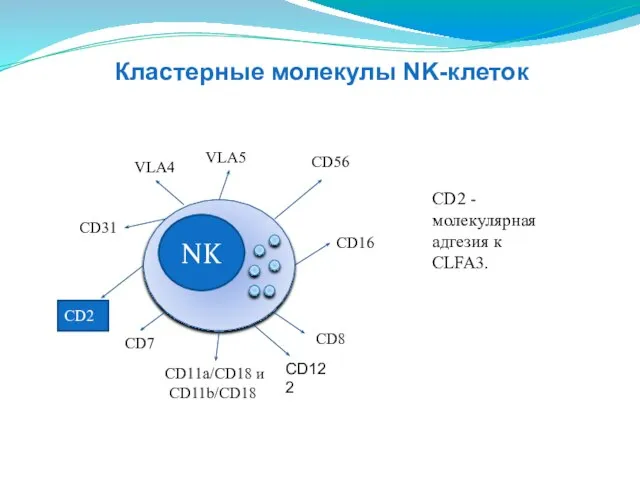
- 141. NK CD16 CD11a/CD18 и CD11b/CD18 СD31 VLA4 VLA5 СD56 CD8 CD2 CD2 - молекулярная адгезия к
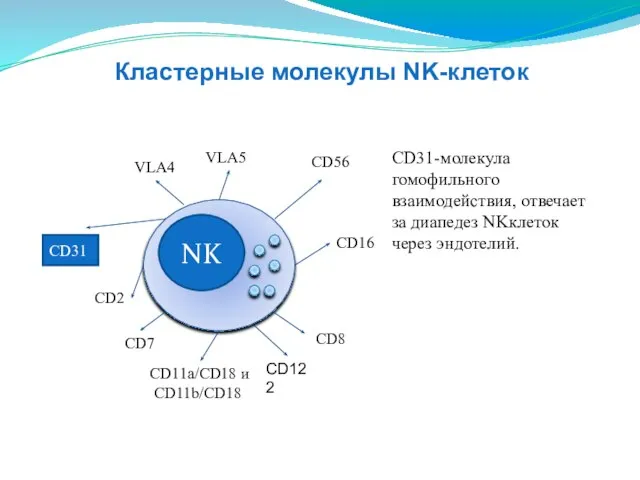
- 142. NK CD16 CD2 CD11a/CD18 и CD11b/CD18 VLA4 VLA5 СD56 CD8 СD31 СD31-молекула гомофильного взаимодействия, отвечает за
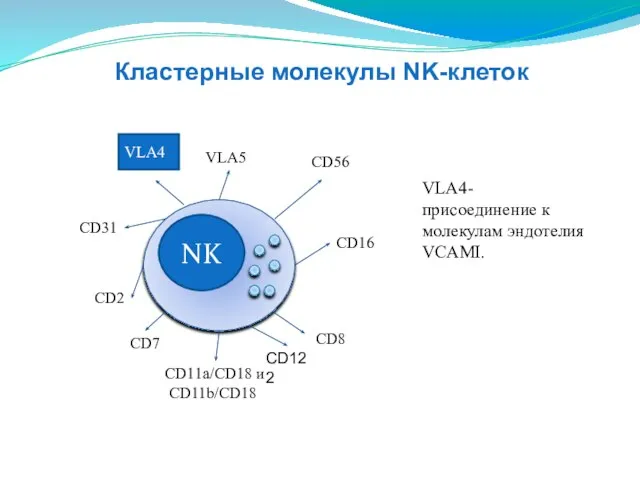
- 143. NK CD16 CD2 CD11a/CD18 и CD11b/CD18 СD31 VLA5 СD56 CD8 VLA4 VLA4-присоединение к молекулам эндотелия VCAMI.
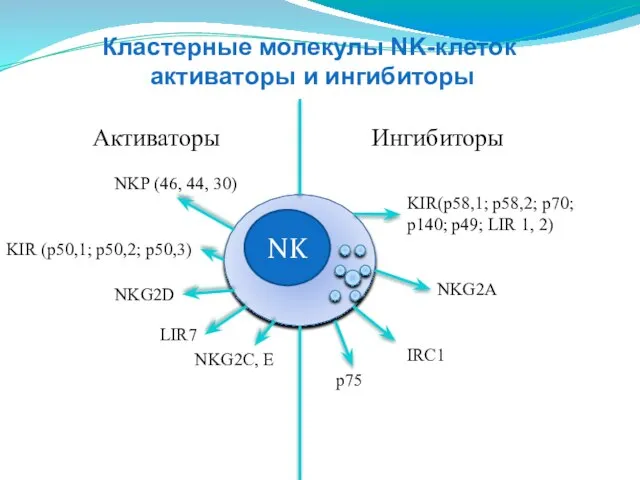
- 144. NK Активаторы Ингибиторы NKP (46, 44, 30) KIR (p50,1; p50,2; p50,3) NKG2D NKG2C, E KIR(p58,1; p58,2;
- 145. Регуляция процессов пролиферации, дифференцировки и элиминации стареющих соматических клеток организма Модуляция клеток врожденного иммунитета Супрессия или
- 146. Созревание предшественников CTL Генерация вирус-специфических CTL Созревание претимоцитов и тимоцитов Функции NK-клеток
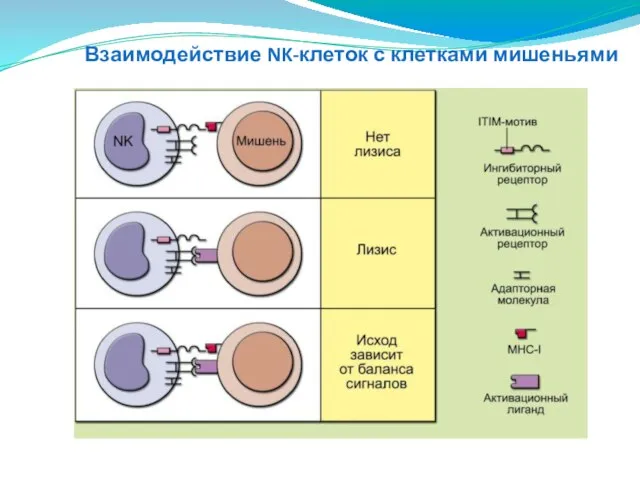
- 147. Взаимодействие NK-клеток с клетками мишеньями
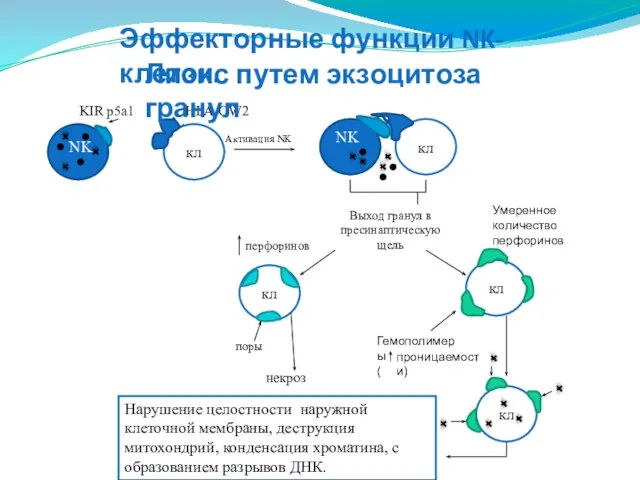
- 148. NK KIR p5a1 кл HLA-CW2 Активация NK кл NK Выход гранул в пресинаптическую щель кл поры
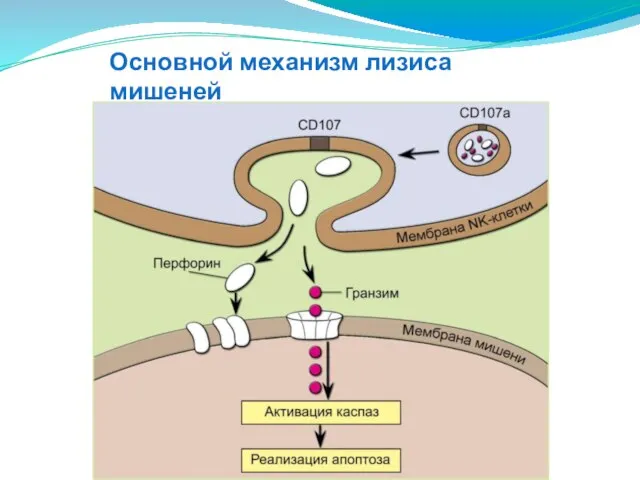
- 149. Основной механизм лизиса мишеней
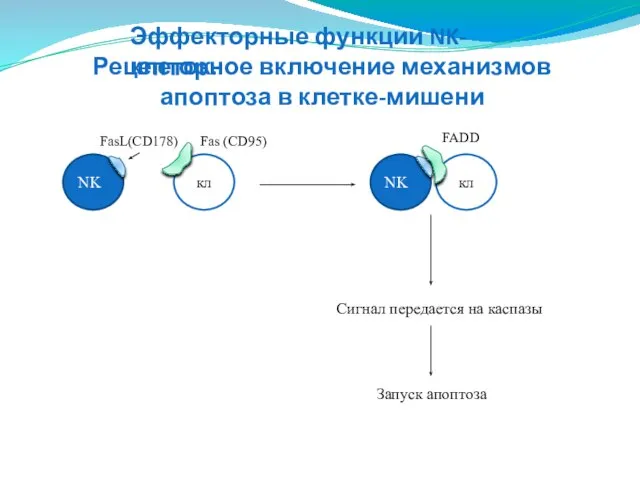
- 150. NK кл FasL(CD178) Fas (CD95) NK кл FADD Сигнал передается на каспазы Запуск апоптоза Рецепторное включение
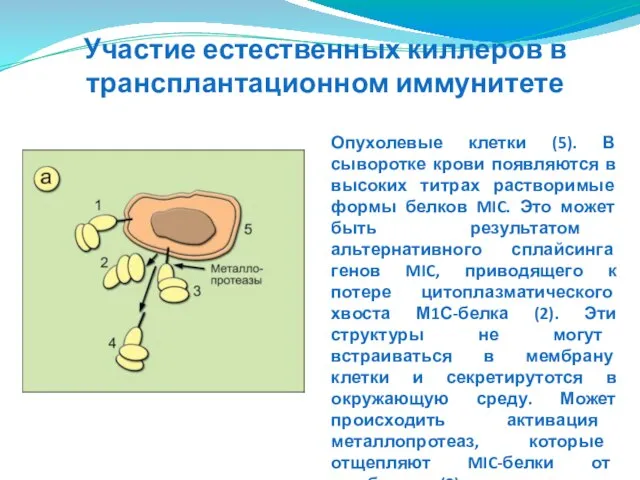
- 151. Опухолевые клетки (5). В сыворотке крови появляются в высоких титрах растворимые формы белков MIC. Это может
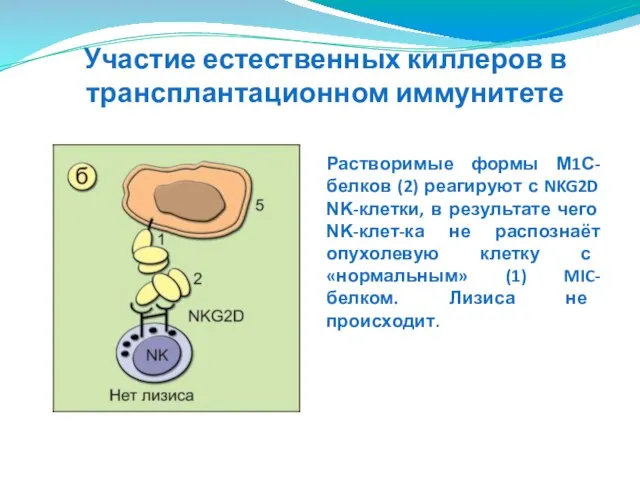
- 152. Растворимые формы М1С-белков (2) реагируют с NKG2D ΝΚ-клетки, в результате чего ΝΚ-клет-ка не распознаёт опухолевую клетку
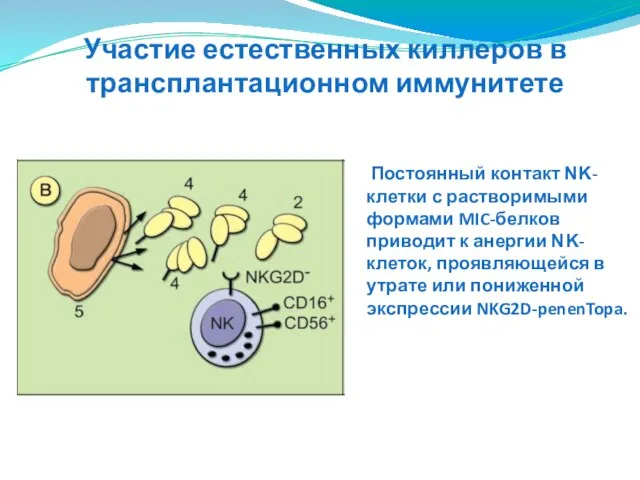
- 153. Постоянный контакт ΝΚ-клетки с растворимыми формами MIC-белков приводит к анергии ΝΚ-клеток, проявляющейся в утрате или пониженной
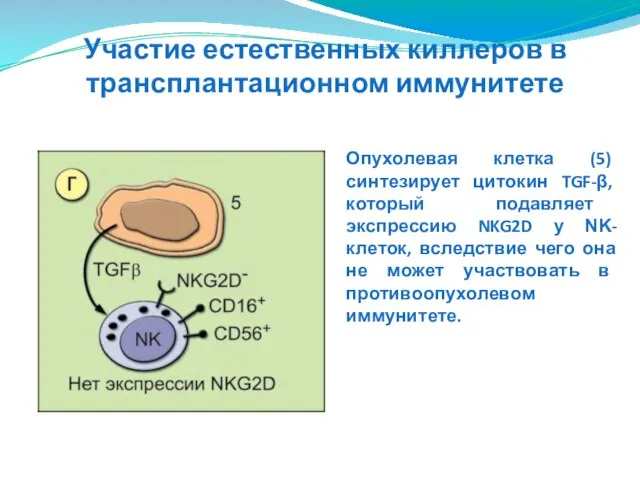
- 154. Опухолевая клетка (5) синтезирует цитокин TGF-β, который подавляет экспрессию NKG2D у ΝΚ-клеток, вследствие чего она не
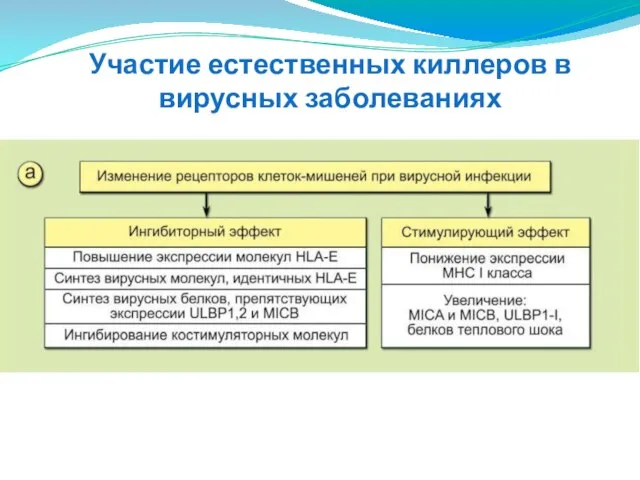
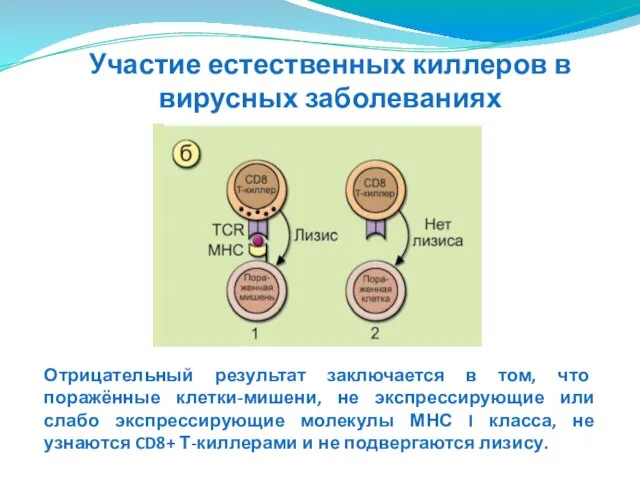
- 155. Участие естественных киллеров в вирусных заболеваниях
- 156. Отрицательный результат заключается в том, что поражённые клетки-мишени, не экспрессирующие или слабо экспрессирующие молекулы МНС I
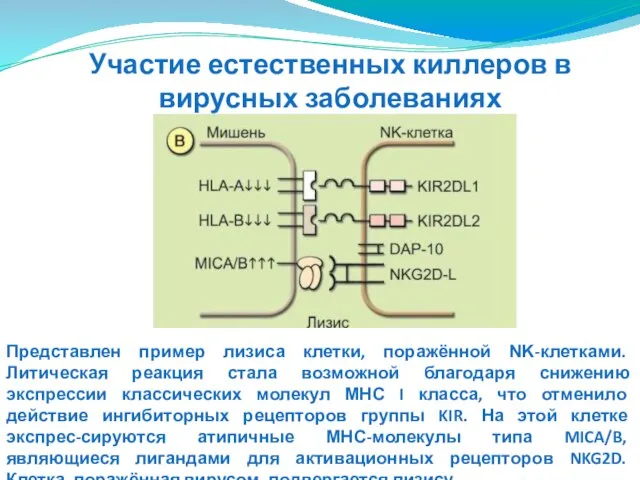
- 157. Представлен пример лизиса клетки, поражённой ΝΚ-клетками. Литическая реакция стала возможной благодаря снижению экспрессии классических молекул МНС
- 158. NK-клетки выступают в роли в роли LGL клеток. Их функции: Регулируют инвазивный рост трофобласта; В трофобласт
- 159. ГУМОРАЛЬНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА
- 160. ГУМОРАЛЬНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА
- 161. ГУМОРАЛЬНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА Гуморальная составляющая врожденного иммунитета представлена несколькими взаимосвязанными системами – системой комплемента цитокиновой
- 162. Компоненты системы комплемента
- 163. Система комплемента является важным компонентом врождённого иммунитета, играющим большую роль в защите и удалении из организма
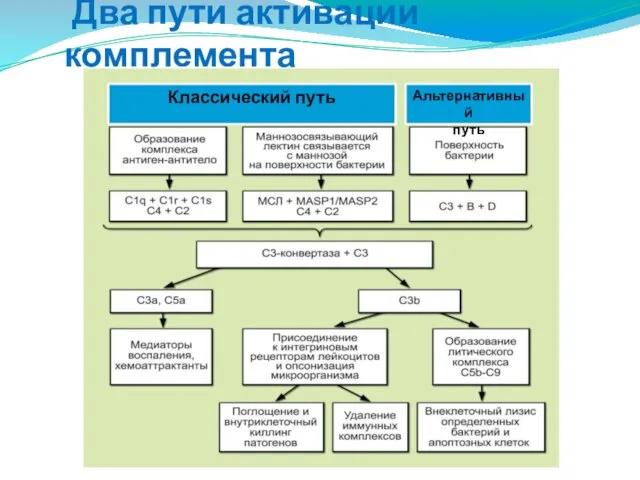
- 164. Два пути активации комплемента Классический путь Альтернативный путь
- 165. Классический путь Альтернативный путь
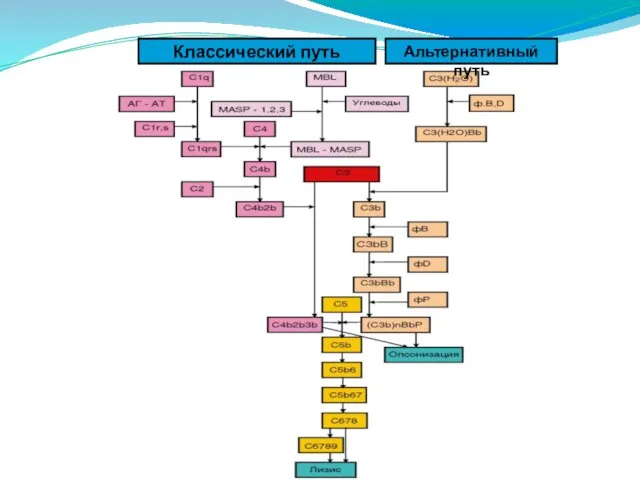
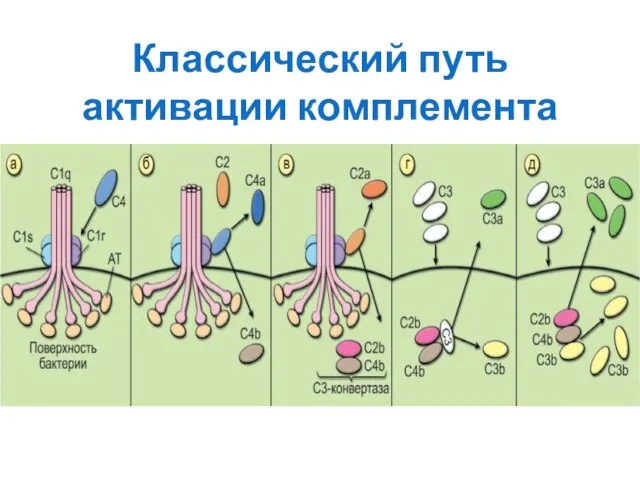
- 166. Классический путь активации комплемента
- 167. А) После присоединения AT класса IgM или некоторых изотипов IgG к поверхности бактериальной клетки у молекулы
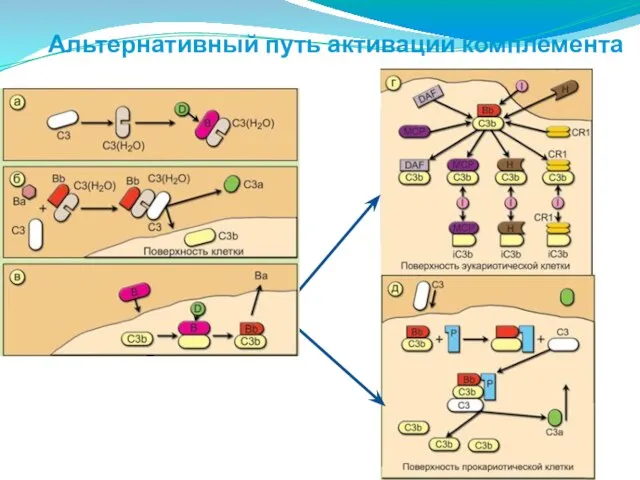
- 168. Альтернативный путь активации комплемента
- 169. Альтернативный путь происходит в отсутствие AT на поверхности микробной клетки, приводя к образованию СЗ-конвертазы. Для его
- 170. В сыворотке крови присутствует сложный белок, относящийся к семейству коллектинов, - маннозасвязывающий лектин (MBL - от
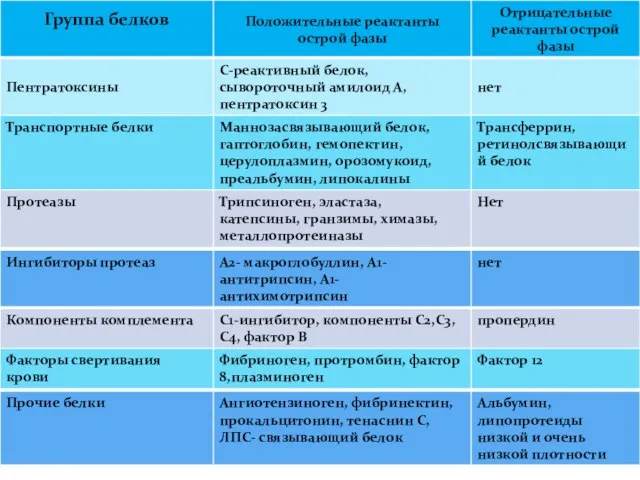
- 171. Белки острой фазы воспаления Белки (реактанты) острой фазы представляют группу протеинов, секретируемых гепатоцитами. При воспалении продукция
- 173. Пентраксины Наиболее полно проявляют свойства реактантов острой фазы белки семейства пентраксинов: в первые 2—3 сут развития
- 174. Пентраксины Короткие петраксины Длинные пентраксины С-реактивный белок Сывороточный амилоид Р РТХ3 (пентраксин 3) Белок PTX3 вырабатывают
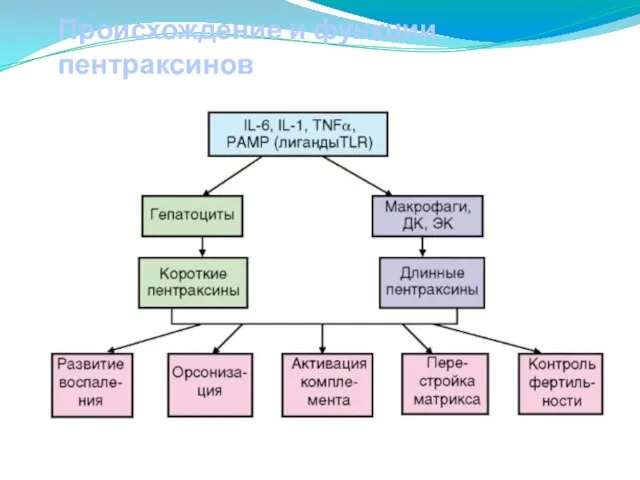
- 175. Происхождение и функции пентраксинов
- 176. Распознавание и связывание РАМР (растворимые патогенраспознающие рецепторы ) Комплемент-активирующая(через Clq) и опсонизирующая функция пентраксинов делает их
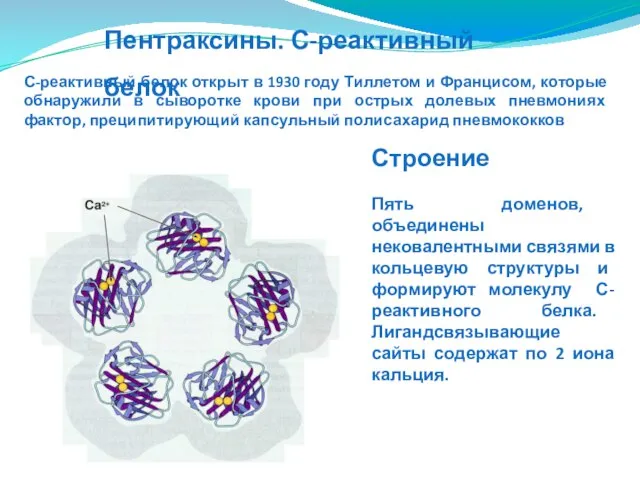
- 177. Пентраксины. С-реактивный белок Строение Пять доменов, объединены нековалентными связями в кольцевую структуры и формируют молекулу С-реактивного
- 178. является предшественником Р-компонента амилоидных фибрилл - постоянной составной части амилоидных депозитов при всех формах амилоидоза в
- 179. Они играют роль переносчиков метаболитов, ионов металлов, физиологически активных факторов. К транспортным белкам относят: преальбумин альбумин
- 180. Протеазы и антипротеазы Другую группу образуют протеазы, активация которых необходима для формирования многих медиаторов воспаления, а
- 181. Цитокины Цитокины –это белковые или полипептидные факторы, лишенные специфичности в отношении антигенов, продуцируемые преимущественно активированными клетками
- 182. Интерфероны Общее свойство интерферонов - наличие у них противовирусной активности. В то же время, подобно другим
- 183. Функции основных интерферонов
- 184. Приобретенный иммунитет
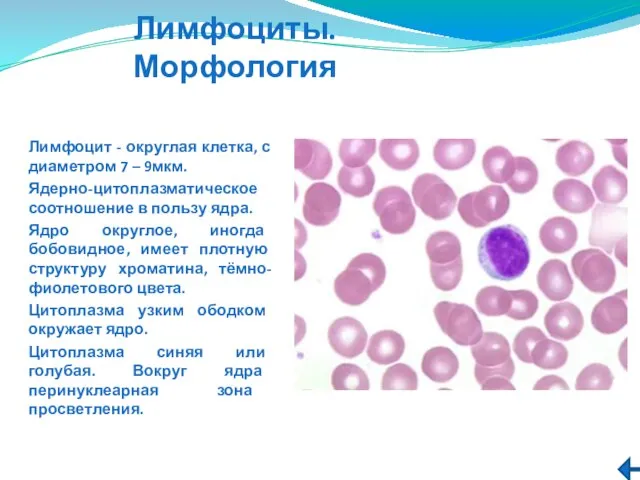
- 186. Лимфоциты.Морфология Лимфоцит - округлая клетка, с диаметром 7 – 9мкм. Ядерно-цитоплазматическое соотношение в пользу ядра. Ядро
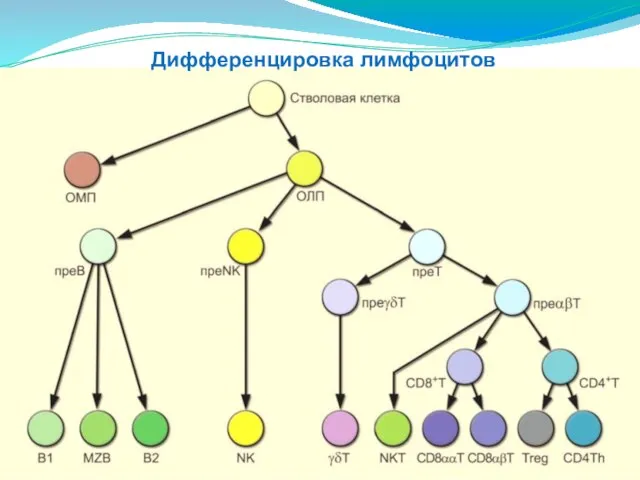
- 187. Дифференцировка лимфоцитов
- 188. Органы иммунной системы Центральные Периферические Костный мозг Тимус Селезенка Аппендикс Пееровые бляшки Печень Лимфоузлы
- 189. Органы иммунной системы Неинкапсулированные MALT (Лимфоидная ткань слизистых оболочек ) GALT (с пищеварительным трактом) Селезенка Тимус
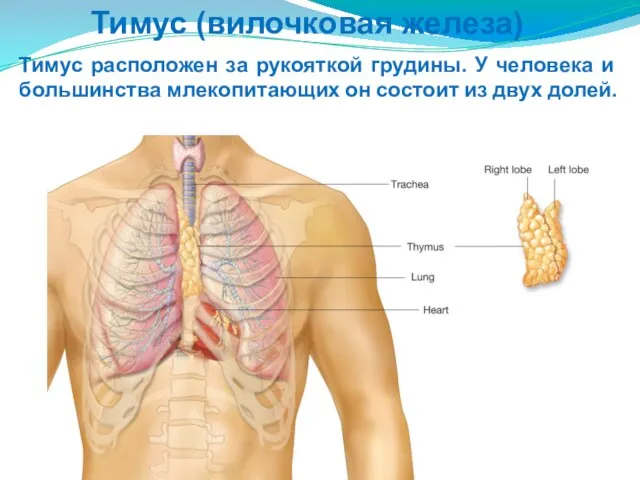
- 190. Тимус (вилочковая железа) Тимус расположен за рукояткой грудины. У человека и большинства млекопитающих он состоит из
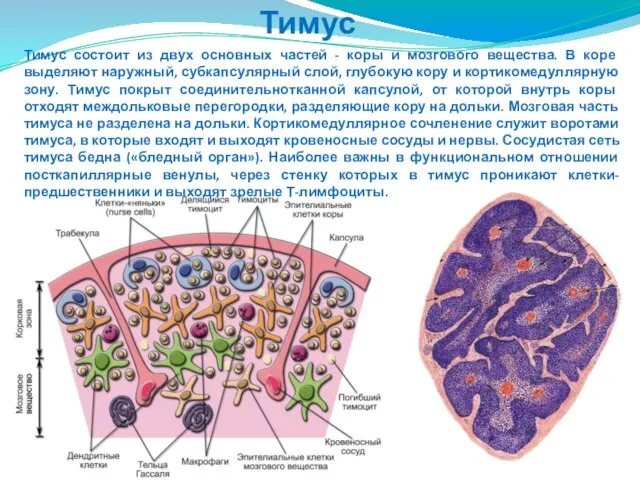
- 191. Тимус Тимус состоит из двух основных частей - коры и мозгового вещества. В коре выделяют наружный,
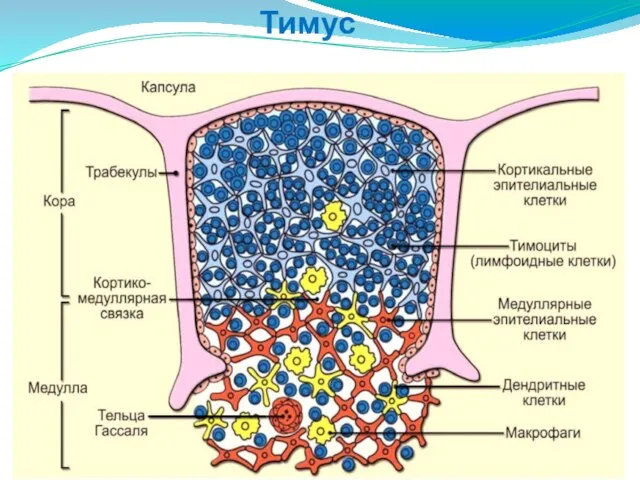
- 192. Тимус
- 193. 1 - корковое вещество; 2 - мозговое вещество; 3 - капсула; 4 - соединительнотканная перегородка (септа);
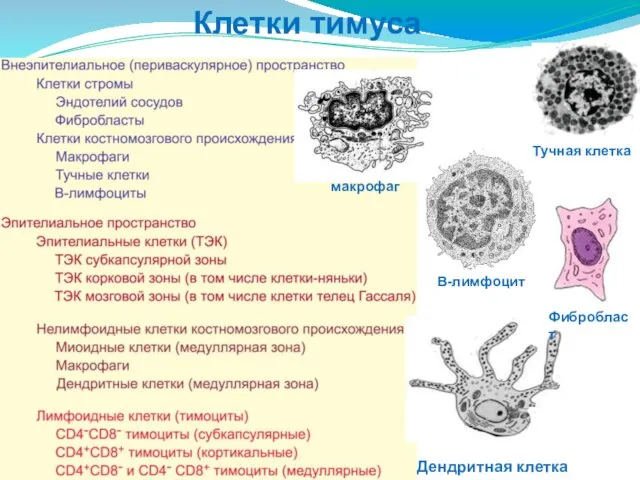
- 194. Клетки тимуса макрофаг В-лимфоцит Тучная клетка Дендритная клетка Фибробласт
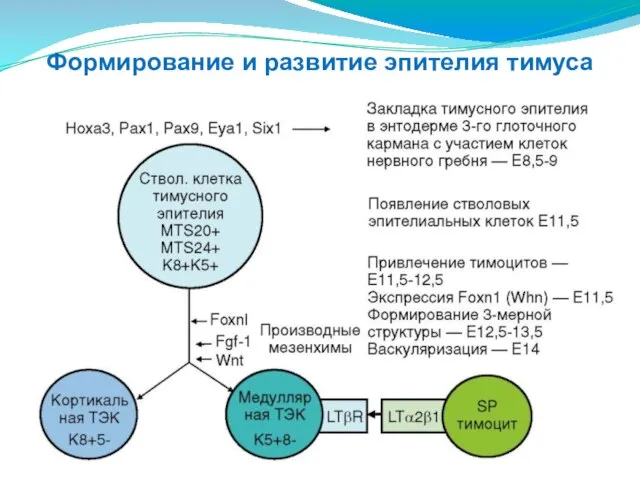
- 195. Формирование и развитие эпителия тимуса
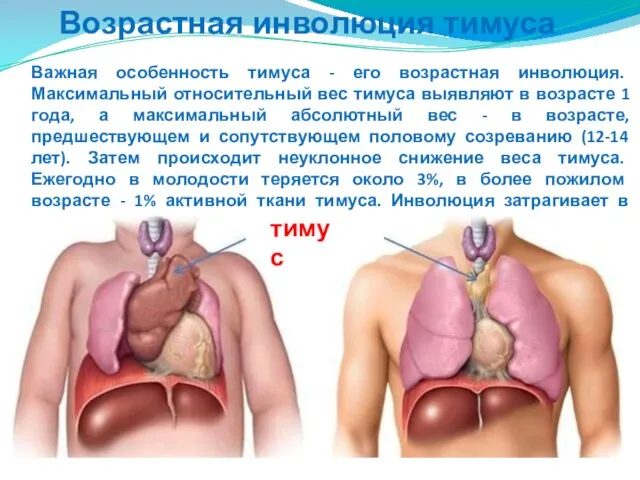
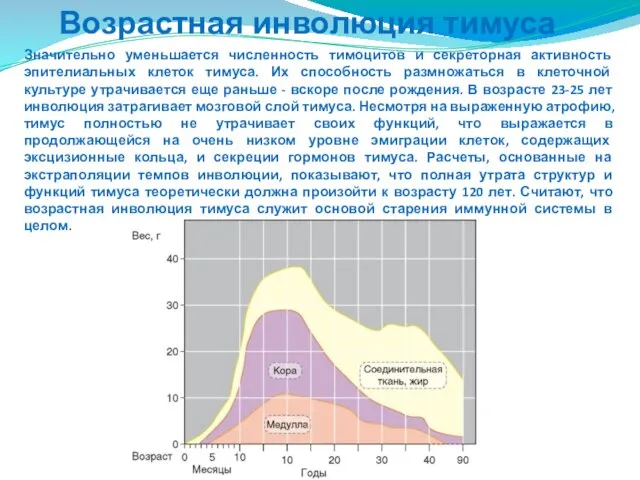
- 196. Возрастная инволюция тимуса Важная особенность тимуса - его возрастная инволюция. Максимальный относительный вес тимуса выявляют в
- 197. Возрастная инволюция тимуса Значительно уменьшается численность тимоцитов и секреторная активность эпителиальных клеток тимуса. Их способность размножаться
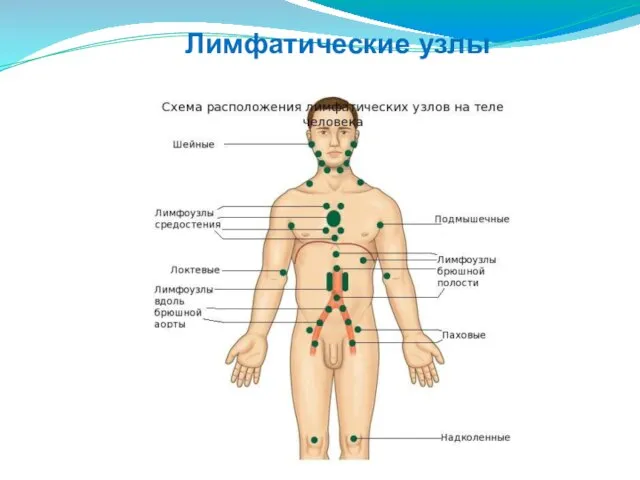
- 198. Лимфатические узлы
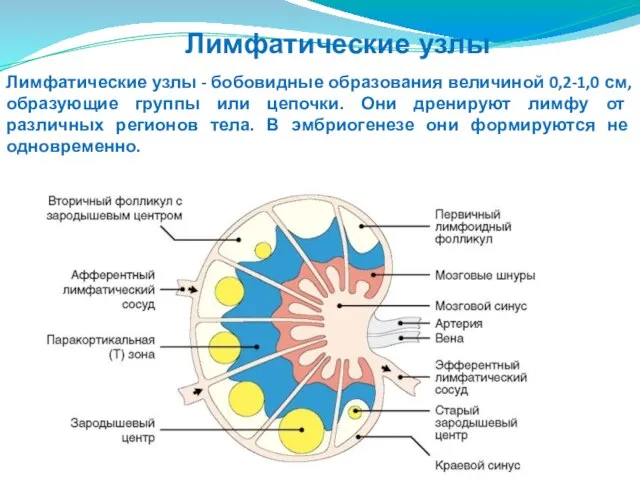
- 199. Лимфатические узлы - бобовидные образования величиной 0,2-1,0 см, образующие группы или цепочки. Они дренируют лимфу от
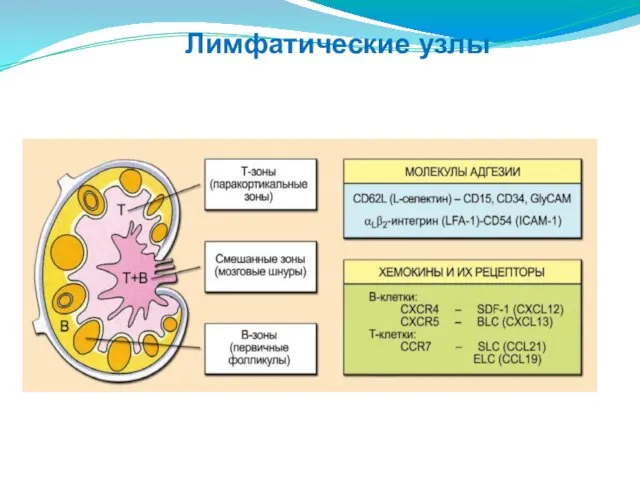
- 200. Лимфатические узлы
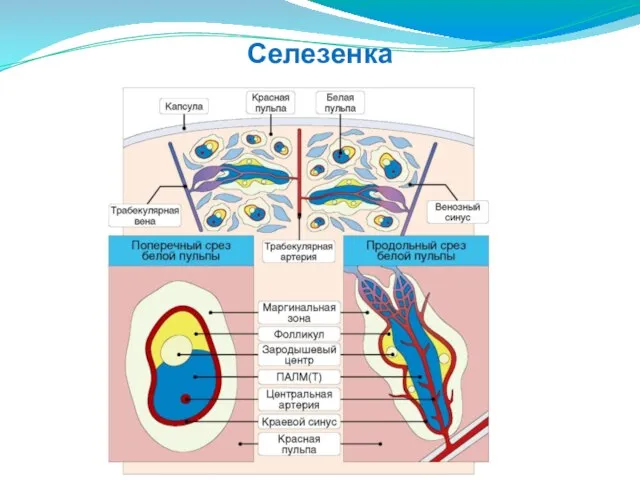
- 201. Селезенка служит иммунным барьером на путях гематогенного распространения патогенов и других чужеродных агентов. Ее функции более
- 202. Селезенка
- 203. Лимфоидная ткань слизистых оболочек MALT GALT (Лимфоидная ткань, ассоциированная с пищ.трактом)
- 204. Т-лимфоциты
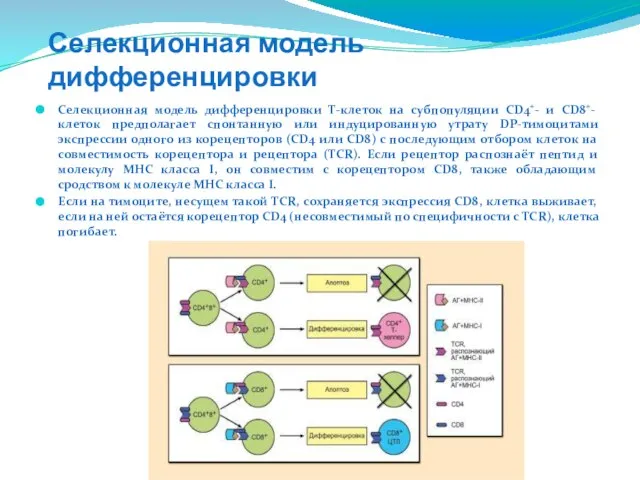
- 205. Селекционная модель дифференцировки Селекционная модель дифференцировки Τ-клеток на субпопуляции CD4+- и CD8+- клеток предполагает спонтанную или
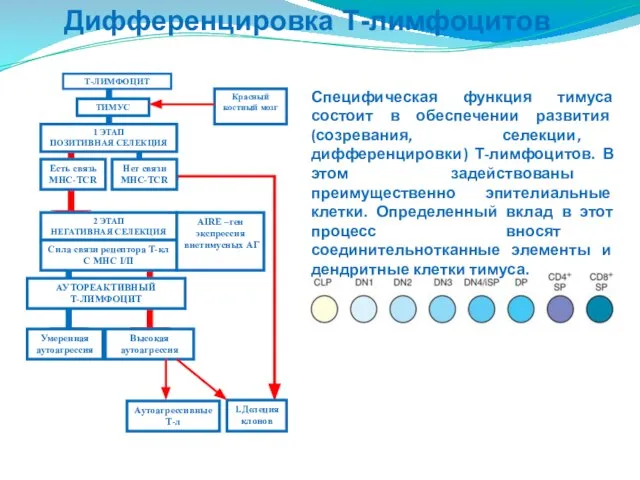
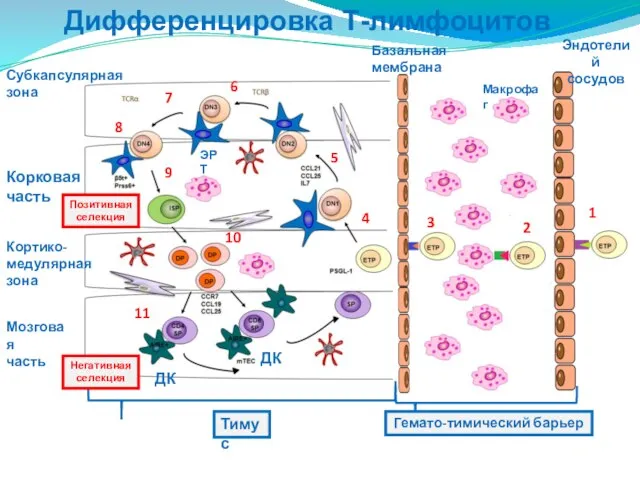
- 206. Дифференцировка Т-лимфоцитов Красный костный мозг ТИМУС 1 ЭТАП ПОЗИТИВНАЯ СЕЛЕКЦИЯ 2 ЭТАП НЕГАТИВНАЯ СЕЛЕКЦИЯ Есть связь
- 207. Дифференцировка Т-лимфоцитов Субкапсулярная зона Корковая часть Кортико- медулярная зона Мозговая часть Позитивная селекция Базальная мембрана Эндотелий
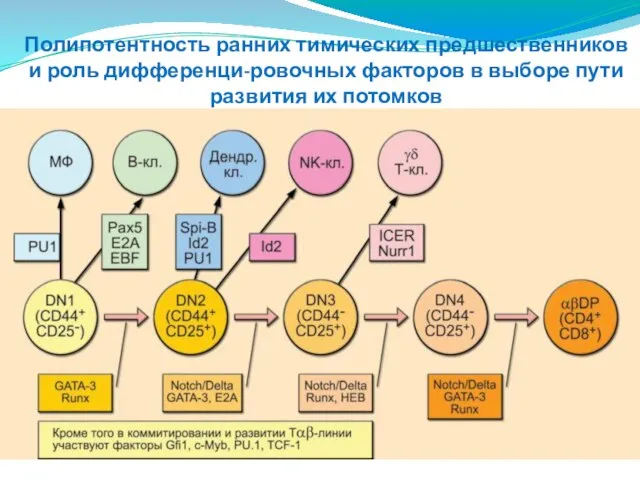
- 208. Полипотентность ранних тимических предшественников и роль дифференци-ровочных факторов в выборе пути развития их потомков
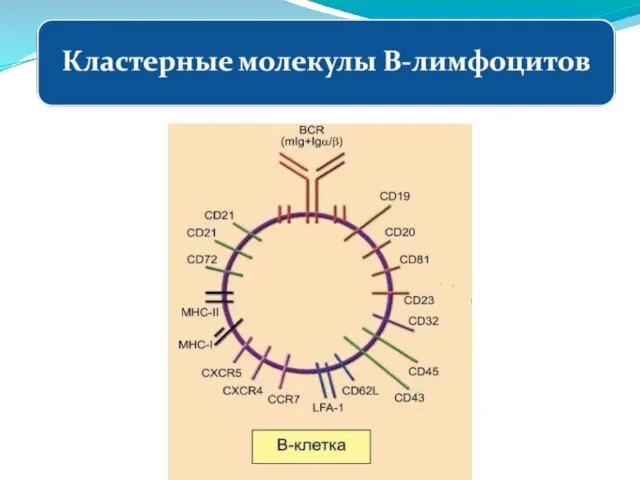
- 209. Кластерные молекулы Т-лмфоцитов Популяции Т- и В-клеток имеют клональную структуру: в процессе дифференцировки каждая клетка приобретает
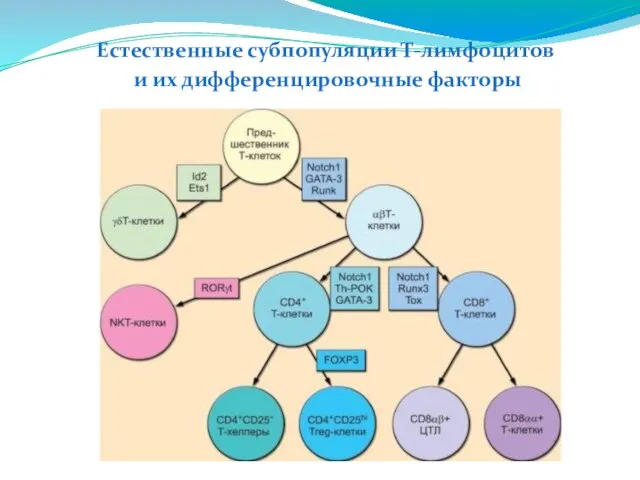
- 210. Естественные субпопуляции Т-лимфоцитов и их дифференцировочные факторы
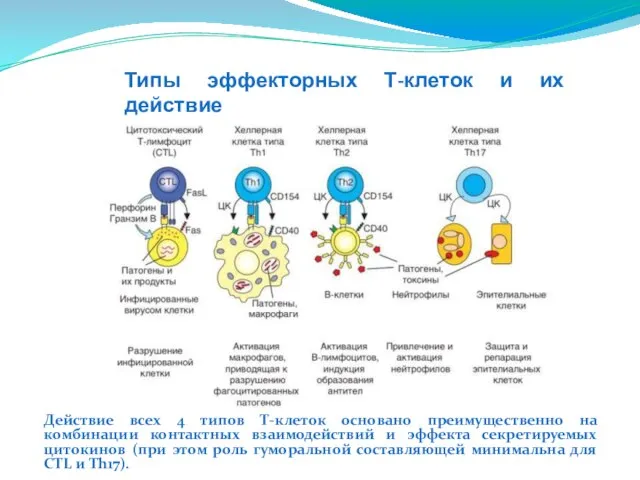
- 211. Типы эффекторных Т-клеток и их действие Действие всех 4 типов Т-клеток основано преимущественно на комбинации контактных
- 212. СD 4+ клетки
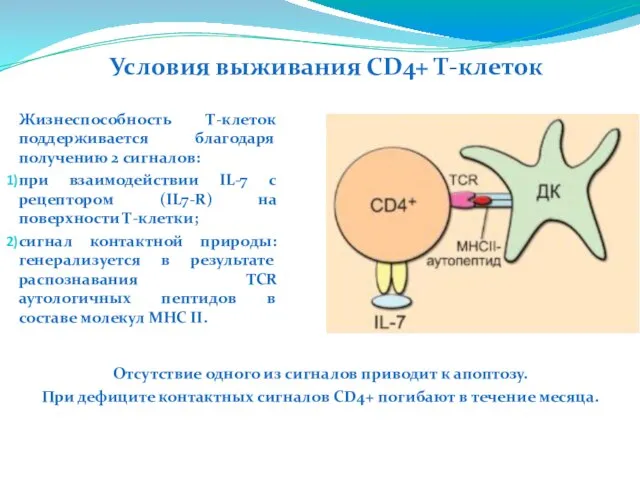
- 213. Жизнеспособность Т-клеток поддерживается благодаря получению 2 сигналов: при взаимодействии IL-7 с рецептором (IL7-R) на поверхности Т-клетки;
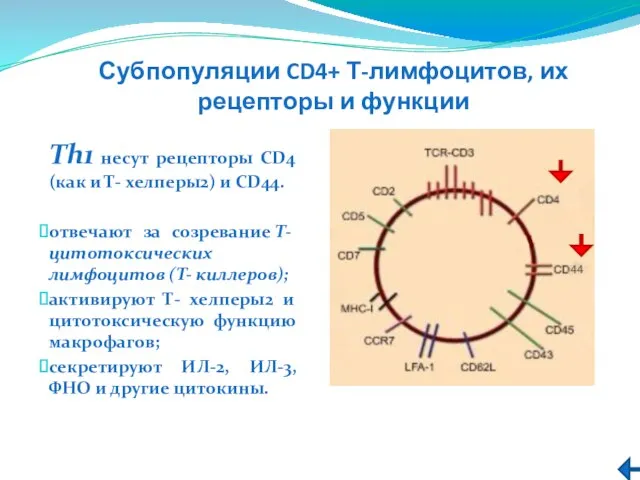
- 214. Субпопуляции CD4+ Т-лимфоцитов, их рецепторы и функции Тh1 несут рецепторы CD4 (как и Т- хелперы2) и
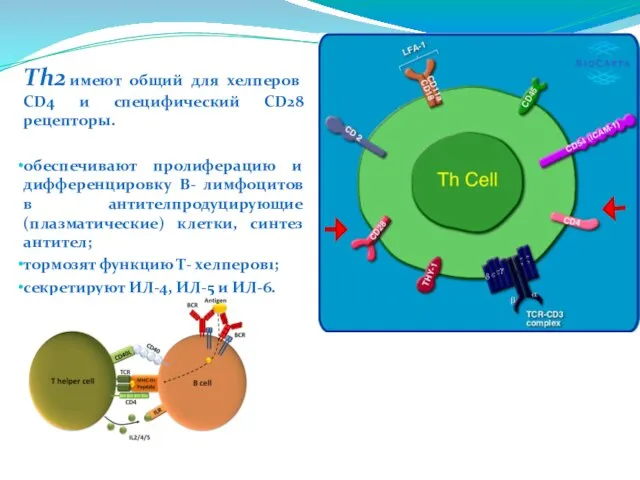
- 215. Тh2 имеют общий для хелперов CD4 и специфический CD28 рецепторы. обеспечивают пролиферацию и дифференцировку В- лимфоцитов
- 216. Маркерные цитокины и рецепторы Th1- и Th2-клеток
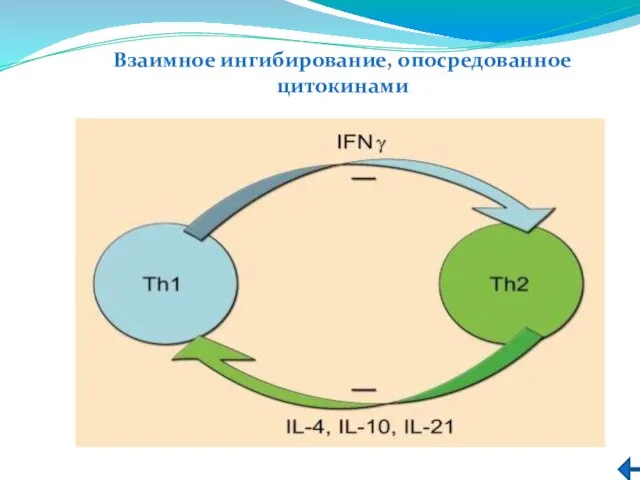
- 217. Взаимное ингибирование, опосредованное цитокинами
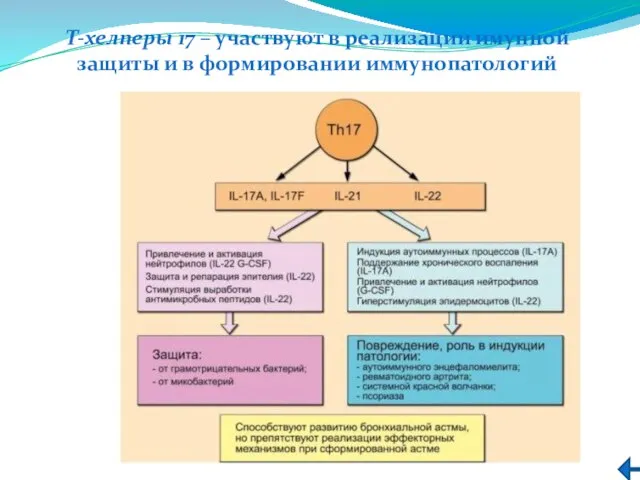
- 218. T-хелперы 17 – участвуют в реализации имунной защиты и в формировании иммунопатологий
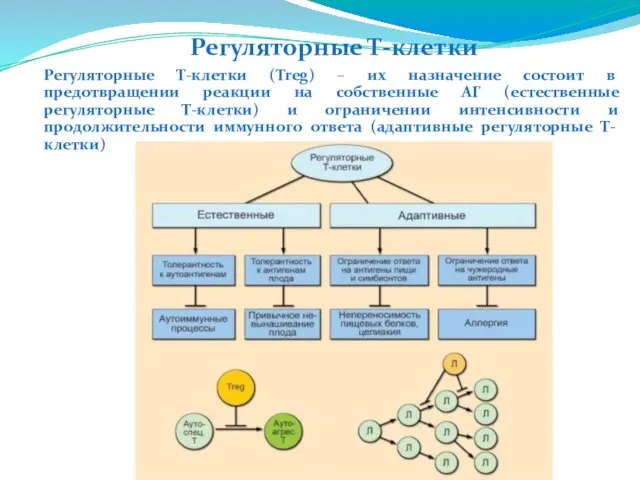
- 219. Регуляторные Т-клетки (Treg) – их назначение состоит в предотвращении реакции на собственные АГ (естественные регуляторные Т-клетки)
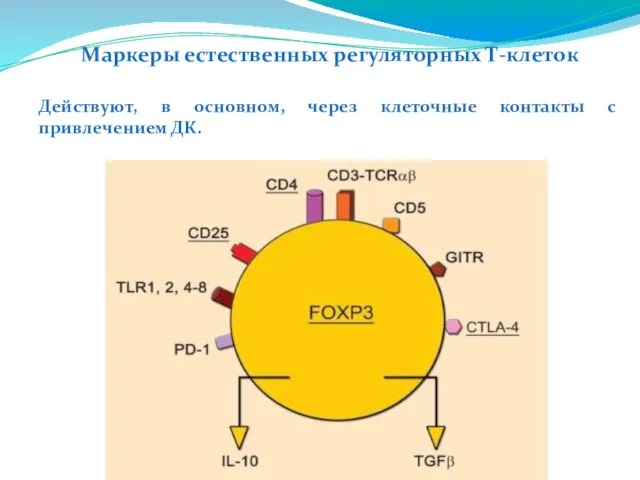
- 220. Маркеры естественных регуляторных Т-клеток Действуют, в основном, через клеточные контакты с привлечением ДК.
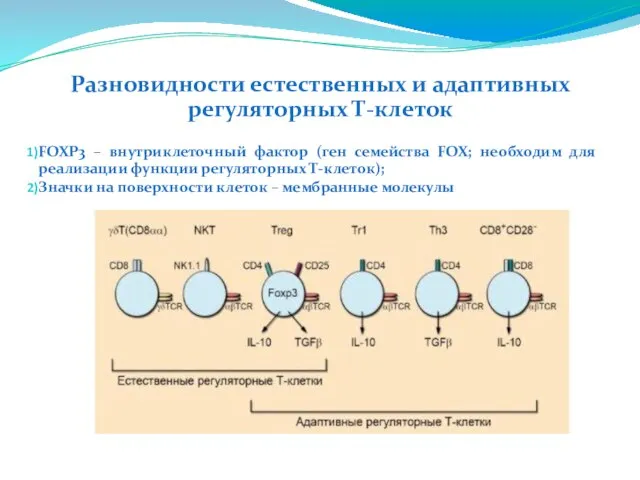
- 221. Разновидности естественных и адаптивных регуляторных Т-клеток FOXP3 – внутриклеточный фактор (ген семейства FOX; необходим для реализации
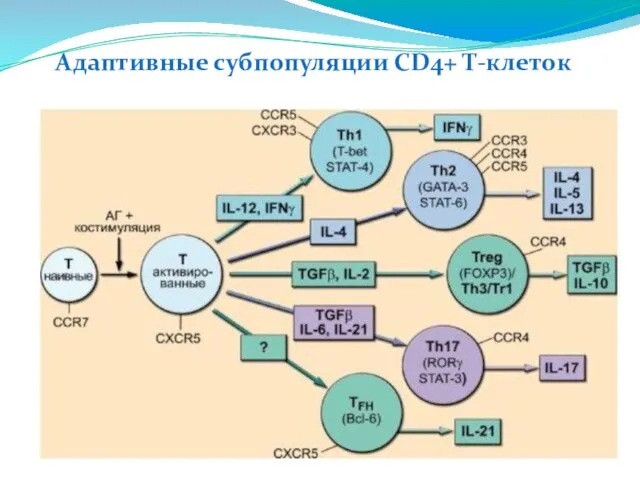
- 222. Адаптивные субпопуляции CD4+ Т-клеток
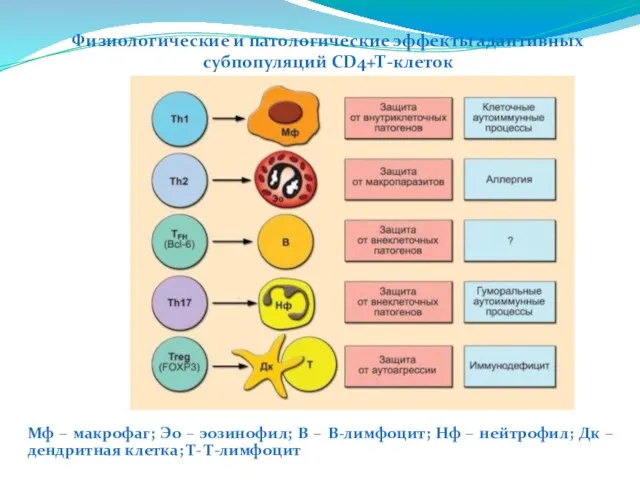
- 223. Физиологические и патологические эффекты адаптивных субпопуляций CD4+Т-клеток Мф – макрофаг; Эо – эозинофил; В – В-лимфоцит;
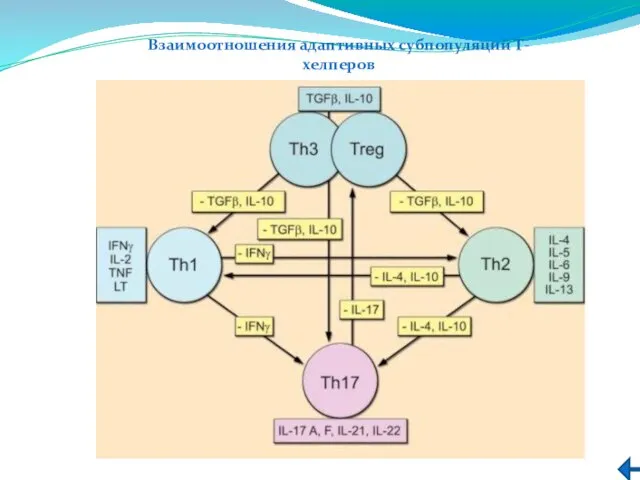
- 224. Взаимоотношения адаптивных субпопуляций Т-хелперов
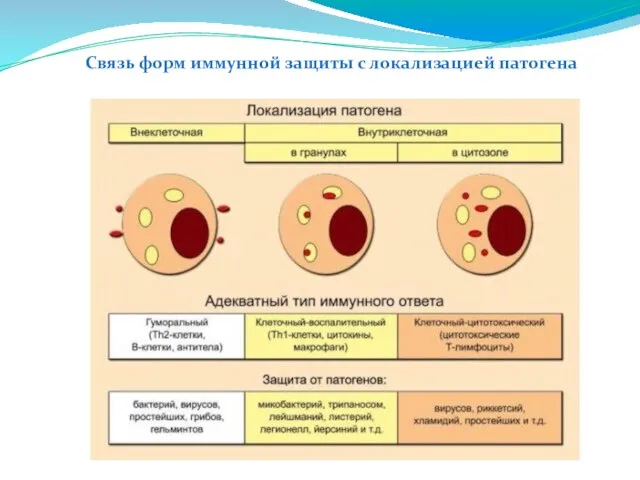
- 225. Связь форм иммунной защиты с локализацией патогена
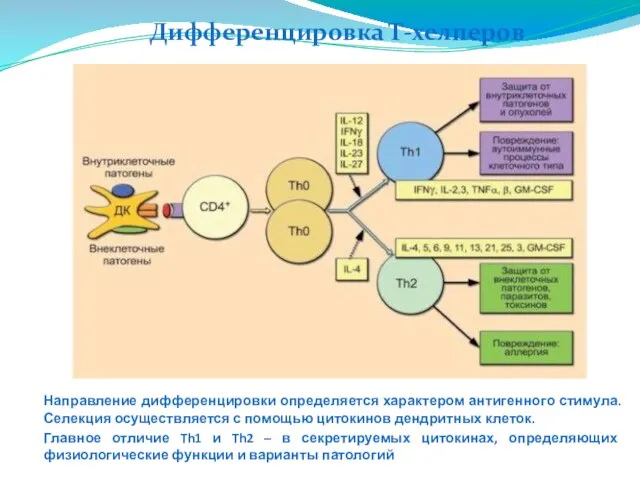
- 226. Дифференцировка Т-хелперов Направление дифференцировки определяется характером антигенного стимула. Селекция осуществляется с помощью цитокинов дендритных клеток. Главное
- 227. Факторы, определяющие преобладание иммунного ответа Th1- или Th2-типа
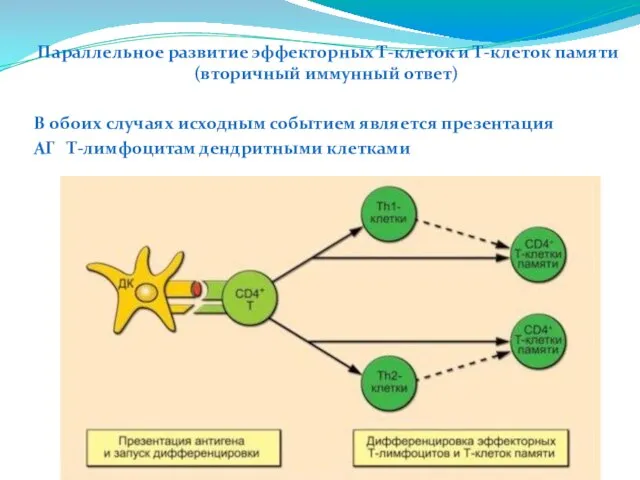
- 229. Параллельное развитие эффекторных Т-клеток и Т-клеток памяти (вторичный иммунный ответ) В обоих случаях исходным событием является
- 230. СD 8+ клетки
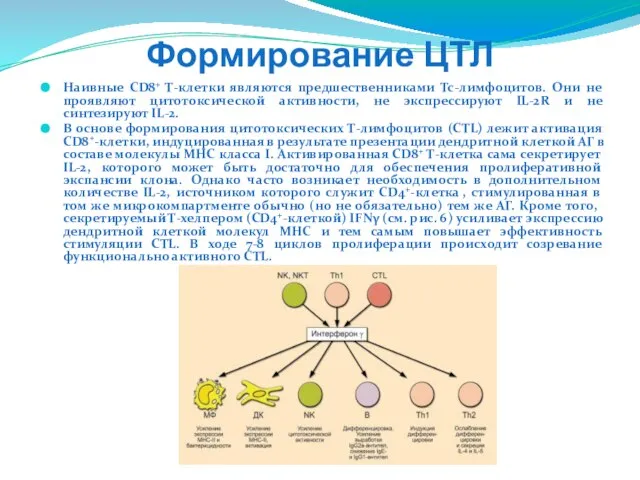
- 231. Формирование ЦТЛ Наивные CD8+ Т-клетки являются предшественниками Tc-лимфоцитов. Они не проявляют цитотоксической активности, не экспрессируют IL-2R
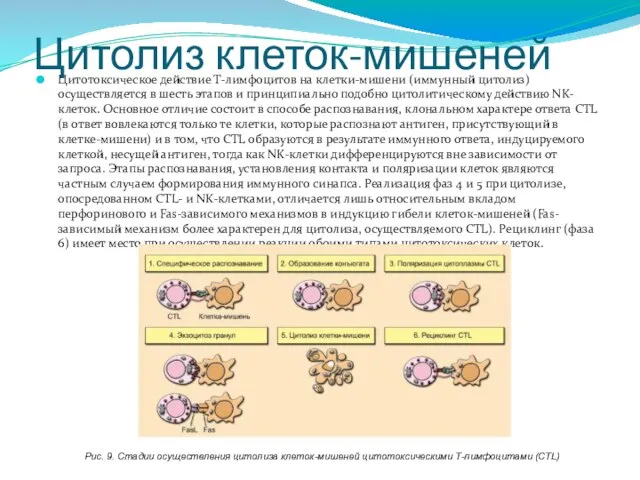
- 232. Цитолиз клеток-мишеней Цитотоксическое действие Т-лимфоцитов на клетки-мишени (иммунный цитолиз) осуществляется в шесть этапов и принципиально подобно
- 233. Гранулы ЦТЛ и апоптоз клеток-мишеней В гранулах содержатся белки, участвующие в реализации цитолиза — перфорин, гранзимы,
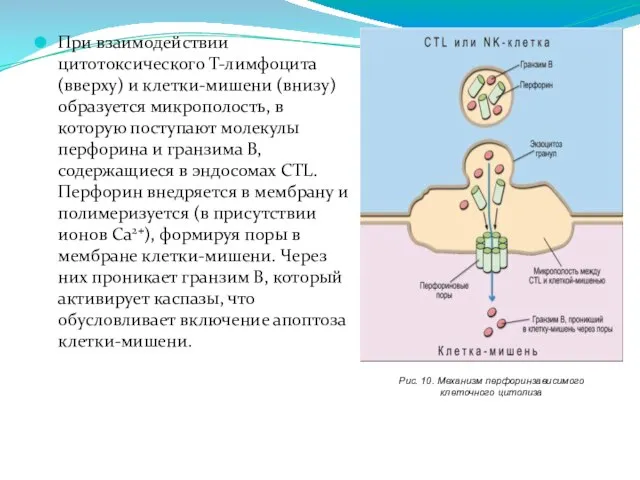
- 234. При взаимодействии цитотоксического Т-лимфоцита (вверху) и клетки-мишени (внизу) образуется микрополость, в которую поступают молекулы перфорина и
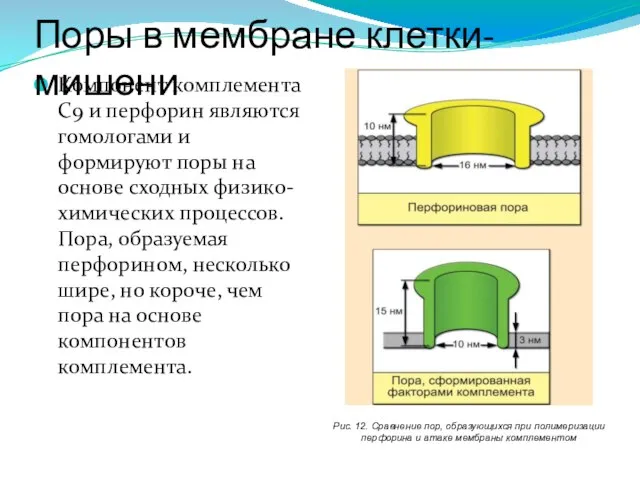
- 235. Компонент комплемента С9 и перфорин являются гомологами и формируют поры на основе сходных физико-химических процессов. Пора,
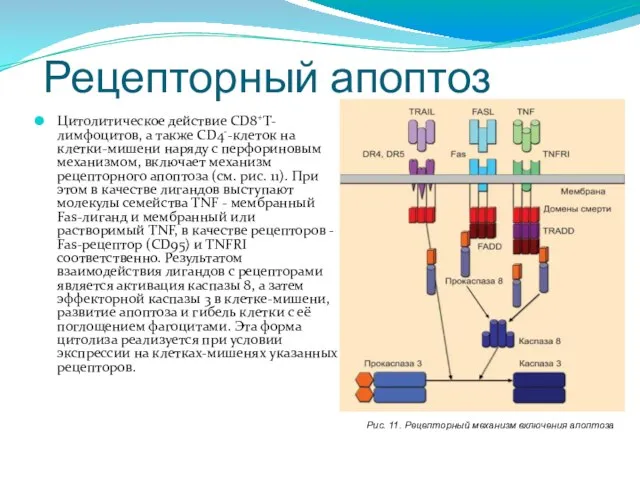
- 236. Рецепторный апоптоз Цитолитическое действие СD8+Т-лимфоцитов, а также CD4--клеток на клетки-мишени наряду с перфориновым механизмом, включает механизм
- 237. Направленность действия Действие Tc-лимфоцитов направлено, главным образом, против вирус-инфицированных и опухолевых клеток. Пролиферация антигенспецифичных клонов является
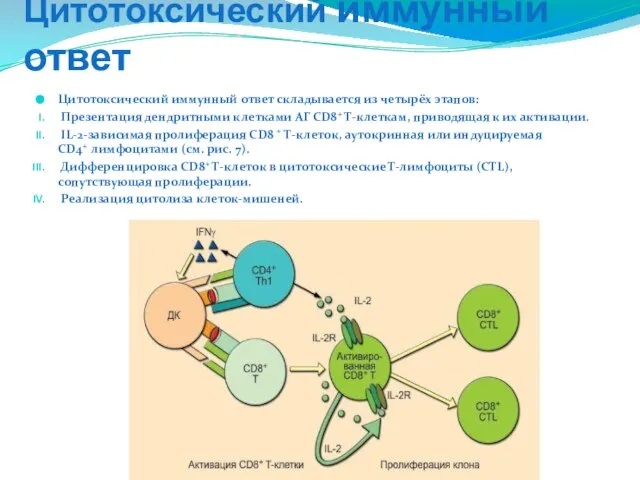
- 238. Цитотоксический иммунный ответ Цитотоксический иммунный ответ складывается из четырёх этапов: Презентация дендритными клетками АГ CD8+ Т-клеткам,
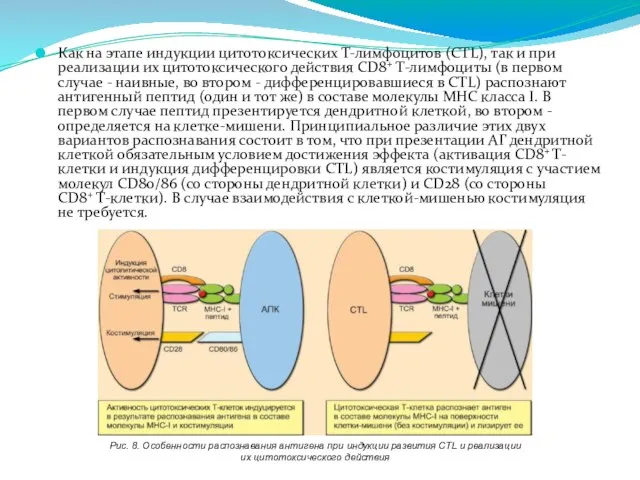
- 239. Как на этапе индукции цитотоксических Т-лимфоцитов (CTL), так и при реализации их цитотоксического действия CD8+ Т-лимфоциты
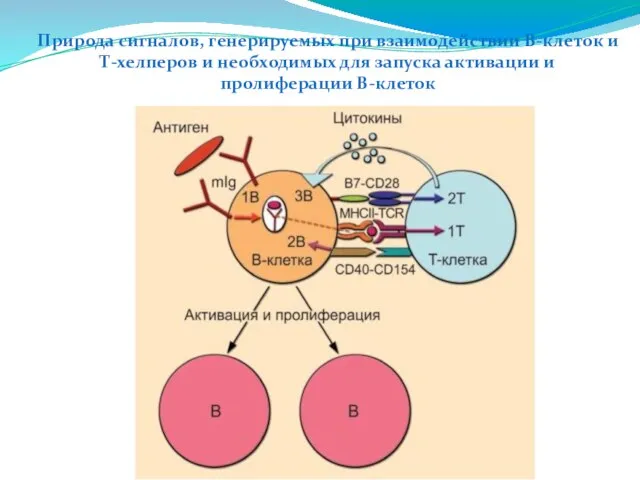
- 240. Природа сигналов, генерируемых при взаимодействии В-клеток и Т-хелперов и необходимых для запуска активации и пролиферации В-клеток
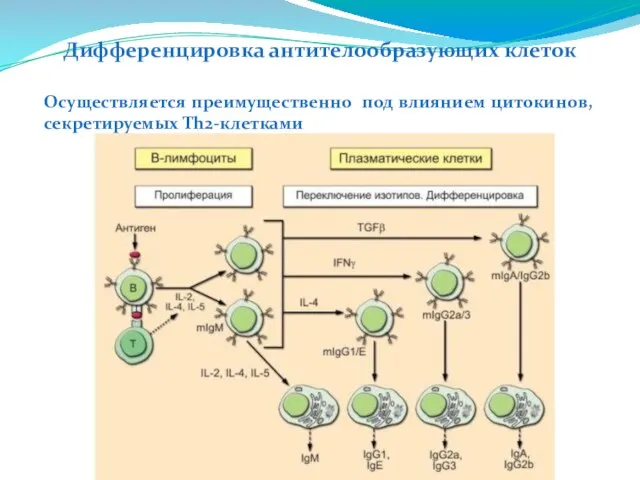
- 241. Дифференцировка антителообразующих клеток Осуществляется преимущественно под влиянием цитокинов, секретируемых Th2-клетками
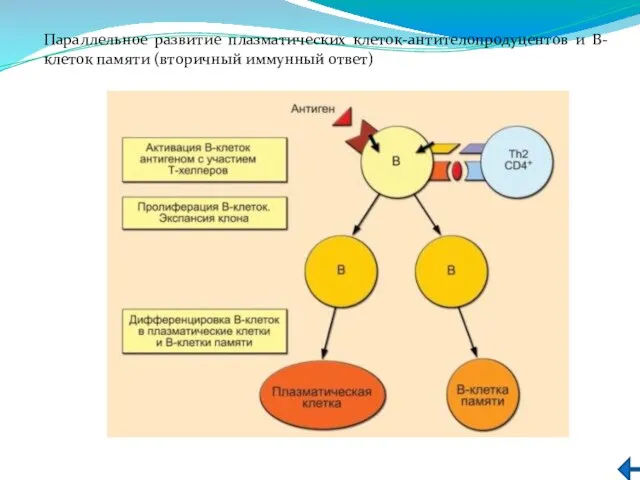
- 242. Параллельное развитие плазматических клеток-антителопродуцентов и В-клеток памяти (вторичный иммунный ответ)
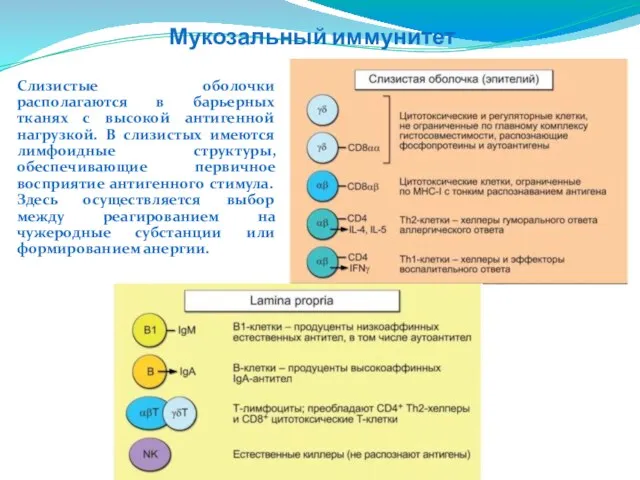
- 243. Мукозальный иммунитет Слизистые оболочки располагаются в барьерных тканях с высокой антигенной нагрузкой. В слизистых имеются лимфоидные
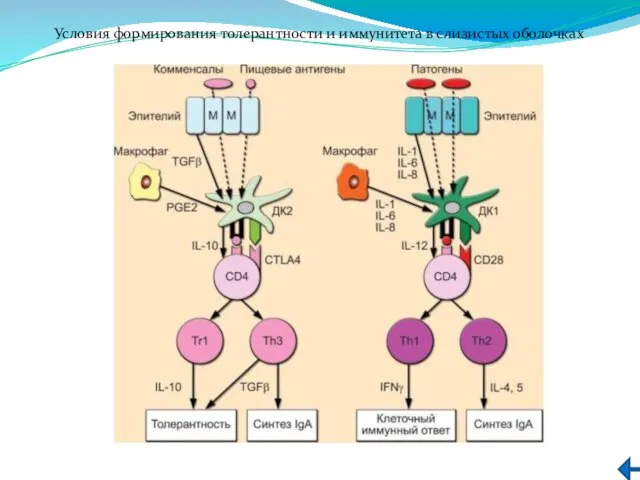
- 244. Условия формирования толерантности и иммунитета в слизистых оболочках
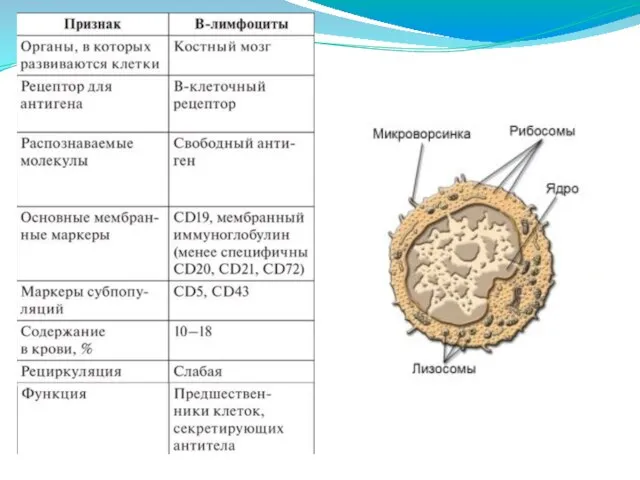
- 246. В-лимфоциты представляют собой клетки адаптивного иммунитета – предшественники плазматических клеток, продуцирующих в организме антитела. Это неоднородная
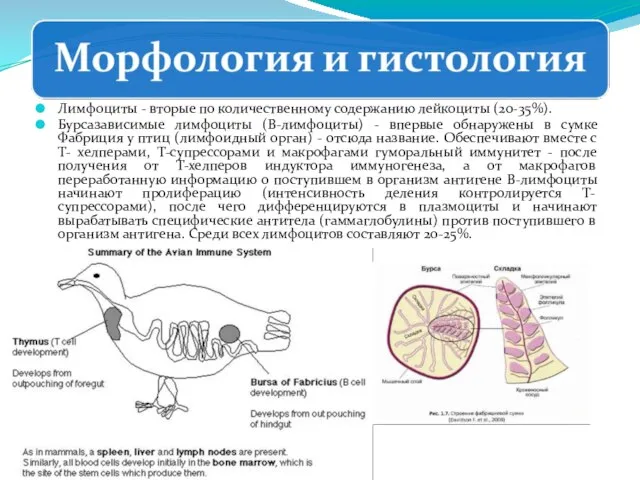
- 247. Лимфоциты - вторые по количественному содержанию лейкоциты (20-35%). Бурсазависимые лимфоциты (В-лимфоциты) - впервые обнаружены в сумке
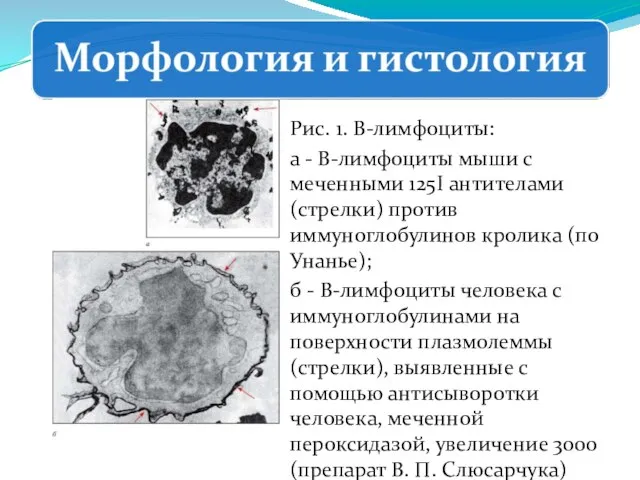
- 248. Рис. 1. В-лимфоциты: а - В-лимфоциты мыши с меченными 125I антителами (стрелки) против иммуноглобулинов кролика (по
- 249. По морфологическим признакам В- и Т-лимфоциты и их субпопуляции различать затруднительно (практически невозможно). Все лимфоциты имеют
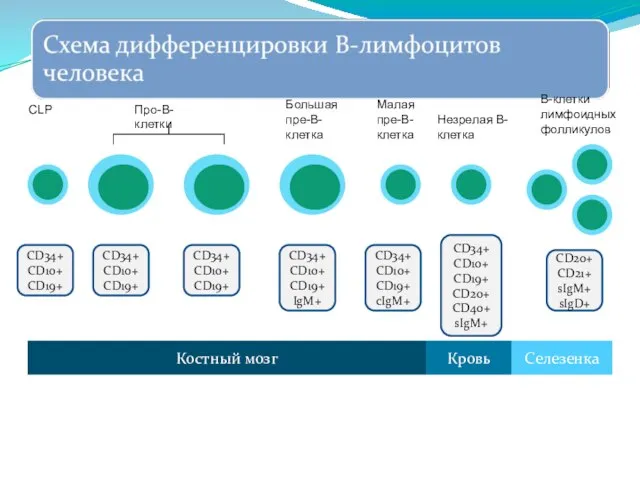
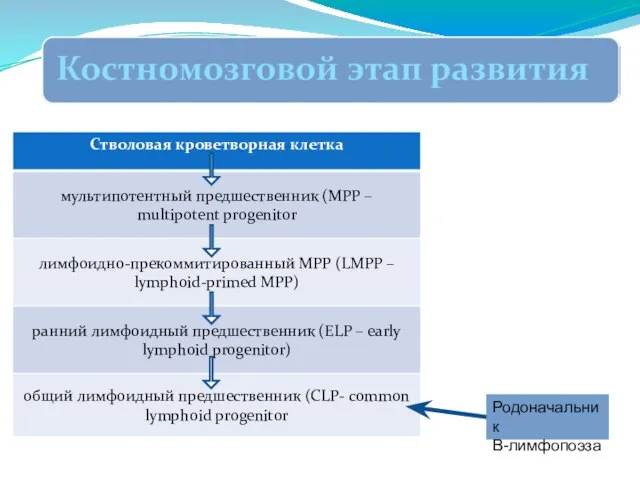
- 251. Образование В-лимфоцитов начинается в эмбриональном периоде и продолжается в течение всей жизни. В развитии В-лимфоцитов, как
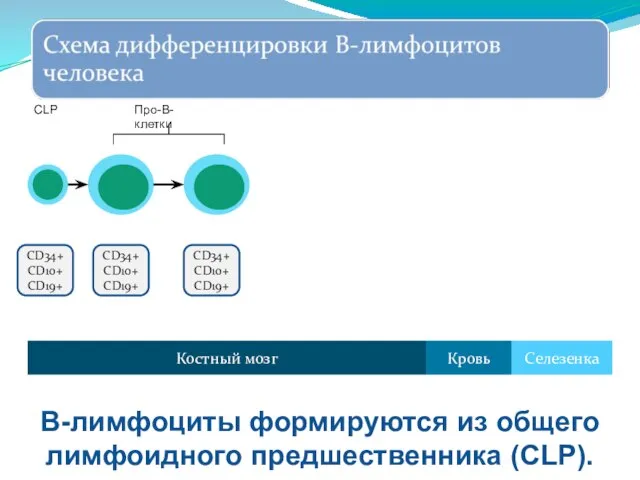
- 252. CD34+ CD10+ CD19+ CD34+ CD10+ CD19+ CD34+ CD10+ CD19+ IgM+ CD34+ CD10+ CD19+ cIgM+ CD34+ CD10+
- 253. CD34+ CD10+ CD19+ CD34+ CD10+ CD19+ CD34+ CD10+ CD19+ Костный мозг Селезенка Кровь CLP Про-В-клетки В-лимфоциты
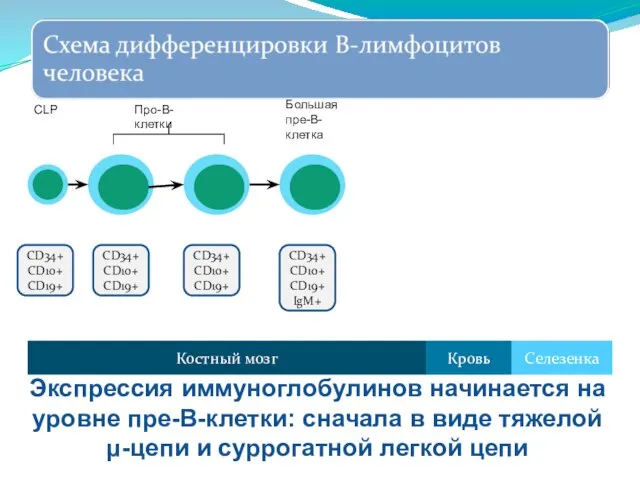
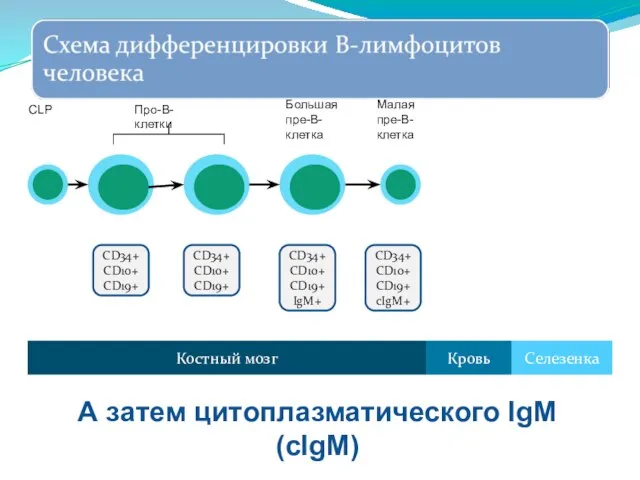
- 254. CD34+ CD10+ CD19+ IgM+ Костный мозг Селезенка Кровь Большая пре-В-клетка Экспрессия иммуноглобулинов начинается на уровне пре-В-клетки:
- 255. CD34+ CD10+ CD19+ cIgM+ Костный мозг Селезенка Кровь Малая пре-В-клетка А затем цитоплазматического IgM (cIgM) CD34+
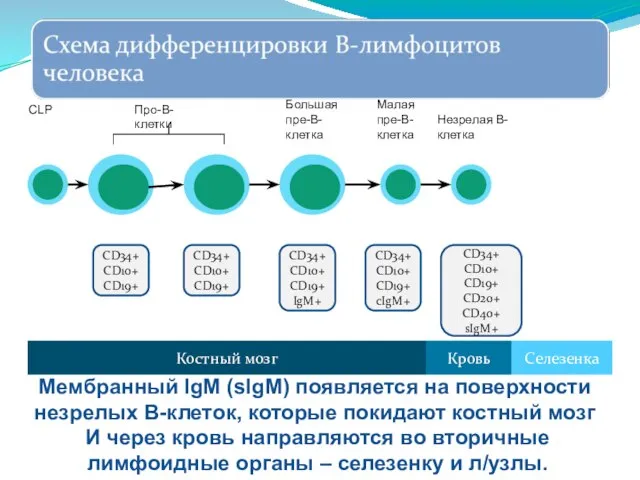
- 256. CD34+ CD10+ CD19+ cIgM+ CD34+ CD10+ CD19+ CD20+ CD40+ sIgM+ Костный мозг Селезенка Кровь Малая пре-В-клетка
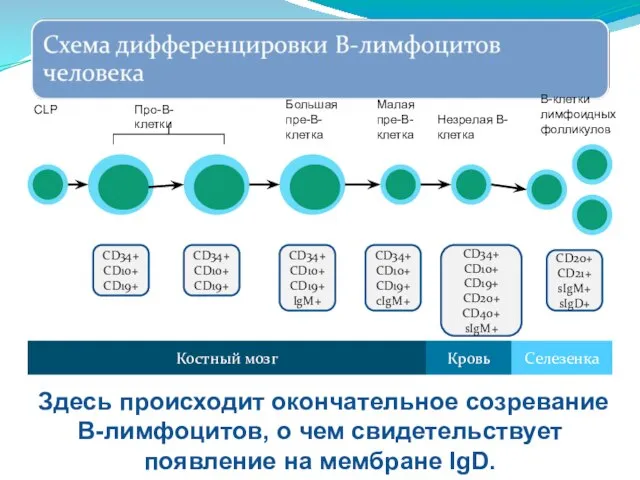
- 257. CD34+ CD10+ CD19+ CD20+ CD40+ sIgM+ CD20+ CD21+ sIgM+ sIgD+ Костный мозг Селезенка Кровь Незрелая В-клетка
- 258. Родоначальник В-лимфопоэза
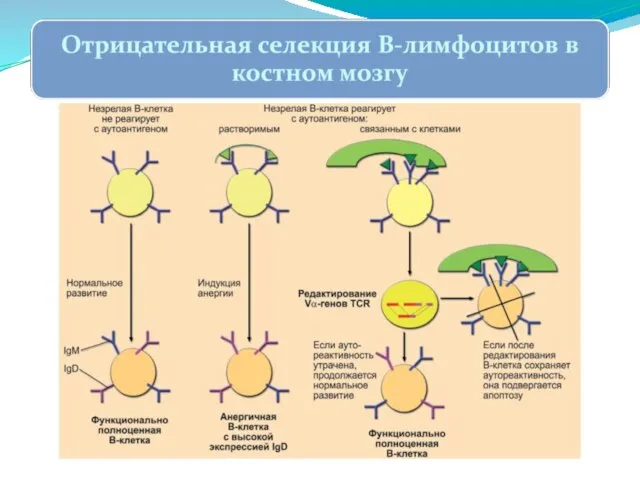
- 259. Негативная селекция и делеция клонов. Связывание мембранного антигена незрелой B-клеткой (экспрессирует IgM-BCR, но ещё отсутствует IgD-BCR)
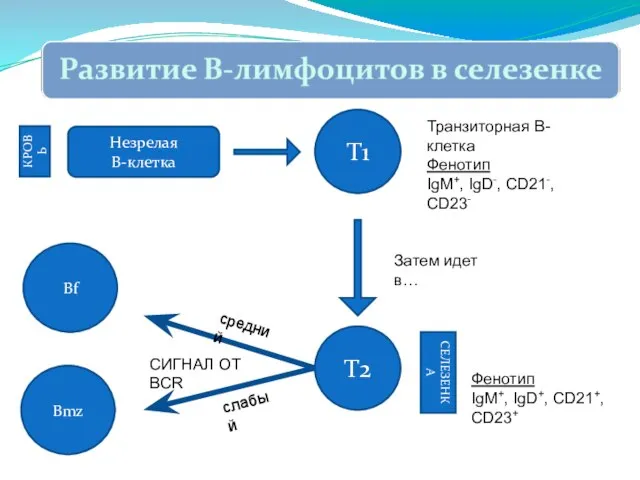
- 261. Незрелая В-клетка КРОВЬ Т1 Транзиторная В-клетка Фенотип IgM+, IgD-, CD21-, CD23- Т2 СЕЛЕЗЕНКА Фенотип IgM+, IgD+,
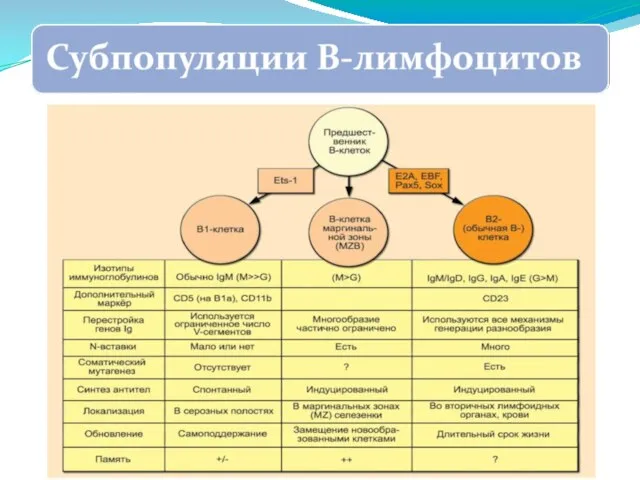
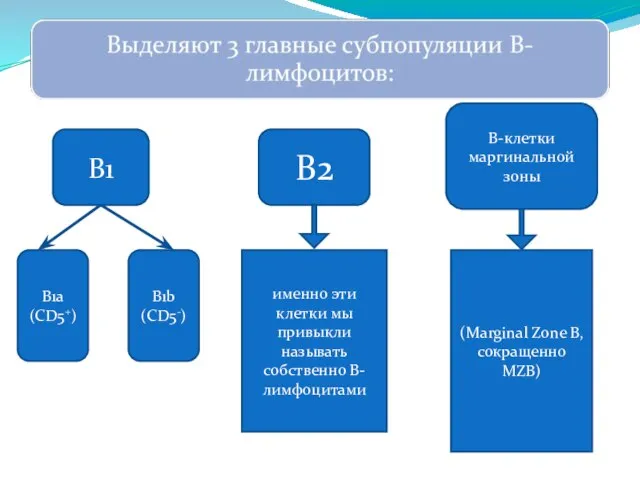
- 265. В1 В2 В-клетки маргинальной зоны именно эти клетки мы привыкли называть собственно В-лимфоцитами (Marginal Zone B,
- 266. Предназначение B1-лимфоцитов - быстрый ответ на проникающие в организм широко распространённые патогены (преимущественно бактерии). Почти все
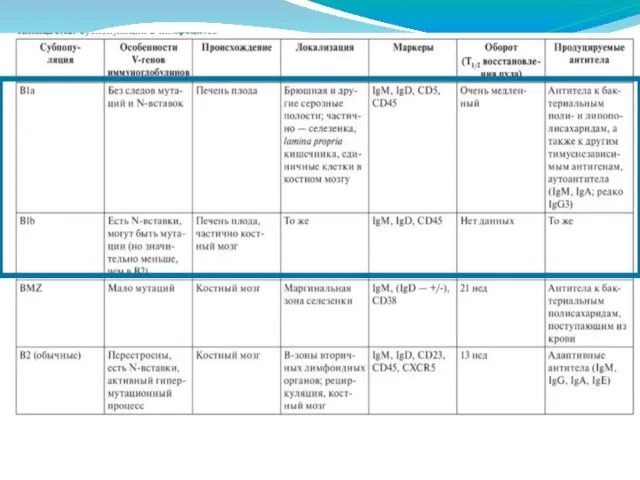
- 267. Предполагают, что основная функция B1a-клеток - секреция естественных антител. Считается, что B1b-лимфоциты участвуют в продукции антител
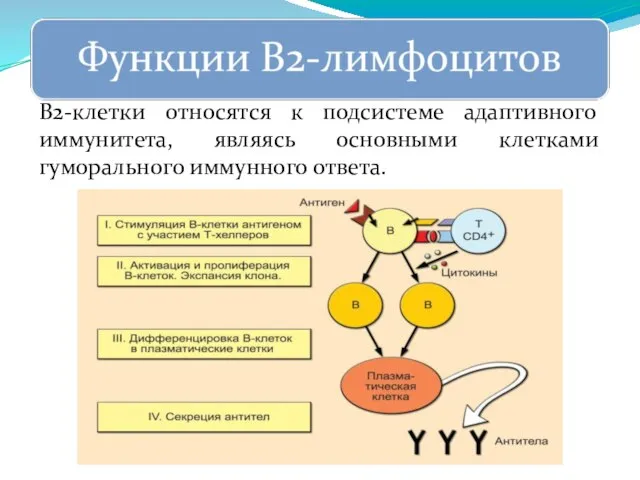
- 269. В2-клетки относятся к подсистеме адаптивного иммунитета, являясь основными клетками гуморального иммунного ответа.
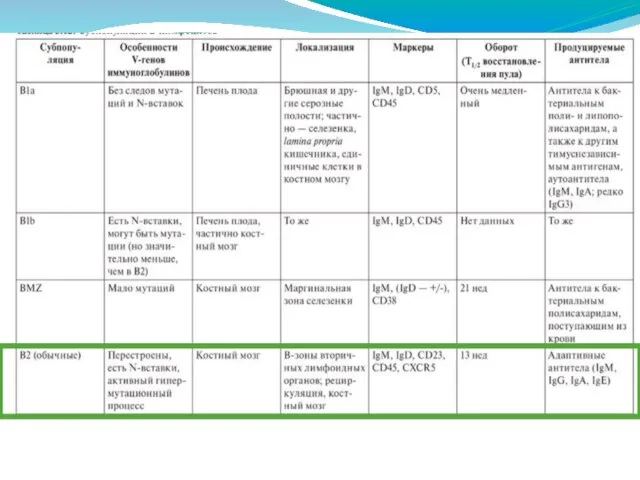
- 271. Их основной задачей является ответ на Т-независимые антигены, находящиеся в крови. Поскольку для ответа на такие
- 274. Антитела Антигенраспознающие молекулы (АРМ) являются основными молекулами системы адаптивного иммунитета. Секретируемые иммуноглобулины (антитела) представляют собой единственный
- 275. История открытия Антитела были открыты в 1890 г., когда Э. Беринг и С. Китасато установили, что
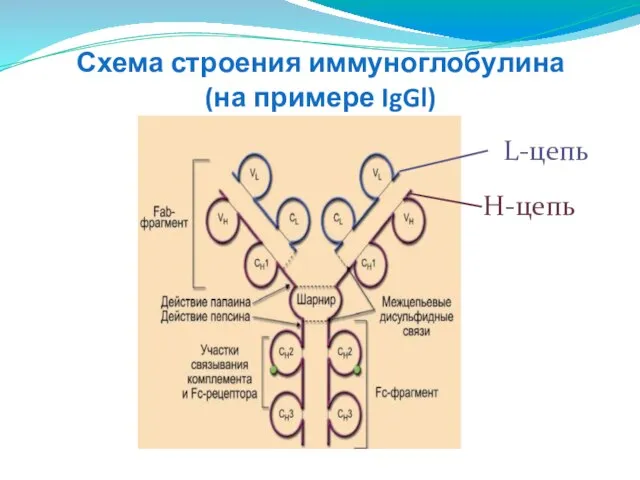
- 276. Строение иммуноглобулинов Молекула Ig - мономер, состоит из двух лёгких (от light) и двух тяжёлых (от
- 277. Схема строения иммуноглобулина (на примере IgGl) L-цепь H-цепь
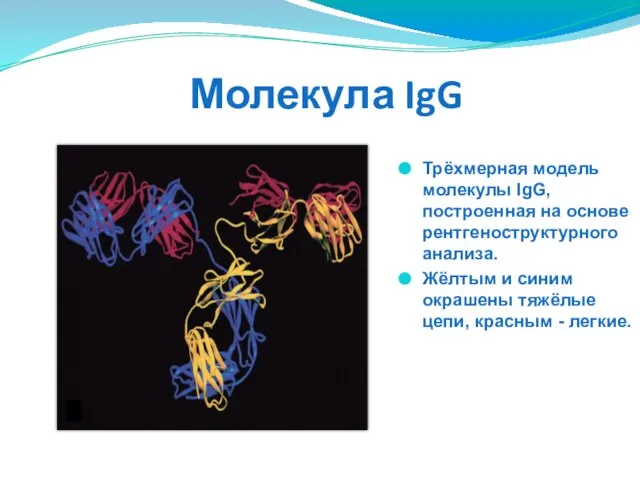
- 278. Молекула IgG Трёхмерная модель молекулы IgG, построенная на основе рентгеноструктурного анализа. Жёлтым и синим окрашены тяжёлые
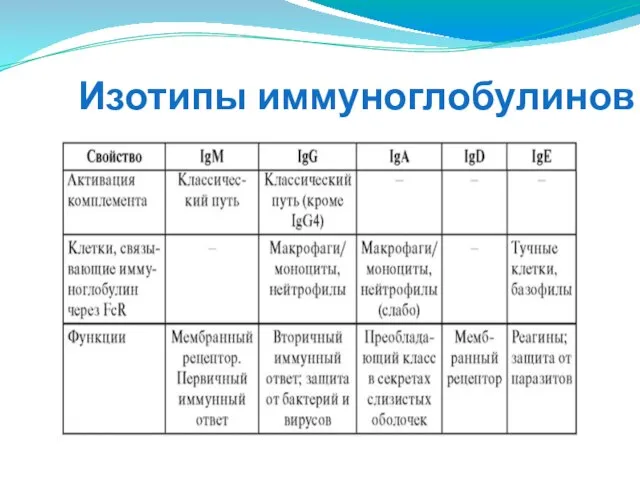
- 279. Изотипия иммуноглобулинов Изотипические детерминанты специфичны для разновидностей Н- и L-цепей. Они локализуются в их С-доменах (в
- 280. Изотипы иммуноглобулинов
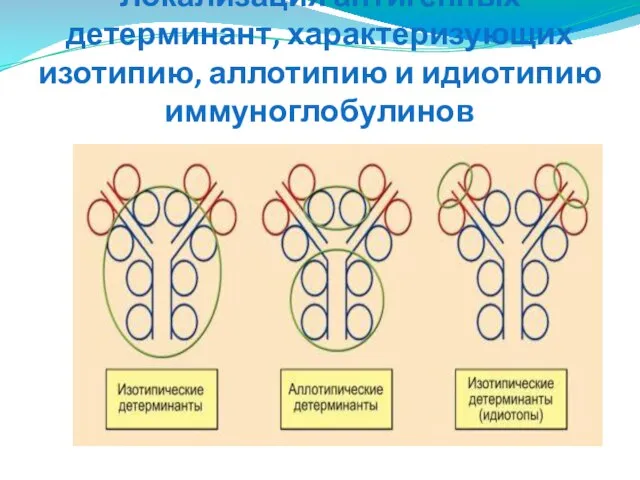
- 281. Аллотипия и идиотипия иммуноглобулинов Аллотипические детерминанты отражают генетический полиморфизм полипептидных цепей иммуноглобулинов, являясь аллельными продуктами полиморфных
- 282. Локализация антигенных детерминант, характеризующих изотипию, аллотипию и идиотипию иммуноглобулинов
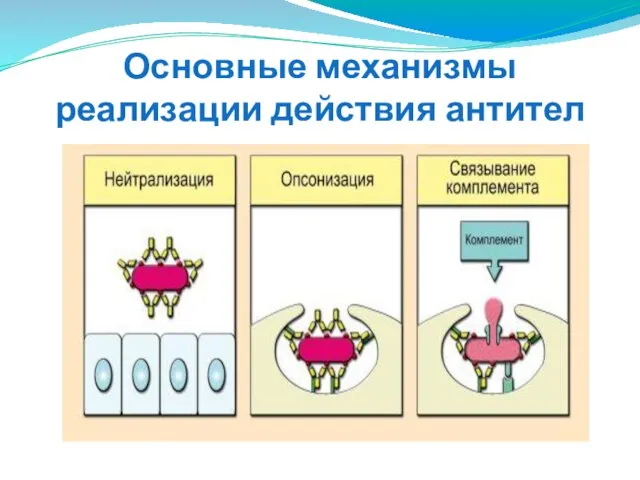
- 283. Функции антител Проявлением эффекторной функции собственно антител является блокада АГ, приводящая к нейтрализации опасных молекул (например,
- 284. Основные механизмы реализации действия антител
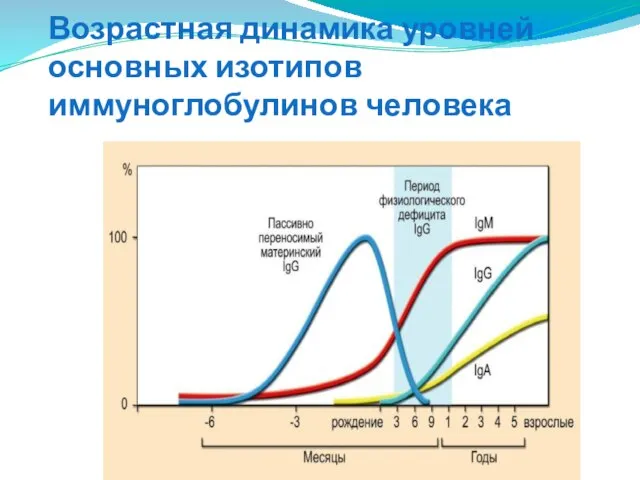
- 285. Возрастная динамика уровней основных изотипов иммуноглобулинов человека
- 286. К моменту рождения успевает в значительной степени сформироваться только механизм выработки IgM-антител; полностью он стабилизируется к
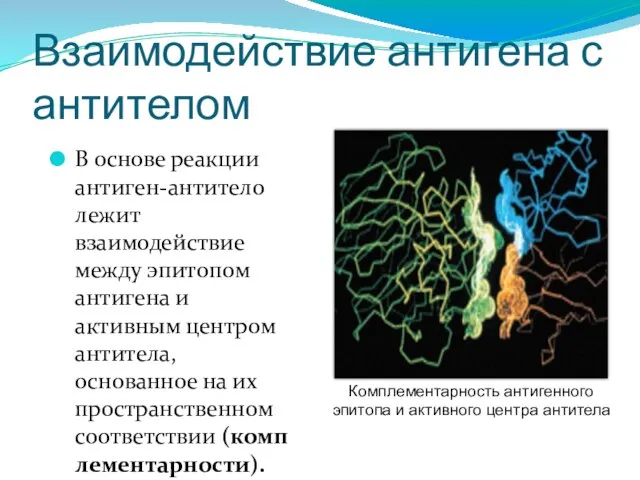
- 287. Взаимодействие антигена с антителом В основе реакции антиген-антитело лежит взаимодействие между эпитопом антигена и активным центром
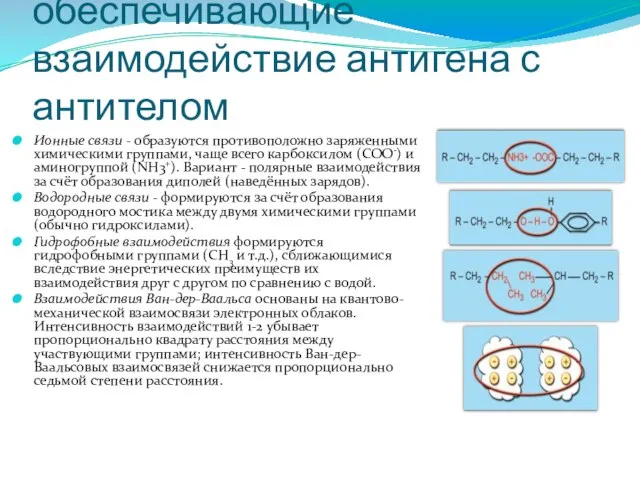
- 288. Нековалентные связи, обеспечивающие взаимодействие антигена с антителом Ионные связи - образуются противоположно заряженными химическими группами, чаще
- 289. Афинность антител Аффинность антител рассматривается как показатель специфичности антител к данному эпитопу. Это мера прочности связи
- 290. Авидность и валентность АТ Авидность (функциональная аффинность) - суммарное сродство. Это сила, с которой мультивалентное АТ
- 292. Скачать презентацию
































































































 Современные методы исследования в офтальмологии
Современные методы исследования в офтальмологии Эскапел новое средство для экстренной контрацепции
Эскапел новое средство для экстренной контрацепции Об этике и долге врача, врачебной деонтологии и врачевании
Об этике и долге врача, врачебной деонтологии и врачевании Пре- и постнатальный онтогенез
Пре- и постнатальный онтогенез Гастрит в детском возрасте
Гастрит в детском возрасте Визначення туберкульозу, як наукової та практичної проблеми. Історія розвитку фтизіатрії. (Лекція 1)
Визначення туберкульозу, як наукової та практичної проблеми. Історія розвитку фтизіатрії. (Лекція 1) Имплантация для чайников
Имплантация для чайников Для снятия зрительной нагрузки, рекомендую просмотр стереограмм (бумажных и электронных)
Для снятия зрительной нагрузки, рекомендую просмотр стереограмм (бумажных и электронных) Арт терапия
Арт терапия Лихорадка
Лихорадка Произведение ребенка 448 группа ОМФ 2011-2012 травматология
Произведение ребенка 448 группа ОМФ 2011-2012 травматология Антенатальная охрана плода
Антенатальная охрана плода Современные подходы к организации медицинской профилактической работы
Современные подходы к организации медицинской профилактической работы 5 игр на развитие памяти
5 игр на развитие памяти Болезни слизистой полости рта
Болезни слизистой полости рта Проходження практики у ветеринарній клініці
Проходження практики у ветеринарній клініці Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод
Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод Самопроизвольное прерывание беременности
Самопроизвольное прерывание беременности Тіс шірігі,тіс шірігіне қатысатын микроорганизмдер. Патогенезі. Тіс тасы , оның құрамы және тіс шірігі дамуына қатысуы
Тіс шірігі,тіс шірігіне қатысатын микроорганизмдер. Патогенезі. Тіс тасы , оның құрамы және тіс шірігі дамуына қатысуы Геморрагические диатезы
Геморрагические диатезы Применение классификации BI-RADS при ультразвуковом скрининге рака молочной железы
Применение классификации BI-RADS при ультразвуковом скрининге рака молочной железы Дрига_322_леч_электронное здравоохранение_аккредитация
Дрига_322_леч_электронное здравоохранение_аккредитация Типология конфликтов
Типология конфликтов Опухоли. Этиология, патогенез, морфогенез опухоли
Опухоли. Этиология, патогенез, морфогенез опухоли Гонорея
Гонорея Кома. Коматозное состояние
Кома. Коматозное состояние Судебная медицина. Организация судебномедицинской службы
Судебная медицина. Организация судебномедицинской службы Организация борьбы с материнской смертностью, борьба с гемморрагическим шоком, инфузионно-трансфузионная терапия
Организация борьбы с материнской смертностью, борьба с гемморрагическим шоком, инфузионно-трансфузионная терапия