Содержание
- 2. План ВВЕДЕНИЕ ОСНОВНАЯ ЧАСТЬ ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ ПОРОШКИ ДЛЯ ПРИГОТОВЛЕНИЯ ИНЬЕКЦИОННЫХ ИЛИ ВНУТРИВЕННЫХ ИНФУЗИОННЫХ
- 3. ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ (ПАРЕНТЕРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА) – СТЕРИЛЬНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ВВЕДЕНИЯ
- 4. Инъекционные лекарственные средства; Внутривенные инфузионные лекарственные средства; Концентраты для инъекционных или внутривенных инфузионных лекарственных средств; Порошки
- 5. Инъекционные лекарственные средства – это стерильные растворы, эмульсии или суспензии. Растворы для инъекций должны быть прозрачными
- 6. Парентеральный путь введения в организм лекарств имеет ряд преимуществ перед другими методами: быстрое действие и полная
- 7. Наряду с преимуществами инъекционный путь введения имеет и некоторые недостатки: при введении жидкостей через поврежденный покров
- 8. В зависимости от места и глубины введения лекарственных препаратов применяют инъекции следующих видов: внутрикожные, подкожные, внутримышечные,
- 9. Требования к лекарственным средствам для парентерального применения Стерильность Отсутствие механических частиц Пирогенность Аномальная токсичность Прозрачность Цветность
- 10. Порошки – лекарственная форма, состоящая из твердых отдельных сухих частиц различной дисперсности, обладающая свойством сыпучести. Порошки
- 11. Порошки для инъекционных или внутривенных инфузионных лекарственных средств – представляют собой твердые стерильные вещества, помещенные в
- 12. Для приготовления инъекционных или инфузионных лекарственных форм содержимое упаковки с лекарственным препаратом растворяют или диспергируют в
- 13. Процесс технологии Процесс получения порошков состоит из следующих стадий: - Подготовка помещений, оборудования, персонала – измельчение
- 14. Для обеспечения асептики необходимо учитывать источники микробной контаминации лекарственных препаратов, которыми являются: - воздух; - поверхность
- 15. Измельчение Целью стадии является измельчение порошков до размеров частиц, нормируемых в фармакопее (не более 0,16 мм).
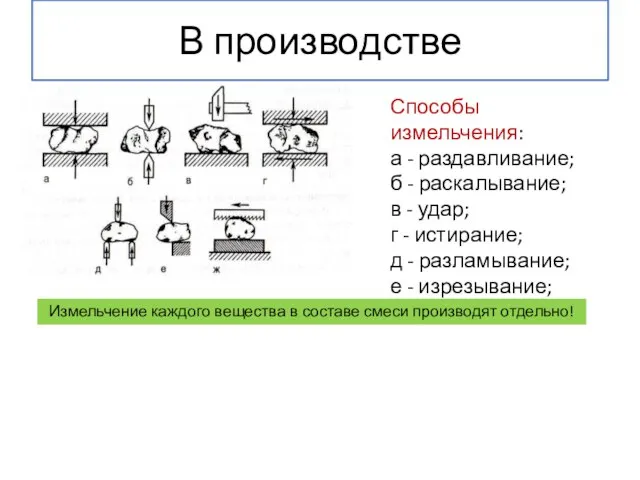
- 16. В производстве Способы измельчения: а - раздавливание; б - раскалывание; в - удар; г - истирание;
- 17. Молотковая мельница 1-корпус, 2-броневые плиты, 3-вал, 4-диск, 5-молоток, 6-колосниковая решетка Дисковая мельница «Эксцельсиор» Машины ударно-центробежного действия
- 18. Особые случаи измельчения: 1. Трудноизмельчаемые порошки измельчают в присутствии вспомогательных жидкостей (спиртоэфирная смесь или этанол) За
- 19. Смешивание (mixtio) Цель стадии смешивания - получение однородной порошковой смеси. Смешивание, как правило, проводят одновременно с
- 20. . Для получения однородных смесей смешивание ведут по принципу «от меньшего к большему». При этом соотношение
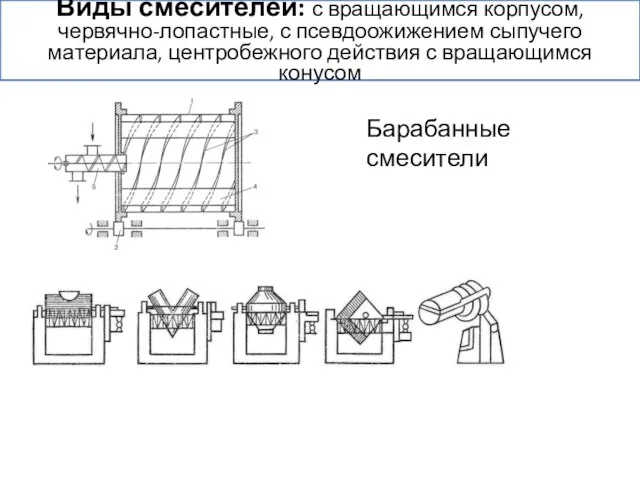
- 21. Барабанные смесители Виды смесителей: с вращающимся корпусом, червячно-лопастные, с псевдоожижением сыпучего материала, центробежного действия с вращающимся
- 22. Просеивание (cubratio) Цель просеивания - получение продукта с одинаковым размером частиц. Просеивание проводят через сито капроновое
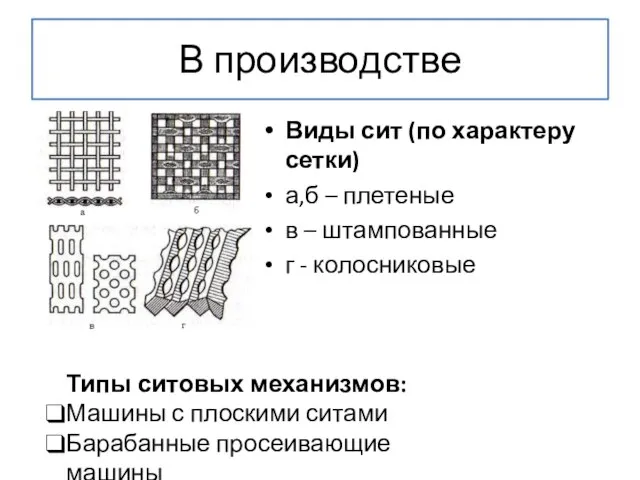
- 23. В производстве Виды сит (по характеру сетки) а,б – плетеные в – штампованные г - колосниковые
- 24. Качающееся сито: 1 – загрузочная воронка 2 – корпус 3 – рабочая поверхность 4 – направляющие
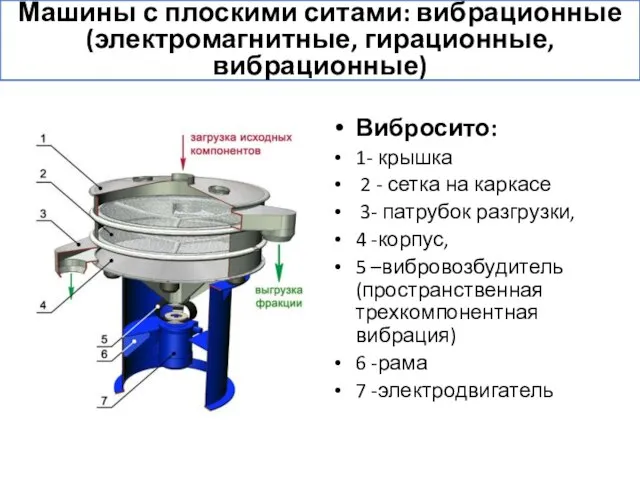
- 25. Вибросито: 1- крышка 2 - сетка на каркасе 3- патрубок разгрузки, 4 -корпус, 5 –вибровозбудитель (пространственная
- 26. стерилизация Стерилизация горячим воздухом (воздушная стерилизация) Для этого метода термической стерилизации стандартными условиями являются нагревание при
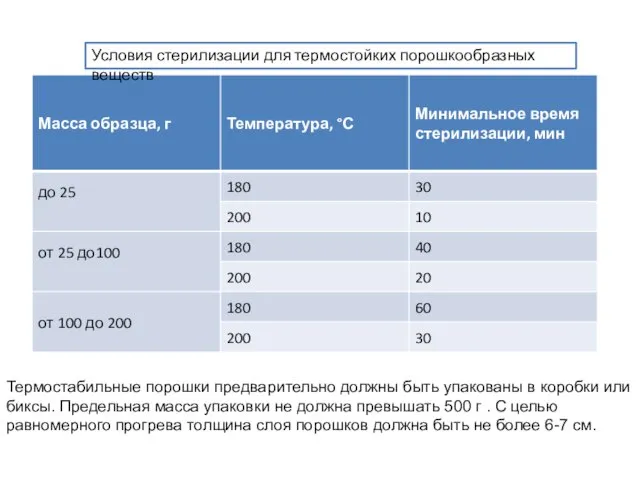
- 27. Условия стерилизации для термостойких порошкообразных веществ Термостабильные порошки предварительно должны быть упакованы в коробки или биксы.
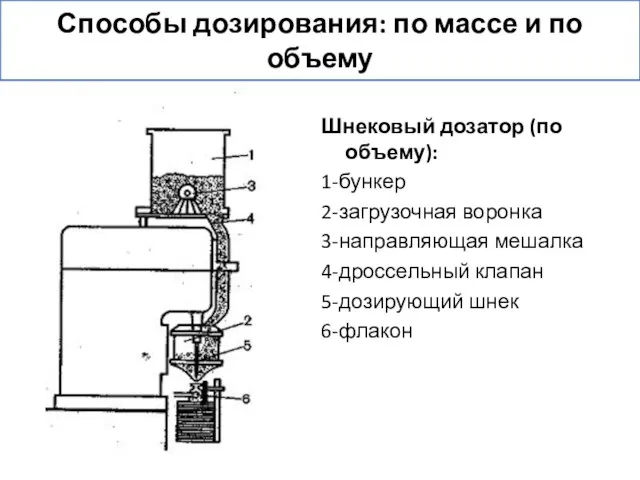
- 28. Дозирование Дозирование порошков проводят по массе и по объему. Для дозирования по массе используют весы аптечные
- 29. Шнековый дозатор (по объему): 1-бункер 2-загрузочная воронка 3-направляющая мешалка 4-дроссельный клапан 5-дозирующий шнек 6-флакон Способы дозирования:
- 30. Упаковка Выбор упаковочного материала осуществляется в соответствии с физико-химическими свойствами порошков флаконы с притертыми пробками –
- 31. оформление На всех этикетках для оформления порошков, приготовляемых в порядке внутриаптечной заготовки и фасовки, должны быть
- 32. описание (цвет, вкус, запах); подлинность; средняя масса и отклонение в массе отдельных порошков; сыпучесть; посторонние примеси;
- 33. Описание Порошки должны быть однородными при рассмотрении невооруженным глазом и иметь размер частиц не более 160
- 34. Цефтазидим порошок для иньекций белый или белый с желтовато-бежевым оттенком порошок
- 35. идентификация для веществ, обладающих специфическими свойствами, внешние признаки могут выступать в качестве показателей подлинности вещества. Кроме
- 36. Идентификация цефтазидима На хромотограмме испытуемого раствора, полученной при количественном определении, время удерживания основного пика должно совпадать
- 37. Прозрачность раствора Прозрачность и степень мутности жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталонами
- 38. Прозрачность раствора цефтазидима 1 г препарата растворяет в воде, свободной от углерода диоксида, доводят тем же
- 39. Цветность раствора Для визуальной оценки окраски жидкостей в зависимости от интенсивности в области коричневых, желтых и
- 40. Метод 1 Испытания проводят в одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром около
- 42. Механические включения: невидимые частицы Механические включения инъекционных и внутривенных инфузионных растворов — это посторонние подвижные нерастворимые
- 43. Методика. Перемешивают содержимое образца, медленно переворачивая его 20 раз. При необходимости осторожно удаляют этикетки и элементы
- 44. потеря в массе при высушивании Под понятием «Потеря в массе при высушивании» подразумевают потерю в массе
- 45. Способ 1. Если не указано иначе, пробу высушивают в течение 2 ч в сушильном шкафу в
- 46. пирогенность Настоящая общая фармакопейная статья распространяется на испытание пирогенности инъекционных растворов и фармацевтических субстанций, из которых
- 47. Каждого кролика содержат в отдельной клетке на полноценном пищевом рационе, ограждая от раздражающих воздействий (акустических, оптических
- 48. Испытуемое лекарственное средство вводят в ушную вену кролика. Объем инъецируемого раствора должен составлять не менее 0,2
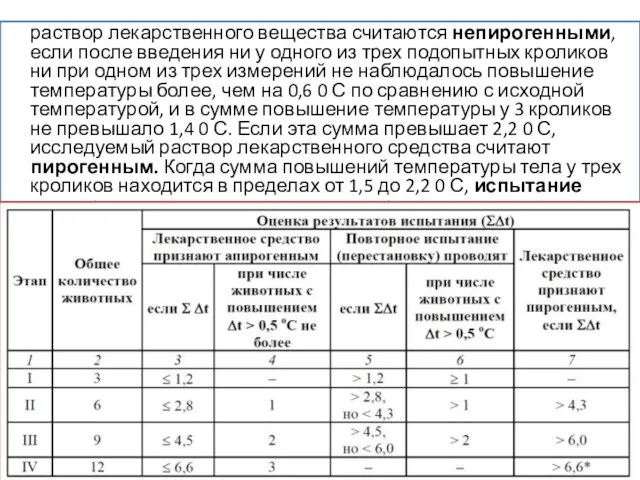
- 49. раствор лекарственного вещества считаются непирогенными, если после введения ни у одного из трех подопытных кроликов ни
- 50. стерильность Определение стерильности растворов проводится путем посева и инкубации на специальных тест-средах образцов каждой серии продукции.
- 51. .Для фильтрования применяют установку с мембраной диаметром 47 мм и размером пор 0,45±0,02 мкм. Фильтры стерилизуют
- 52. Заключение Испытуемый порошок для иньекций Цефтазидим соответствует требованиям ГФ РК.
- 53. литературы Фармакопея РК I том. Стр: 25, 36, 37, 112, 164, 173, 254, 324, 512, 539
- 55. Скачать презентацию













































 Медицинская микробиология и вирусология
Медицинская микробиология и вирусология Медициналық тактика
Медициналық тактика Медиобазальные отделы коры, правое полушарие мозга
Медиобазальные отделы коры, правое полушарие мозга Созылмалы ішек аурулары кезіндегі пациентті және туыстарын үйрету
Созылмалы ішек аурулары кезіндегі пациентті және туыстарын үйрету Публичное обсуждение результатов мониторинга наркоситуации в ХМАО – Югре за 2018 год
Публичное обсуждение результатов мониторинга наркоситуации в ХМАО – Югре за 2018 год Гибридные фотоакустические и термоакустические технологии в биомедицинской инженерии. Состояние и перспективы
Гибридные фотоакустические и термоакустические технологии в биомедицинской инженерии. Состояние и перспективы Ет және ет өнімдері. Жұқпалы аурулар
Ет және ет өнімдері. Жұқпалы аурулар Эфферентные связи мозжечка
Эфферентные связи мозжечка Миома матки. Диагностика и лечение
Миома матки. Диагностика и лечение ЛОР ағзаларының тілмелі қабынулары. Клиникасы
ЛОР ағзаларының тілмелі қабынулары. Клиникасы Процесс взаимодействия лекарственных средств с организмом
Процесс взаимодействия лекарственных средств с организмом Недостаточность митрального клапана
Недостаточность митрального клапана Bronchial asthma
Bronchial asthma Консультирование бесплодной пары
Консультирование бесплодной пары Применение бесконтактного инфракрасного термометра для мониторинга температуры тела пациента в операционной
Применение бесконтактного инфракрасного термометра для мониторинга температуры тела пациента в операционной Микрохирургия. Общие хирургические требования
Микрохирургия. Общие хирургические требования Первая медицинская помощь при наружном кровотечении
Первая медицинская помощь при наружном кровотечении Neurocognitive disorders
Neurocognitive disorders Классификация, мониторирование, лечение бронхиальной астмы у детей
Классификация, мониторирование, лечение бронхиальной астмы у детей Lasers in medicine
Lasers in medicine Трихомонадная инфекция
Трихомонадная инфекция Внекишечные гельминтозы
Внекишечные гельминтозы Невралгия языкоглоточного нерва
Невралгия языкоглоточного нерва Работа с детьми, пережившими травму
Работа с детьми, пережившими травму Задачи, организационная структура и основы деятельности всероссийской службы медицины катастроф
Задачи, организационная структура и основы деятельности всероссийской службы медицины катастроф Профилактика ОРВИ и гриппа
Профилактика ОРВИ и гриппа Трихинеллёз. Trichinella
Трихинеллёз. Trichinella Учёт возрастных особенностей детей в работе вожатого
Учёт возрастных особенностей детей в работе вожатого