Содержание
- 2. СТРУКТУРА УЧЕБНОГО СОДЕРЖАНИЯ 1.1. Основы организации клинической фармакологии в Российской Федерации 1.2. Клиническая фармакокинетика лекарственных средств
- 3. 1.1. Основы организации клинической фармакологии в Российской Федерации
- 4. Клиническая фармакология - это дисциплина изучающая все аспекты взаимодействия между лекарством и человеком. Цель клинической фармакологии
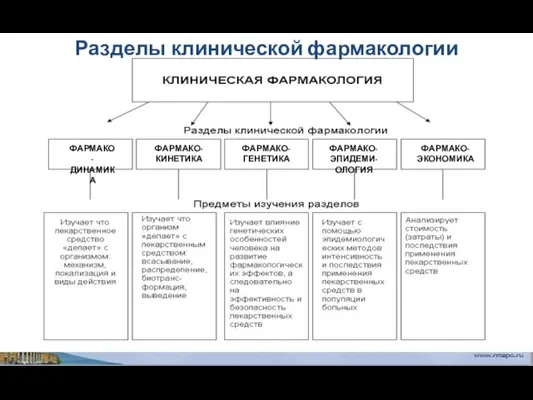
- 5. ФАРМАКО- ДИНАМИКА ФАРМАКО- КИНЕТИКА ФАРМАКО- ГЕНЕТИКА ФАРМАКО- ЭПИДЕМИ-ОЛОГИЯ ФАРМАКО- ЭКОНОМИКА Разделы клинической фармакологии
- 6. Основы организации клинической фармакологии в Российской Федерации Медицинская помощь по профилю "клиническая фармакология", направленная на повышение
- 7. Функции службы клинической фармакологии в медицинских организациях консультативное сопровождение фармакотерапии в медицинской организации; создание и внедрение
- 8. Документы, регламентирующие деятельность службы клинической фармакологии в Российской Федерации: Приказ Министерство здравоохранения РФ о введении специальности
- 9. Часть обсуждаемых ранее трудовых функций перешло в «разряд» трудовых действий. Итого их 8!
- 11. Правовые основы обращения применения лекарственных средств в России Федеральный закон РФ от 21.11.2011 № 323-ФЗ (ред.
- 12. Чем регламентируется фармакотерапия в клинической практике? инструкцией по применению конкретного ЛС стандартами медицинской помощи / технологическими
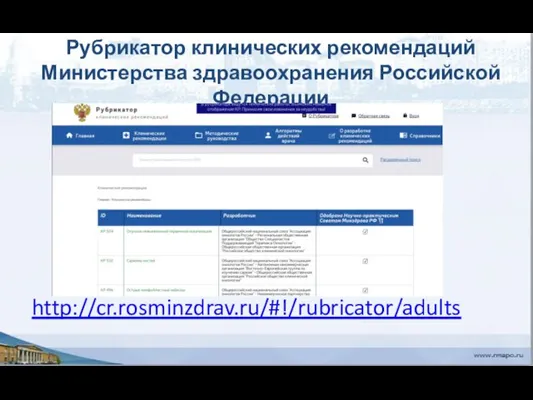
- 13. Рубрикатор клинических рекомендаций Министерства здравоохранения Российской Федерации http://cr.rosminzdrav.ru/#!/rubricator/adults
- 15. Справочники лекарственных средств коммерческие справочники справочники-монографии справочники общественных организаций Официальные: инструкции по медицинскому применению ЛС Государственного
- 16. Структура инструкции по медицинскому применению лекарственных средств фармакологическое действие фармакокинетика показания к применению противопоказания применение с
- 17. Назначение препаратов с предполагаемой этиотропной эффективностью off-label Оff-label - назначение ЛС по показаниям, в дозировке или
- 18. Законодательные основы назначения препаратов off-label в Российской Федерации Федеральный закон РФ от 21.11.2011 № 323-ФЗ (ред.
- 19. Характеристика лекарственных препаратов для лечения covid-19
- 20. 1.2. Клиническая фармакокинетика лекарственных средств
- 21. Зачем нужна врачу информация о фармакокинетике лекарственных средств? Фармакокинетика позволяет понять , что организм «делает» с
- 22. Интерпретация фармакокинетических параметров и характеристик из раздела «Фармакокинетика» инструкции Основные фармакокинетические процессы: всасывание, распределение, биотрансформация, выведение
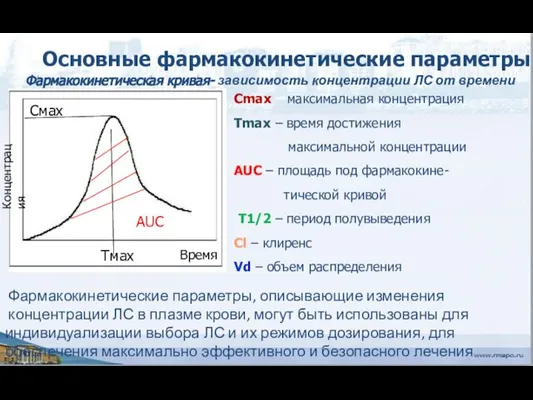
- 23. Время Концентрация Тмах Смах AUC Сmax – максимальная концентрация Tmax – время достижения максимальной концентрации AUC
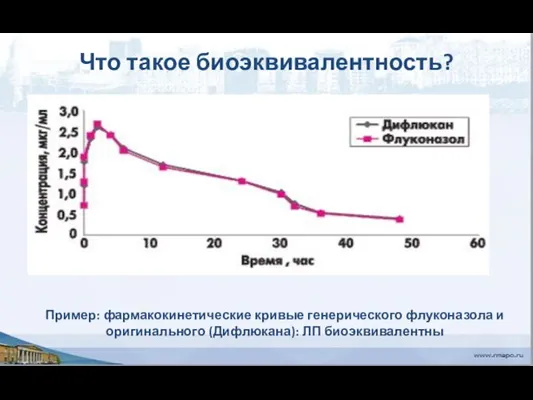
- 24. Что такое биоэквивалентность? Пример: фармакокинетические кривые генерического флуконазола и оригинального (Дифлюкана): ЛП биоэквивалентны
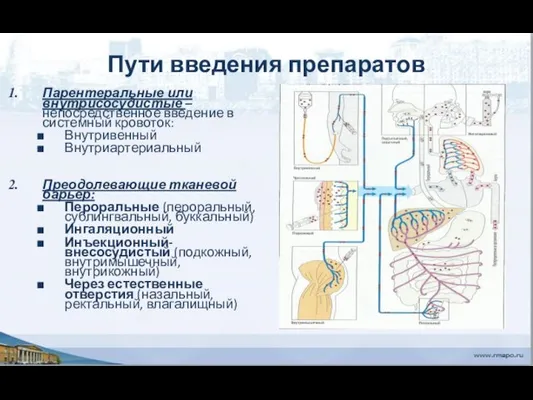
- 25. Пути введения препаратов Парентеральные или внутрисосудистые – непосредственное введение в системный кровоток: Внутривенный Внутриартериальный Преодолевающие тканевой
- 26. Всасывание (абсорбция) - это процесс поступления ЛС из места введения в системный кровоток Факторы, влияющие на
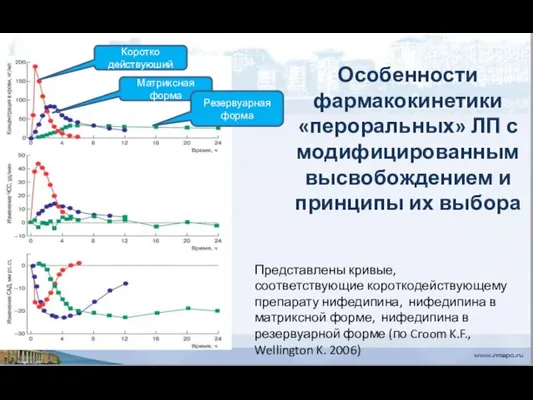
- 27. Особенности фармакокинетики «пероральных» ЛП с модифицированным высвобождением и принципы их выбора Коротко действуюший Матриксная форма Резервуарная
- 28. Механизм всасывания – способность ЛС проникать через биологические мембраны. Определяется их растворимостью в липидах и ионизацией
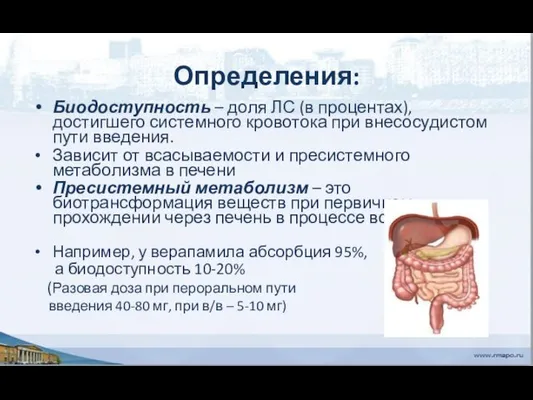
- 29. Определения: Биодоступность – доля ЛС (в процентах), достигшего системного кровотока при внесосудистом пути введения. Зависит от
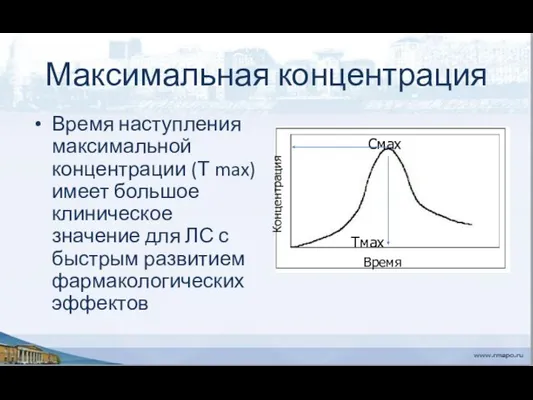
- 30. Максимальная концентрация Время наступления максимальной концентрации (Т max) имеет большое клиническое значение для ЛС с быстрым
- 31. Связывание лекарственных веществ с белками плазмы и крови Только свободная форма лекарственного препарата проходит через мембраны.
- 32. Связь с белками плазмы Связывание с белками плазмы имеет большое значение, т.к. именно концентрация свободного лекарственного
- 33. Варфарин (кумарин) Доза: 10 мг. Биодоступность ~ 100% Связь с белками плазмы – 99%: 9,9 мг
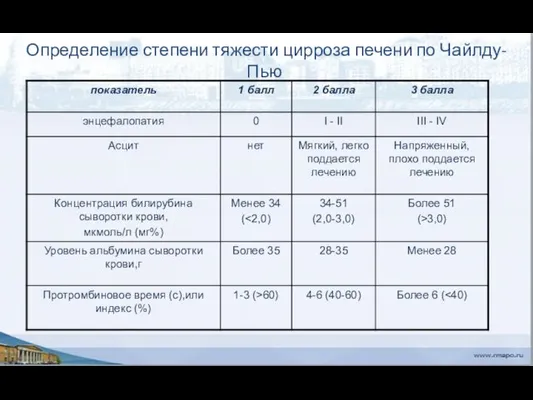
- 34. Определение степени тяжести цирроза печени по Чайлду-Пью
- 35. Коррекция доз для ЛС с высоким пресистемным метаболизмом при заболеваниях печени. По степени нарушения функции печени:
- 36. Vd – это гипотетический объем жидкости, необходимой для равномерного распределения всего количества введенного ЛС в концентрации,
- 37. Период полувыведения Период полувыведения – время, необходимое для снижения концентрации ЛС в плазме крови на 50%
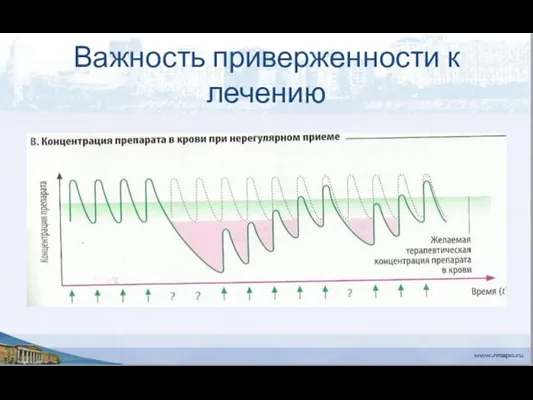
- 38. Важность приверженности к лечению
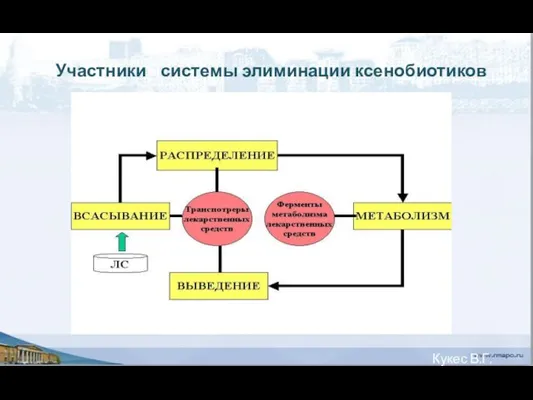
- 39. Кукес В.Г. 2003 «Участники» системы элиминации ксенобиотиков
- 40. Биотрансформация Биотрансформация или метаболизм – комплекс физико-химических превращений ЛС , в процессе которых образуются полярные водорастворимые
- 41. Фазы детоксикации или элиминации ксенобиотиков, в том числе ЛС О фаза – препятствие всасывания ЛС в
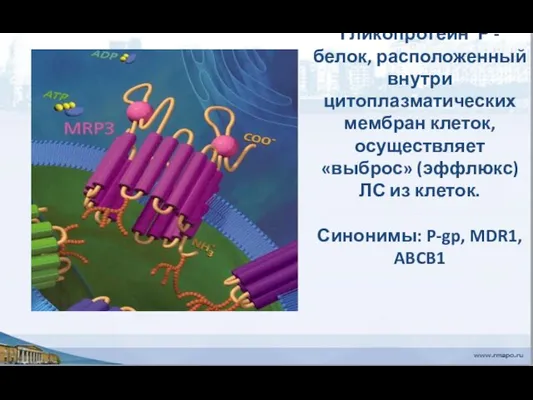
- 42. Гликопротеин Р - белок, расположенный внутри цитоплазматических мембран клеток, осуществляет «выброс» (эффлюкс) ЛС из клеток. Синонимы:
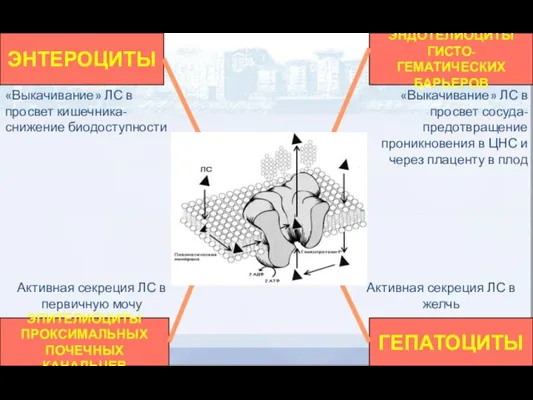
- 43. ЭНТЕРОЦИТЫ ЭПИТЕЛИОЦИТЫ ПРОКСИМАЛЬНЫХ ПОЧЕЧНЫХ КАНАЛЬЦЕВ ГЕПАТОЦИТЫ ЭНДОТЕЛИОЦИТЫ ГИСТО-ГЕМАТИЧЕСКИХ БАРЬЕРОВ «Выкачивание» ЛС в просвет кишечника- снижение биодоступности
- 44. Цитохром Р-450 Основная часть реакций I фазы биотрансформации катализируется гемопротеинами, так называемыми изоферментами цитохрома Р450 (CYP)
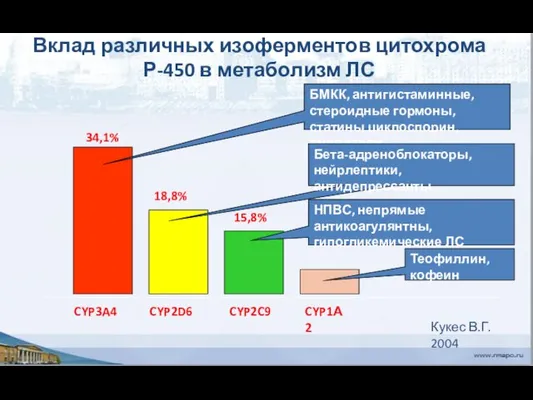
- 45. Вклад различных изоферментов цитохрома Р-450 в метаболизм ЛС Кукес В.Г. 2004 CYP3A4 CYP2D6 CYP2C9 34,1% 18,8%
- 46. Выведение лекарственных средств из организма Процесс экскреции, наряду с метаболизмом и распределением в тканях, определяет продолжительность
- 47. Основные пути выведения лекарственных средств из организма
- 48. Выведение лекарственного средства Элиминация – процесс удаления лекарственного средства из организма . Константа скорости элиминации (K
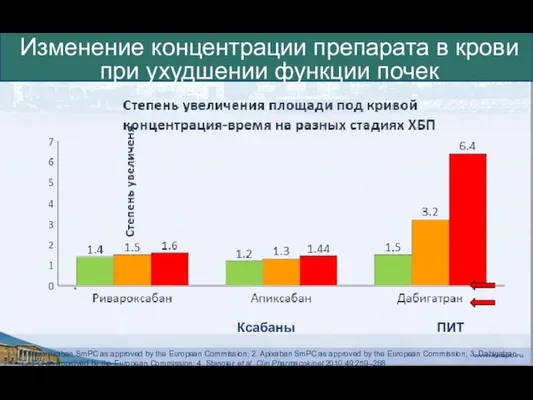
- 49. Фармакокинетика ПОАК Heidbuchel H., et al. Europace 2015;17:1467–507.
- 50. Изменение концентрации препарата в крови при ухудшении функции почек Ксабаны ПИТ * 1. Rivaroxaban SmPC as
- 51. 1.3. Фармакодинамика лекарственных средств
- 52. Фармакодинамика - раздел фармакологии изучающий совокупность эффектов лекарственных средств и механизмы их действия .
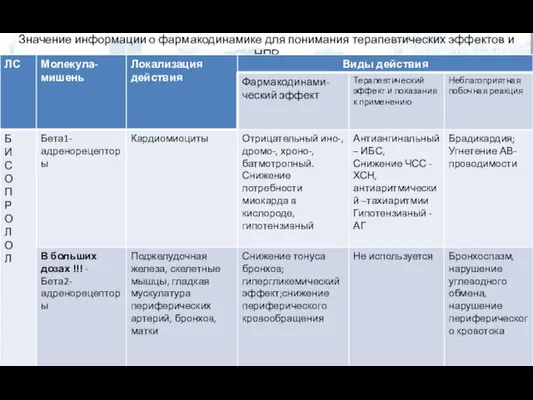
- 53. Зачем нужна врачу информация о фармакодинамике лекарственных средств и как ее интерпретировать? Механизм действия («молекулы-мишени»), локализация
- 54. Задачи: исследуются следующие процессы 1. Выявление желаемого и побочного эффектов 2. Установление выраженности эффекта а) минимальный
- 55. Задачи: исследуются следующие процессы 4. Установление дозы а) пороговые б) минимальные в) средние г) высшие д)
- 56. Задачи: исследуются следующие процессы 6. Динамика дозировок а) ударные б) поддерживающие 7. Характеристика дозирования а) терапевтический
- 57. Параметры фармакодинамики 1. Механизм действия ЛС - на специфические рецепторы - на активность ферментов - физико-химическое
- 58. Параметры фармакодинамики 3. Зависимость фармакотерапевтическиго эффекта от свойств ЛС и условий их применения - химическое строение,
- 59. Значение информации о фармакодинамике для понимания терапевтических эффектов и НПР
- 60. Чем выше селективность (избирательность) ЛС, тем выше безопасность, но хуже эффективность. Чем выше доза ЛС, тем
- 61. 1.4. Основы рационального комбинирования лекарств и прогнозирования клинически значимых межлекарственных взаимодействий
- 62. Актуальность От 6,2 до 6,7% назначенных рецептурных препаратов вступают в клинически значимые межлекарственные взаимодействия (МВ) В
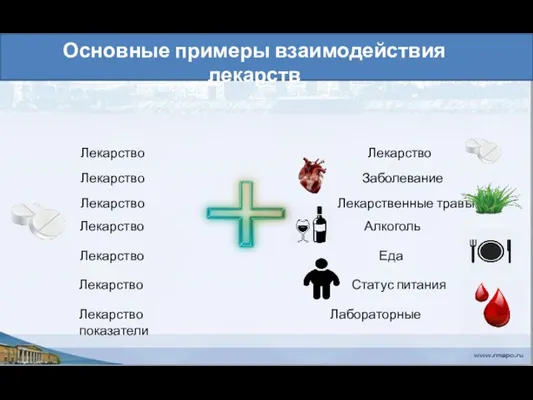
- 63. Межлекарственное взаимодействие Клинически значимое изменение действия одного ЛС в результате его совместного применения с другим ЛС
- 64. Основные примеры взаимодействия лекарств Лекарство Лекарство Лекарство Заболевание Лекарство Лекарственные травы Лекарство Алкоголь Лекарство Еда Лекарство
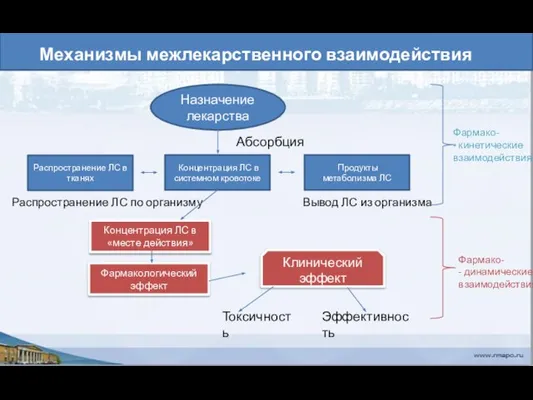
- 65. Механизмы межлекарственного взаимодействия Назначение лекарства Абсорбция Концентрация ЛС в системном кровотоке Продукты метаболизма ЛС Распространение ЛС
- 66. Фармакокинетические взаимодействия. Этап всасывания ЛС Hansten PD, Horn JR. The Top 100 Drug Interactions. A Guide
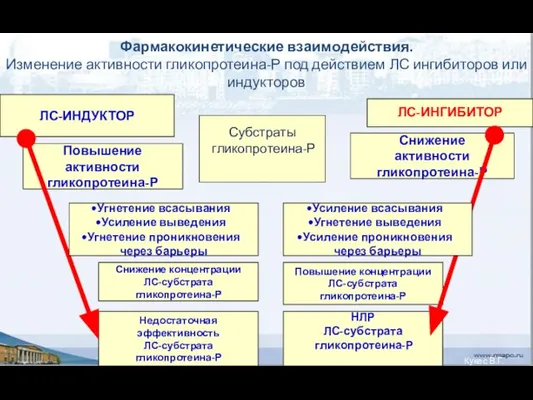
- 67. Фармакокинетические взаимодействия. Изменение активности гликопротеина-Р под действием ЛС ингибиторов или индукторов ЛС-ИНДУКТОР ЛС-ИНГИБИТОР Повышение активности гликопротеина-Р
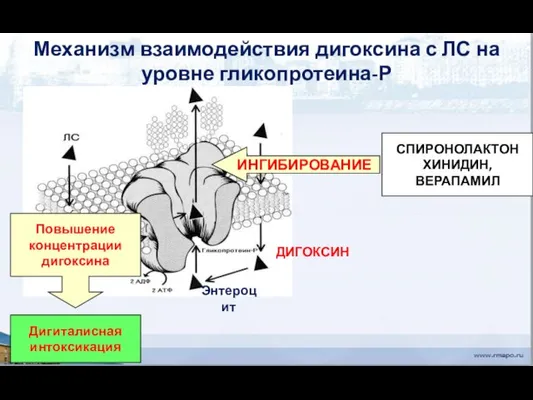
- 68. СПИРОНОЛАКТОН ХИНИДИН, ВЕРАПАМИЛ Механизм взаимодействия дигоксина с ЛС на уровне гликопротеина-Р ИНГИБИРОВАНИЕ ДИГОКСИН Энтероцит Дигиталисная интоксикация
- 69. Фармакокинетические взаимодействия. P-гликопротеин Пример: Дигоксин - субстрат Р-гликопротеина Хинин является ингибитором Р-гликопротеина. Он ингибирует выведение дигоксина
- 70. Примеры P-гликопротеин субстратов/индукторов/ингибиторов Hansten PD, Horn JR. The Top 100 Drug Interactions. A Guide to Patient
- 71. Фармакокинетические взаимодействия. Этап распространения ЛС в организме
- 72. Фармакокинетические взаимодействия. Этап метаболизма ЛС Основная система метаболизма ЛС: ферменты цитохрома Р450 Происхождение названия «Цитохром» (от
- 73. Фармакокинетические взаимодействия. Этап метаболизма ЛС Один и тот же фермент биотрансформации может метаболизировать разные ЛС, которые
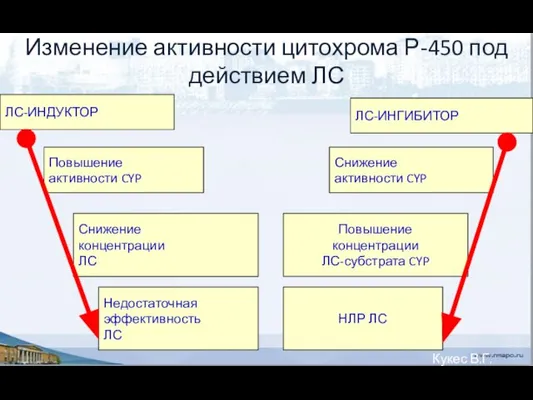
- 74. Изменение активности цитохрома Р-450 под действием ЛС ЛС-ИНДУКТОР ЛС-ИНГИБИТОР Повышение активности CYP Снижение активности CYP Снижение
- 75. Фармакокинетические взаимодействия. Этап метаболизма ЛС
- 76. Фармакокинетические взаимодействия. Примеры потенциальных МВ на этапе метаболизма ЛС US Food and Drug Administration . Drug
- 77. Фармакодинамические взаимодействия. Аддитивный эффект Назначение двух или более препаратов со схожими фармакодинамическими эффектами может привести к
- 78. Фармакодинамические взаимодействия. Антагонистическое действие Назначение двух или более препаратов со противоположными фармакодинамическими эффектами может привести к
- 79. Факторы риска развития межлекарственных взаимодействий. Факторы пациента Большое количество принимаемых ЛС (полипрагмазия) Тяжесть заболевания (основного и
- 80. Факторы риска развития межлекарственных взаимодействий. Факторы лекарственного средства Высокая доза Узкий терапевтический диапазон (например, дигоксин) Назначение
- 81. Факторы риска развития МВ. Другие факторы Возрастающая сложность схем лечения Отсутствие преемственности в оказании медицинской помощи
- 82. 3000 пациентов У 1 из 1000 пациентов случится клинически значимое МВ Вероятность выявления: 95% Активный мониторинг
- 83. Формирование стратегии по снижению риска возникновения МВ Создание системы контроля за регистрацией случаев межлекарственных взаимодействий Выявление
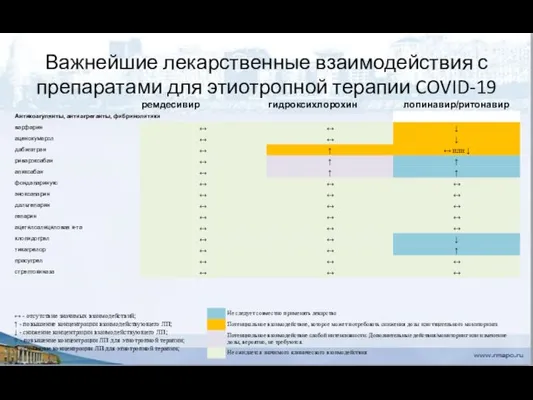
- 84. Важнейшие лекарственные взаимодействия с препаратами для этиотропной терапии COVID-19 ↔ - отсутствие значимых взаимодействий; ↑ -
- 85. Важнейшие лекарственные взаимодействия с препаратами для этиотропной терапии COVID-19 ↔ - отсутствие значимых взаимодействий; ↑ -
- 86. Важнейшие лекарственные взаимодействия с препаратами для этиотропной терапии COVID-19 ↔ - отсутствие значимых взаимодействий; ↑ -
- 87. Важнейшие лекарственные взаимодействия с препаратами для этиотропной терапии COVID-19 ↔ - отсутствие значимых взаимодействий; ↑ -
- 88. 1.5. Нежелательные лекарственные реакции: профилактика, диагностика, коррекция, мониторинг
- 89. «Если препарат лишен побочных эффектов, стоит задуматься есть ли у него какие-либо эффекты вообще» Академик АМН
- 90. Безопасность лекарственного средства и побочное действие Федеральный закон от 12.04.2010 года №61-ФЗ «Об обращении лекарственных средств»
- 91. Нежелательная реакция Решение совета Евразийской Экономической Комиссии от 3 ноября 2016 года №87 Об утверждении Правил
- 92. Нежелательное явление Решение совета Евразийской Экономической Комиссии от 3 ноября 2016 года №87 Об утверждении Правил
- 93. Серьезная и непредвиденная реакция Федеральный закон от 12.04.2010 года №61-ФЗ «Об обращении лекарственных средств» статья 4
- 94. Классификация нежелательных побочных реакций классификация Роулинса-Томпсона с 4-мя типами реакций (ABCD) Тип А- предсказуемые Тип В-
- 95. Классификация нежелательных побочных реакций Stephens' Detection of New Adverse Drug Reactions, 5th Edition. – 2004. Wiley.
- 96. Классификация НПР: тип А Тип А Предсказуемое действие Дозозависимое действие Более распространены (90% НЛР) Есть реакция
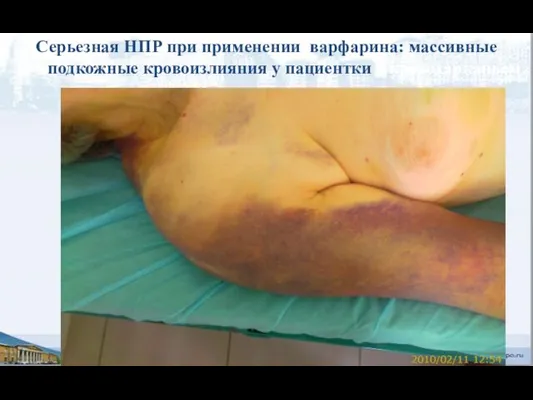
- 97. Серьезная НПР при применении варфарина: массивные подкожные кровоизлияния у пациентки с кровохарканьем
- 98. Возможные НПР при применении ЛП, рекомендованных для лечения COVID 19 Хлорохин и гидроксихлорохин обладают кардиотоксичностью Обязательна
- 99. ЭКГ-контроль Продолжительность интервала QT корригированного оценивается по формуле Bazett, она не должна превышать 480 мсек. При
- 100. Оценка риска развития и потенциальную тяжесть НПР типа А Тщательный сбор фармакологического анамнеза Оценка наличия факторов
- 101. Нежелательные побочные реакции Тип С Выделение нового типа реакций – типа C. НПР данного типа возникают
- 102. Классификация нежелательных побочных реакций Тип D (отсроченные эффекты), например … Канцерогенные эффекты Мутагенные эффекты Тератогенные реакции
- 103. Тип D Талидомид С 1956 по 1962 г. более 10 тыс. детей по всему миру родились
- 104. Факторы риска развития НПР «Крайние» возрастные категории Полипрагмазия Больные с патологией печени и почек Прием ЛС
- 105. Частота возникновения реакций (ВОЗ) Очень частые возникают более чем у 10% пациентов, принимающих ЛС Частые развиваются
- 106. Серьезные и несерьезные нежелательные реакции Серьезность реакции – это мера выраженности (интенсивности) причиненного или возможного вреда
- 107. Тяжесть нежелательной реакции Тяжесть реакции – это мера выраженности (интенсивности) протекания самой реакции Современный подход к
- 108. Тяжесть нежелательной реакции Тяжесть и серьезность – это разные характеристики реакции! Нежелательная реакция может быть тяжелой,
- 109. Предвиденность и предсказуемость реакций. Обратимость реакций. Предвиденность, также в литературе используются термин ожидаемость, указывает на наличие
- 110. Актуальность определения причинно-следственной связи Определение причинно-следственной связи «лекарство-реакция» предполагает получение доказательств причастности конкретного препарата к возникшим
- 111. Степени достоверности причинно-следственной связи Упсальского Центра мониторинга ВОЗ (WHO-UMC) Определенная Клинические проявления реакции, нарушения лабораторных показателей
- 112. Степени достоверности причинно-следственной связи (WHO-UMC) Условная Клинические проявления реакции, нарушения лабораторных показателей, отнесенные к проявлениям реакции,
- 113. Сравнение степеней достоверности причинно-следственной связи
- 114. Международная правовая основа Резолюция ВОЗ от 23 мая 1963 года №16.36 «Клиническая и фармакологическая оценка фармацевтических
- 115. Нормативно-правовая база мониторинга безопасности ЛС в РФ Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных
- 116. Федеральный закон № 61-ФЗ«Об обращении лекарственных средств» Глава 13.Статья 64 Фармаконадзор Пункт 3. Субъекты обращения ЛС
- 117. Методы фармаконадзора Метод спонтанных сообщений Метод активного (рецептурного) мониторинга Фармакоэпидемиологические: наблюдательные когортные исследования, исследования «случай–контроль», регистры
- 118. Метод спонтанных сообщений и его особенности Спонтанное сообщение - добровольное или в соответствии с законодательными требованиями
- 119. Принципы метода спонтанных сообщений и сроки подачи Сообщающий не должен решать, точно ли данный подозреваемый препарат
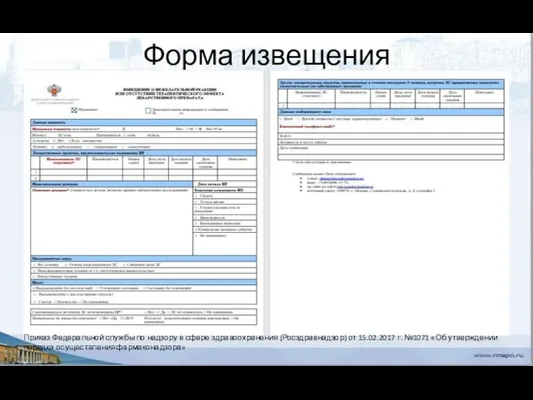
- 120. Форма извещения Приказ Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) от 15.02.2017 г. №1071 «Об
- 121. Активный мониторинг безопасности Создание системы поиска и сбора сообщений о нежелательных явлениях: Система «точек мониторинга» (Организация
- 122. Метод «триггеров» Триггер - индикатор или признак возможно развившейся нежелательной реакции Оценка триггеров - эффективный метод
- 123. Сайт Росздравнадзора – источник информации о регуляторных решениях
- 124. Критерии оценки работы медицинских организаций по фармаконадзору Знание сотрудниками медицинской организации законодательства в сфере мониторинга безопасности
- 125. Критерии оценки работы медицинских организаций по фармаконадзору Среднее число выявляемых нежелательных реакций, количество сообщений, направленных в
- 126. 1.6. Фармакоэкономика
- 127. Фармакоэкономика Фармакоэкономика (Pharmacoeconomics) – это отрасль экономики здравоохранения, изучающие клинические и экономические преимущества использования ЛС и
- 128. Основные методы фармакоэкономического анализа В настоящее время в мировой практике используется 4 основных метода: Анализ по
- 129. Анализ по критерию «затраты-эффективность» Сost/effectiveness analysis (CEA) (cost/efficacy analysis) - сравниваются лекарственные средства и протоколы лечения
- 130. Анализ «затраты-польза (утилитарность)» Cost/utility analysis (CUA) - (расчет затрат, приходящихся на достижение «полезного» с точки зрения
- 131. Анализ «затраты-прибыль» Cost/benefit analysis (CBA) - на этом этапе проводится расчет ожидаемой прибыли, предполагаемой пользы от
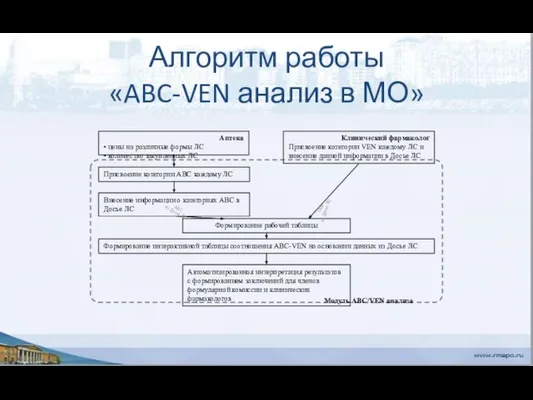
- 132. Анализ целесообразности затрат на закупки ЛС АВС-VEN-анализ, или оценка затрат позволяет выявить наиболее приоритетные ЛС, которые
- 133. Аптека • цены на различные формы ЛС • количество закупленных ЛС Клинический фармаколог Присвоение категории VEN
- 134. УСТАНОВЛЕННАЯ СУТОЧНАЯ ДОЗА (DDD) DDD — это расчетная средняя поддерживающая суточная доза лекарственного средства, применяемого по
- 135. 1.7. Фармакоэпидемиология
- 136. Фармакоэпидемиология Фармакоэпидемиология - это наука, изучающая с помощью эпидемиологических методов эффективность, безопасность и особенности использования лекарственных
- 137. Главные задачи фармакоэпидемиологических исследований: выявление новых, ранее неизвестных эффектов ЛС (как благоприятных, так и нежелательных); определение
- 138. 1.8. Лекарственный формуляр
- 139. Основные понятия Формуляр - перечень тщательно отобранных, рекомендованных с использованию ЛС. Формулярный справочник (формулярное руководство, формуляр)
- 140. Формулярная система в России В настоящее время иерархия формулярной системы в России представлена тремя уровнями: национальный
- 141. Формулярная система в России национальный (федеральный)уровень Национальный представлен комиссией МЗ РФ по формированию перечней ЛС и
- 142. Формулярная система в России территориальный уровень (уровень субъекта РФ) Формулярная система на территориальном уровне представлена формулярными
- 143. Формулярная система в России локальный уровень (уровень медицинской организации). На локальном уровне ФС осуществляют свою деятельность
- 144. Формулярная система в России В основной круг обязанностей ФК входят: анализ качества оказания медицинской помощи пациентам,
- 145. Формулярная система в России Стратегическая функция формуляров - формирование потребности в лекарственных средствах (для профильных отделений,
- 146. Формулярная система в России На основании приказа Формулярная комиссия МО отвечает за все аспекты функционирования формулярной
- 147. Формулярная система в России В РФ на локальном уровне создание и изменения формуляра входят в обязанности
- 148. 1.9. Источники информации о лекарственных препаратах: приниципы использования
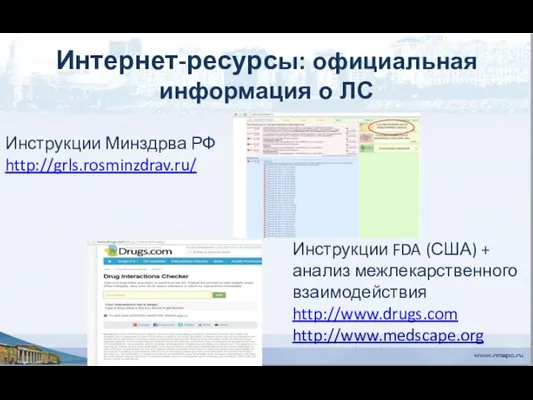
- 149. Интернет-ресурсы: официальная информация о ЛС Инструкции Минздрва РФ http://grls.rosminzdrav.ru/ Инструкции FDA (США) + анализ межлекарственного взаимодействия
- 150. Источники информации по межлекарственным взаимодействиям Государственный реестр лекарственных средств (https://grls.rosminzdrav.ru) Справочники РЛС Проверка взаимодействия лекарств (Medscape.com)
- 152. Ресурсы, посвященные неблагоприятным побочным эффектам ЛС: Ресурс содержит информацию о частоте неблагоприятных побочных эффектов, их классификацию
- 153. Темы для самостоятельной работы Назначение препаратов с предполагаемой этиотропной эффективностью off-label у пациентов с коронавирусной инфекцией
- 154. Контрольные вопросы Укажите взаимосвязь между фармакокинетикой и фармакодинамикой. Аллергические и псевдоаллергические реакции на лекарственные средства. Особенности
- 155. Рекомендуемая литература Приказ Министерства здравоохранения Российской Федерации от 19 марта 2020 №1984 «О временном порядке организации
- 156. Информация о коронавирусной инфекции Страница Всемирной организации здравоохранения (ВОЗ) https://www.who.int/emergencies/diseases/novel-coronavirus-2019 Страница о коронавирусе на сайте Минздрава
- 157. Список использованных сокращений ВОЗ – Всемирная организация здравоохранения ЛП – лекарственный препарат ЛС - лекарственное средство
- 159. Скачать презентацию































































































































 Лучевая диагностика заболеваний позвоночника и позвоночного канала. (Часть 2)
Лучевая диагностика заболеваний позвоночника и позвоночного канала. (Часть 2) Здоровьесберегающие технологии в работе с детьми с овз в условиях инклюзивного образования
Здоровьесберегающие технологии в работе с детьми с овз в условиях инклюзивного образования Проблемы госсанэпиднадзора за организациями общественного питания на промышленных предприятиях
Проблемы госсанэпиднадзора за организациями общественного питания на промышленных предприятиях Мембрано-пролиферативный гломерулонефрит
Мембрано-пролиферативный гломерулонефрит Отделение реанимации и интенсивной терапии
Отделение реанимации и интенсивной терапии МРТ-анатомия головного мозга
МРТ-анатомия головного мозга Сестринская помощь при кори и краснухе
Сестринская помощь при кори и краснухе Порушення в розвитку дітей: загальна характеристика
Порушення в розвитку дітей: загальна характеристика Методы обследования больных с заболеваниями сердечно-сосудистой системы
Методы обследования больных с заболеваниями сердечно-сосудистой системы Реконструктивно-пластические операции при огнестрельно-взрывных ранениях
Реконструктивно-пластические операции при огнестрельно-взрывных ранениях Medicine in the Middle Ages
Medicine in the Middle Ages Акушерские кровотечения при беременности, в родах, и послеродовом периоде. Геморрагический шок и синдром ДВС
Акушерские кровотечения при беременности, в родах, и послеродовом периоде. Геморрагический шок и синдром ДВС Кардиоваскулярлы жүйе
Кардиоваскулярлы жүйе Презентация
Презентация Патология тромбоцитарного звена гемостаза. Коагулопатии
Патология тромбоцитарного звена гемостаза. Коагулопатии Методы экспериментального изучения опухолевого роста
Методы экспериментального изучения опухолевого роста Изменения крови при физической нагрузке
Изменения крови при физической нагрузке Интеллекттің бұзылуы
Интеллекттің бұзылуы Алгоритм диагностики и лечения дисгормональных заболеваний молочной железы
Алгоритм диагностики и лечения дисгормональных заболеваний молочной железы Планирование семьи
Планирование семьи Федеральные клинические рекомендации по оказанию медицинской помощи детям с инфекцией мочевыводящих путей
Федеральные клинические рекомендации по оказанию медицинской помощи детям с инфекцией мочевыводящих путей Теоретическая подготовка к Всероссийской Олимпиаде по оториноларингологии
Теоретическая подготовка к Всероссийской Олимпиаде по оториноларингологии Заболевания детей раннего возраста. Рахит
Заболевания детей раннего возраста. Рахит Интеллект (от латинского слова intellectus – разумение, понимание, постижение)
Интеллект (от латинского слова intellectus – разумение, понимание, постижение) 10 аргументов, чтобы прекратить потребление алкоголя
10 аргументов, чтобы прекратить потребление алкоголя Нижний ИМ. Клиническое Значение
Нижний ИМ. Клиническое Значение Igiena vieţii sexuale
Igiena vieţii sexuale Маммография. Методы исследования молочной железы
Маммография. Методы исследования молочной железы