Содержание
- 2. Литература Кутлунина Н.А., Ермошин А.А. Молекулярно-генетические методы в исследовании растений : учеб.-метод. пособие. М-во образования и
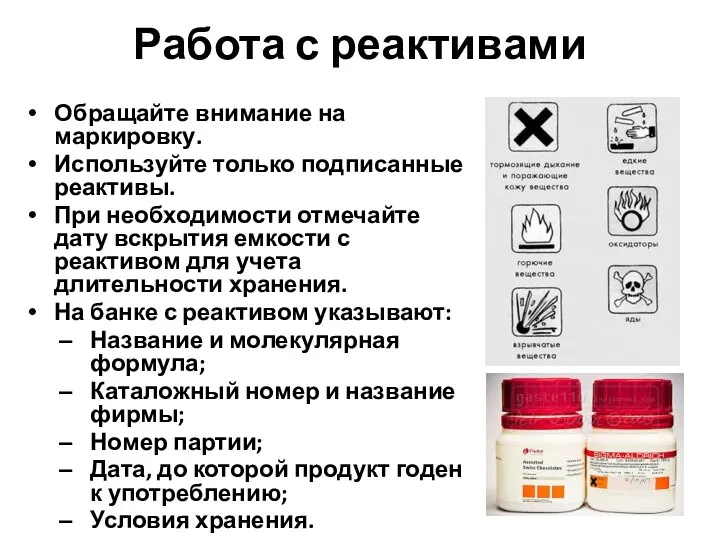
- 3. Работа с реактивами Обращайте внимание на маркировку. Используйте только подписанные реактивы. При необходимости отмечайте дату вскрытия
- 4. Взвешивание Если при взвешивании реактив (объект) попал на весы: НЕ НАДО ЕГО СДУВАТЬ! Следует аккуратно снять
- 5. Автоматическая пипетка Внимательно работайте с горячими, холодными, вязкими растворами и растворами с небольшим поверхностным натяжением. Отбор
- 6. Автоматическая пипетка Правила работы: Отжать пипетку до первого упора; Отбирать жидкость с поверхности, наконечник глубоко не
- 10. Ламинар-бокс Лабораторный прибор для работы с биологическими объектами в стерильных условиях. Шкаф, оборудованный осветителями, ультрафиолетовыми лампами
- 11. Зачем выделять НК? Выделение ДНК и РНК — важный шаг подготовки проб перед биохимическими и диагностическими
- 12. ПЦР ПЦР (полимеразная цепная реакция) представляет собой реакцию синтеза комплементарной цепочки ДНК на ДНК матрице, катализируемую
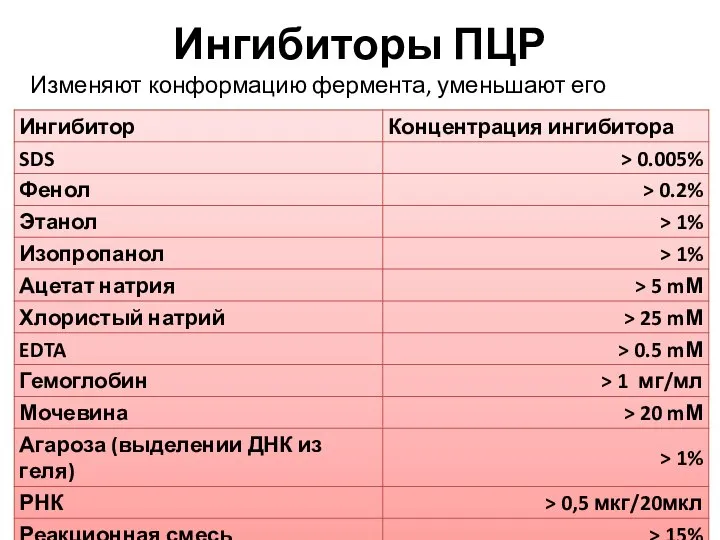
- 13. Ингибиторы ПЦР Изменяют конформацию фермента, уменьшают его активность.
- 14. Способы выделения НК осаждение НК на суспензионный носитель; выделение на колонках. Традиционные методы выделения являются надежными
- 15. Способы выделение НК https://vmtbio.ru/isolation-dna/ Фенол-хлороформная экстракция (Guanidinium Thiocyanate-Phenol-Chloroform Extraction). FTA-карты. С помощью коммерческих наборов (KITs) Силикатные
- 16. Растительный материал для выделения ДНК Выделять ДНК можно из свежих или замороженных (при минус 70–80 °С)
- 17. Особенности выделения ДНК из растительных объектов При выделении ДНК из растительных объектов необходимо дезактивировать клеточные ферменты,
- 18. Особенности выделения ДНК из растительных объектов В целом выделение ДНК включает обязательные процедуры: – разрушение клеток
- 19. После экстракции целесообразно проверить качество выделенной НК, например, измерить концентрацию с помощью флюориметра/спектрофотометра, провести гель-электрофорез или
- 20. Список оборудования для выделения ДНК Растительная ткань (замороженная жидким азотом, свежая или высушенная) Набор реагентов Центрифуга
- 22. 1 мл = 1000 мкл на 100 проб
- 23. 1. Внесение образца
- 24. Около 10 мг сухого образца
- 26. 2. Лизис клеток
- 27. Не забыть: Перчатки одеть Добавить реагент Сбросить наконечник («тип») Закрыть пробирки, баночки с реактивами
- 28. Удаление РНК
- 29. Трясем через каждые 20 мин
- 30. 3. Осаждение белков
- 32. 4. Осаждение ДНК
- 36. 5. Промывка и растворение ДНК
- 39. Скачать презентацию

































 Вирусные дерматозы
Вирусные дерматозы Поджелудочная железа
Поджелудочная железа Пренатальная диагностика
Пренатальная диагностика Острые деструктивные пневмонии у детей
Острые деструктивные пневмонии у детей Проблемы тяжелобольных пациентов
Проблемы тяжелобольных пациентов Ожоги и отморожения челюстно-лицевой области
Ожоги и отморожения челюстно-лицевой области Дифференциальная диагностика заболеваний, протекающих с лихорадкой
Дифференциальная диагностика заболеваний, протекающих с лихорадкой ЭКГ Аритмии
ЭКГ Аритмии Детоксикационная программа TianDe
Детоксикационная программа TianDe Нарушения обмена липидов
Нарушения обмена липидов Семиотика поражения мышечной системы у детей
Семиотика поражения мышечной системы у детей Вводная лекция. Оперативная хирургия: содержание и методы изучения. Операция ампутации конечностей
Вводная лекция. Оперативная хирургия: содержание и методы изучения. Операция ампутации конечностей Управление эмоциями в социальной работе
Управление эмоциями в социальной работе Тестирование
Тестирование Балалардағы ауыз қуысының аурулары, алдын – алу және емдеу
Балалардағы ауыз қуысының аурулары, алдын – алу және емдеу Молекулярный онкогенез
Молекулярный онкогенез Коронавирус. Мифы и реальность
Коронавирус. Мифы и реальность Семейная динамика
Семейная динамика Радиационная медицина. Острая лучевая болезнь
Радиационная медицина. Острая лучевая болезнь Влияние психосоматического состояния спортсмена на результативность в игровых видах спорта
Влияние психосоматического состояния спортсмена на результативность в игровых видах спорта Клиническая фармакология и основы гирудотерапии
Клиническая фармакология и основы гирудотерапии Конфликты на предприятии
Конфликты на предприятии Протезирование зубов на имплантатах
Протезирование зубов на имплантатах Анемии
Анемии Настои и отвары
Настои и отвары Молекулярные механизмы закладки, формирования и гистогенеза зубных зачатков
Молекулярные механизмы закладки, формирования и гистогенеза зубных зачатков Обмен липидов и его нарушение
Обмен липидов и его нарушение Тіркеу, Аурулардың халықаралық жіктелуі
Тіркеу, Аурулардың халықаралық жіктелуі