Содержание
- 2. Спин-орбитали группируются в оболочки по значениям квантовых чисел Оболочечная модель n, – оболочки ( n, )ν,
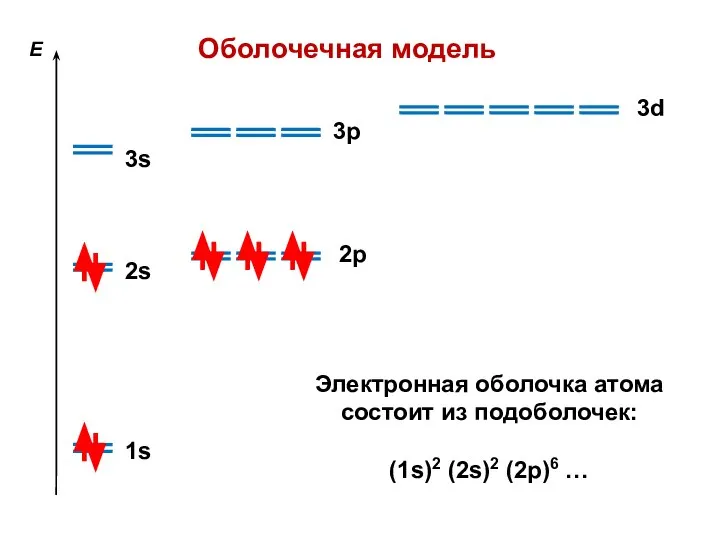
- 3. E 1s 2s 3s 2p 3p 3d Оболочечная модель Электронная оболочка атома состоит из подоболочек: (1s)2
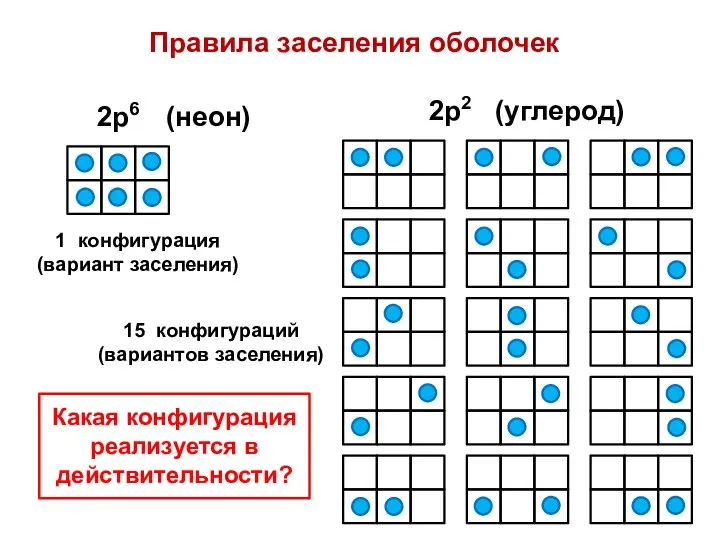
- 4. Правила заселения оболочек 2р2 (углерод) 1 конфигурация (вариант заселения) 15 конфигураций (вариантов заселения) Какая конфигурация реализуется
- 5. Полная энергия атома зависит от ряда параметров: 1) от орбитальных энергий и распределения электронов по атомным
- 6. Е = f ( |L|, |S|, |J| ) или E = f ( L, S, J
- 7. Атом углерода Электронная формула: (1s)2 (2s)2 (2p)2 J = L + S J = J1 +
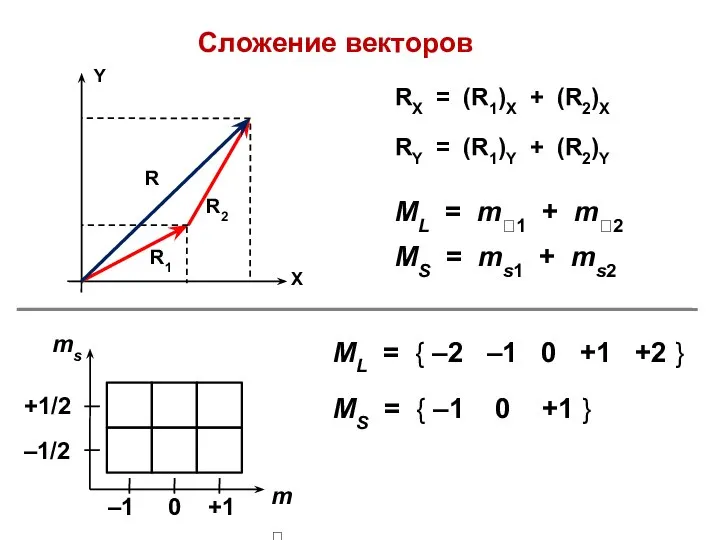
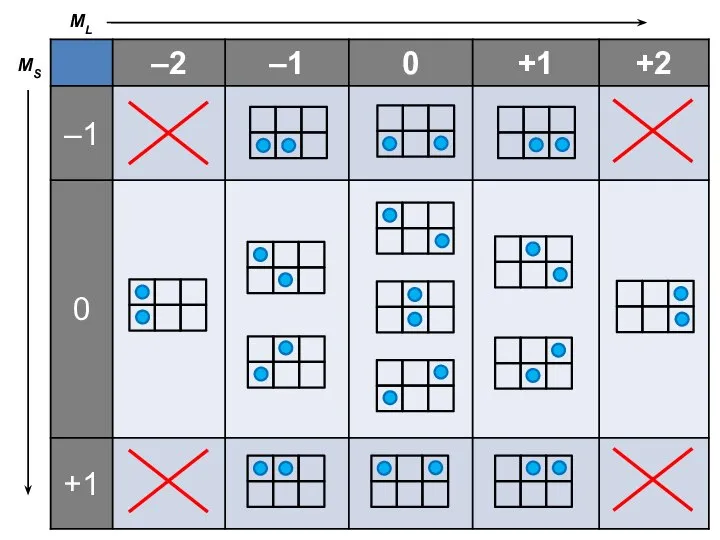
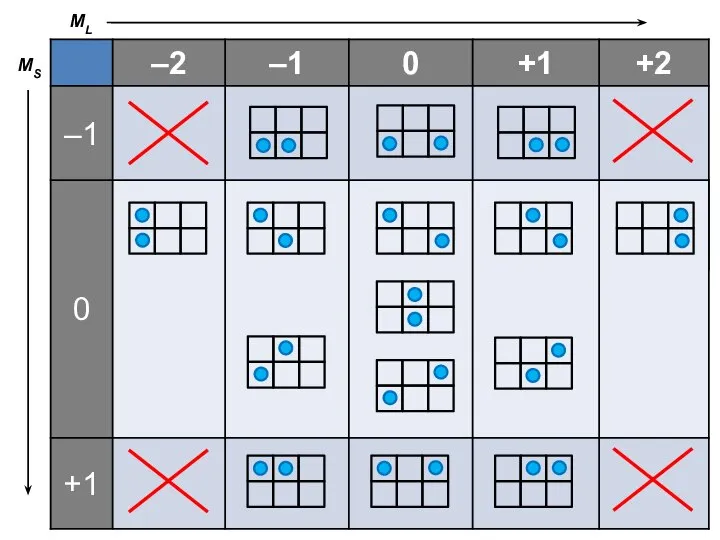
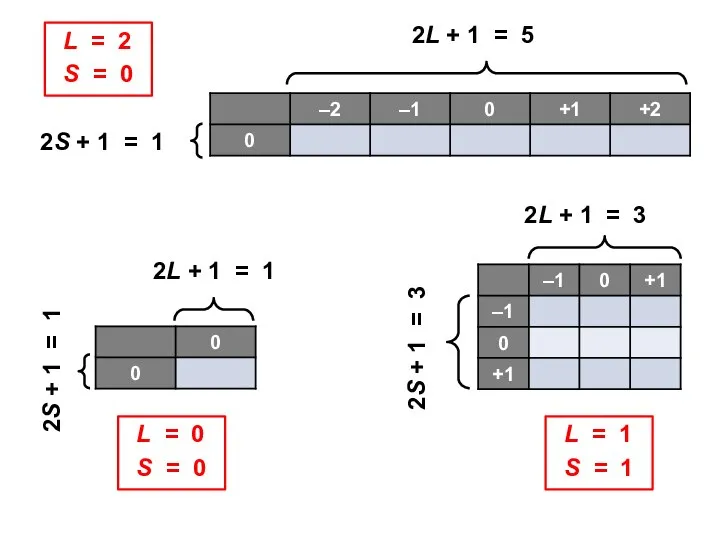
- 8. Сложение векторов ML = { –2 –1 0 +1 +2 } MS = { –1 0
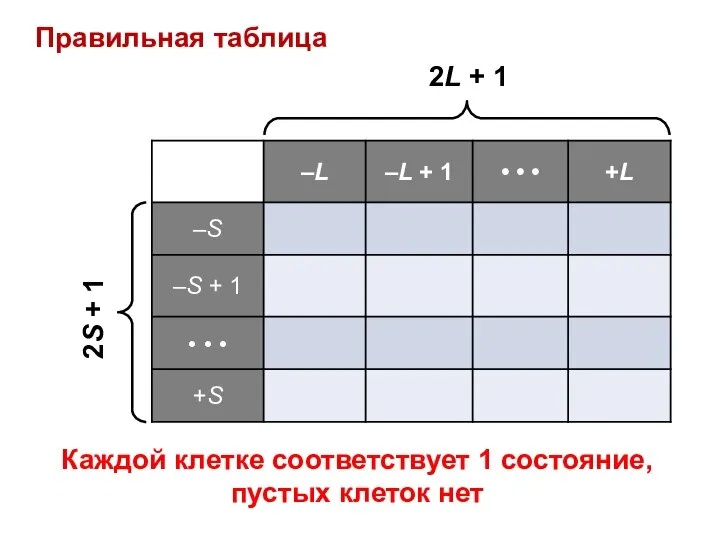
- 10. 2S + 1 2L + 1 Каждой клетке соответствует 1 состояние, пустых клеток нет Правильная таблица
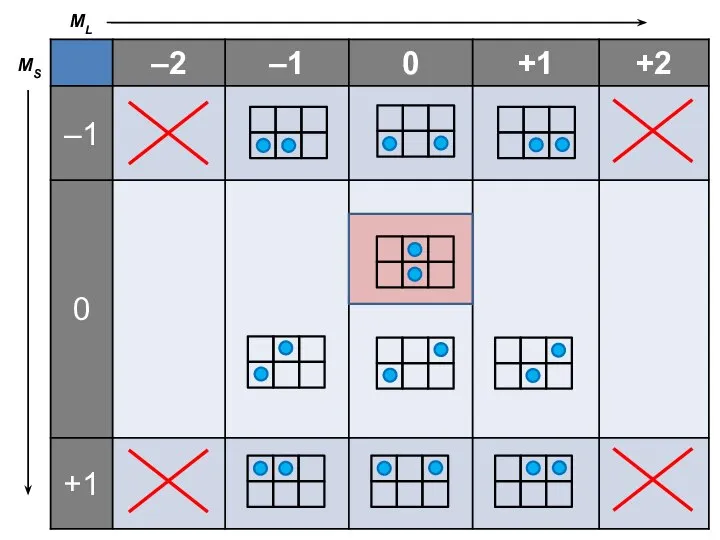
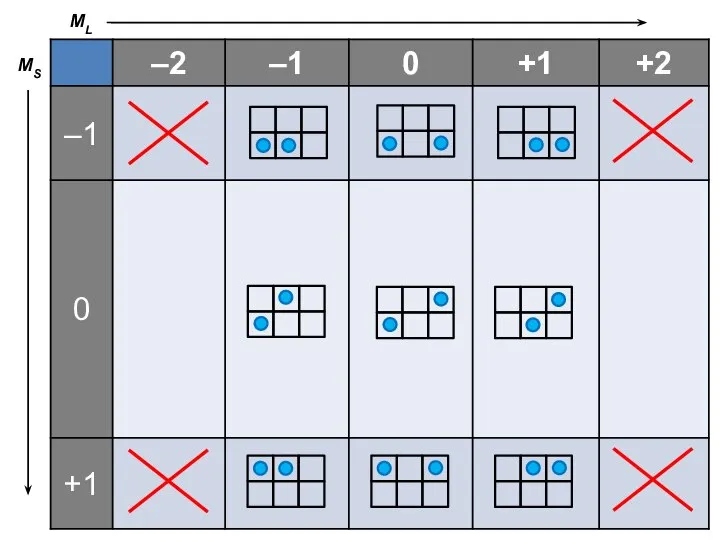
- 14. 2L + 1 = 1 2S + 1 = 1 2L + 1 = 3 2S
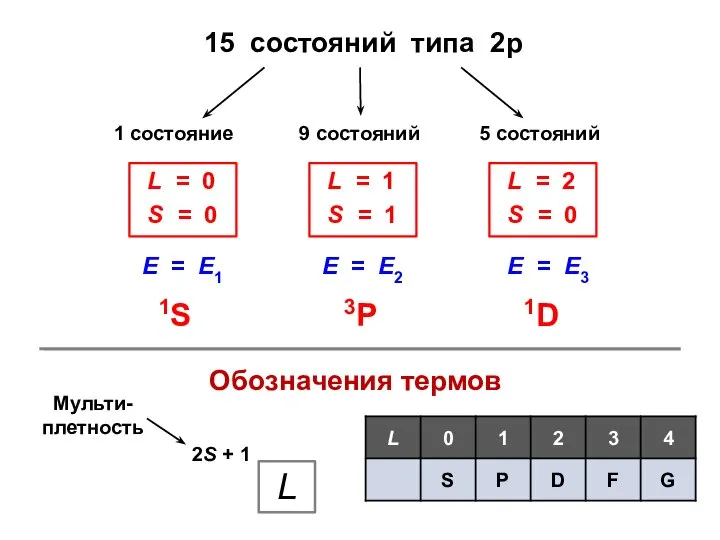
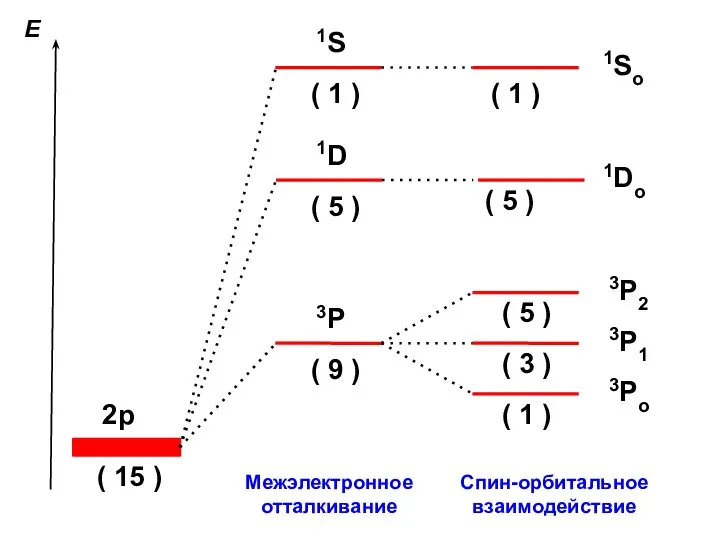
- 15. 15 состояний типа 2р Е = Е1 Е = Е2 Е = Е3 1S 3P 1D
- 16. Как располагаются термы на шкале энергии? 3P 1D 1S E
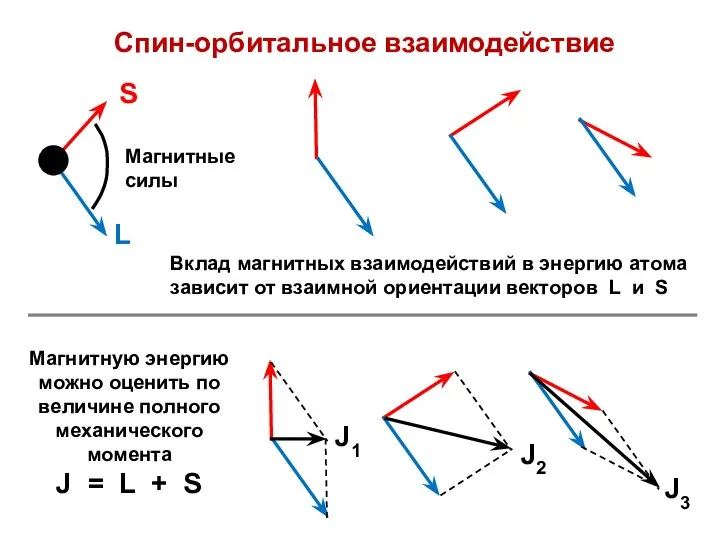
- 17. Спин-орбитальное взаимодействие Вклад магнитных взаимодействий в энергию атома зависит от взаимной ориентации векторов L и S
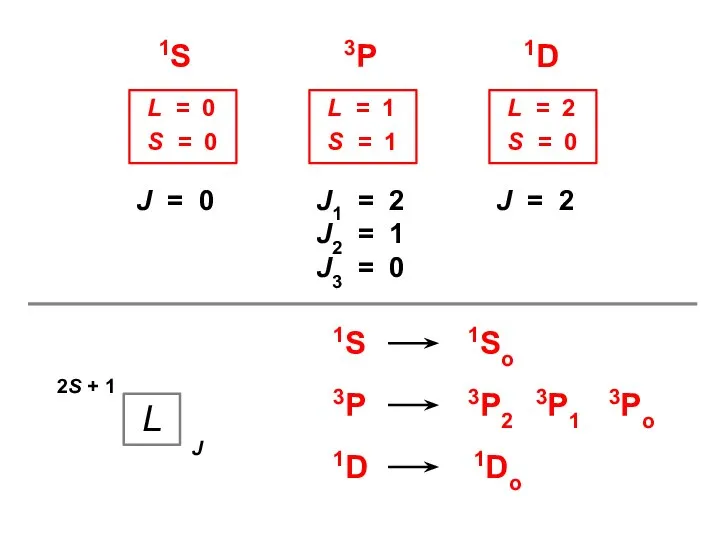
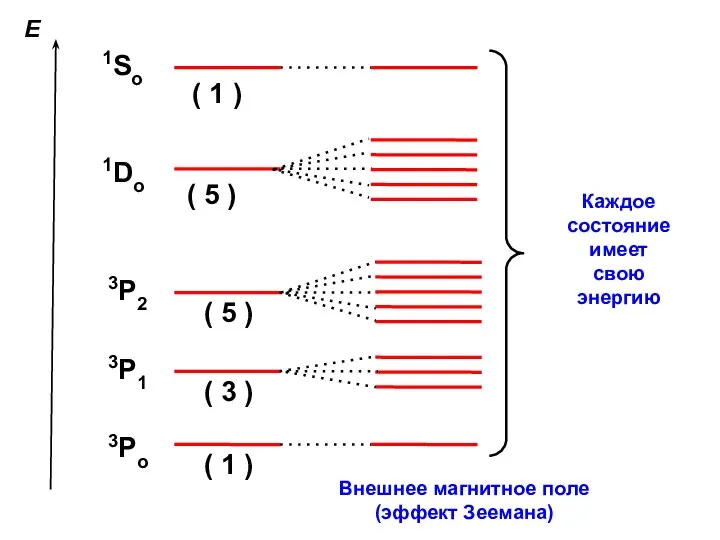
- 18. 1S 3P 1D J = 0 J1 = 2 J2 = 1 J3 = 0 J
- 19. Как располагаются подтермы на шкале энергии?
- 20. Межэлектронное отталкивание Спин-орбитальное взаимодействие
- 21. Внешнее магнитное поле (эффект Зеемана) Каждое состояние имеет свою энергию
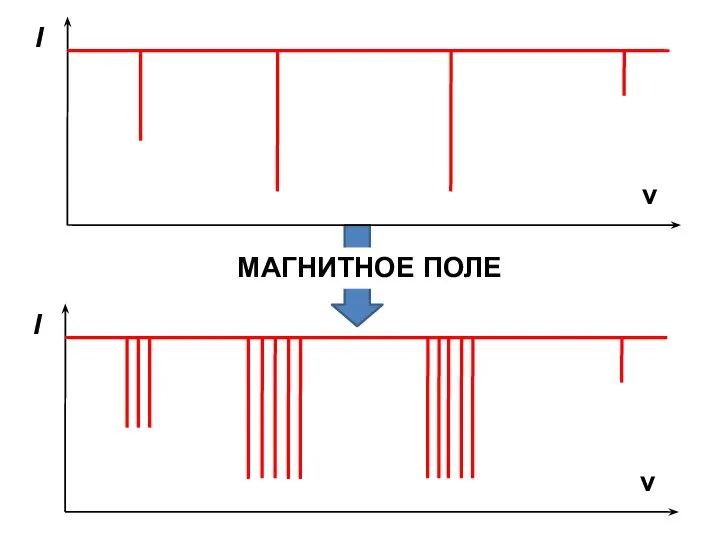
- 22. МАГНИТНОЕ ПОЛЕ
- 23. Домашнее задание Задача 7.1. Для указанного атомного терма определить характер расщепления за счет спин-орбитального взаимодействия. Изобразить
- 25. Скачать презентацию







 Статистическое моделирование
Статистическое моделирование Проверочная работа № 2 «Стили архитектуры»
Проверочная работа № 2 «Стили архитектуры» Cycling. History of cycling
Cycling. History of cycling Сталинград - презентация для начальной школы_
Сталинград - презентация для начальной школы_ История сестринского дела.
История сестринского дела. Штрафной бросок в баскетболе
Штрафной бросок в баскетболе ТИКО-изобретение_-_Солнечная_система_и_космическая_техника_из_ТИКО_Tw1TVIJ
ТИКО-изобретение_-_Солнечная_система_и_космическая_техника_из_ТИКО_Tw1TVIJ Основы методики воспитания двигательно-координационных способностей
Основы методики воспитания двигательно-координационных способностей Комплектность системы
Комплектность системы Содержание ограниченных вещных прав: право хозяйственного ведения и право оперативного управления.
Содержание ограниченных вещных прав: право хозяйственного ведения и право оперативного управления.  Технология разработки программного обеспечения (ТРПО)
Технология разработки программного обеспечения (ТРПО) Объекты ремонта
Объекты ремонта Исследование функции и построение графика 10 класс
Исследование функции и построение графика 10 класс Беттік жетекті винттік сорғыш қондырғының штанг бағаналарында болатын тербеліс механизмін зерттеу
Беттік жетекті винттік сорғыш қондырғының штанг бағаналарында болатын тербеліс механизмін зерттеу Традиционные промыслы и занятия коренных малочисленных народов Томской области
Традиционные промыслы и занятия коренных малочисленных народов Томской области От котлована до реализации: как Майкрософт поддерживает строительную индустрию
От котлована до реализации: как Майкрософт поддерживает строительную индустрию НРАВСТВЕННЫЙ ПОСТУПОК
НРАВСТВЕННЫЙ ПОСТУПОК Диагностика и лечение аномалий прикуса у взрослых
Диагностика и лечение аномалий прикуса у взрослых 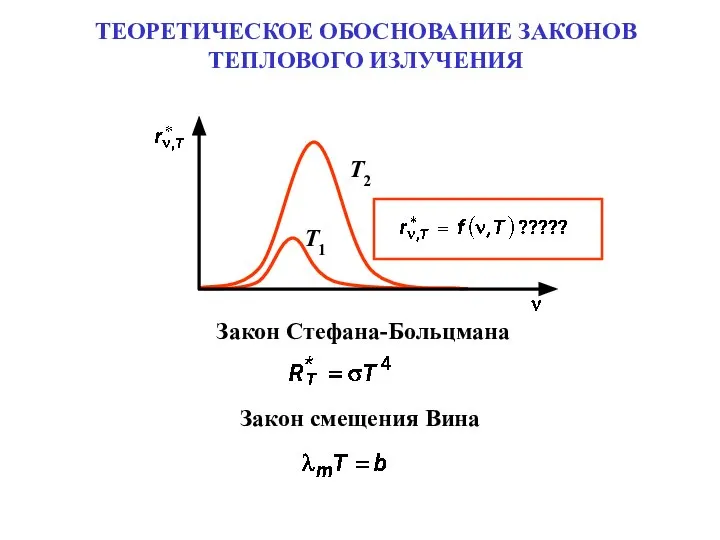 ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЗАКОНОВ ТЕПЛОВОГО ИЗЛУЧЕНИЯ
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЗАКОНОВ ТЕПЛОВОГО ИЗЛУЧЕНИЯ Реестр недобросовестных поставщиков, органы власти, уполномоченные на ведение реестра
Реестр недобросовестных поставщиков, органы власти, уполномоченные на ведение реестра  British police
British police Рельсо-балоный цех АО ЕВРАЗ НТМК. Прохождение практики
Рельсо-балоный цех АО ЕВРАЗ НТМК. Прохождение практики «Народный праздничный костюм»
«Народный праздничный костюм» Медиация как форма досудебного урегулирования
Медиация как форма досудебного урегулирования Свойства растворов. Планочные, отделочные и специальные растворы
Свойства растворов. Планочные, отделочные и специальные растворы Язвенная болезнь желудка и двенадцатиперстной кишки Язвенная болезнь желудка и двенадцатиперстной кишки Специальность 060101 «Л
Язвенная болезнь желудка и двенадцатиперстной кишки Язвенная болезнь желудка и двенадцатиперстной кишки Специальность 060101 «Л Закон о труде
Закон о труде Practical work №9. Internet Technology
Practical work №9. Internet Technology