Содержание
- 2. План: Морфология поперечно-полосатой мышцы. Мышечные белки. Небелковые вещества ткани мышц. Функциональная биохимия мышц. Механизм мышечного сокращения
- 3. Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора (реже гормона), проявляющаяся в уменьшении длины клетки.
- 4. Мышечная ткань составляет 40–42% от массы тела. При сокращении мышц осуществляется работа, связанная с превращением химической
- 5. МОРФОЛОГИЧЕСКАЯ ОРГАНИЗАЦИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ Поперечно-полосатая мышца состоит из многочисленных удлиненных волокон, или мышечных клеток . Двигательные
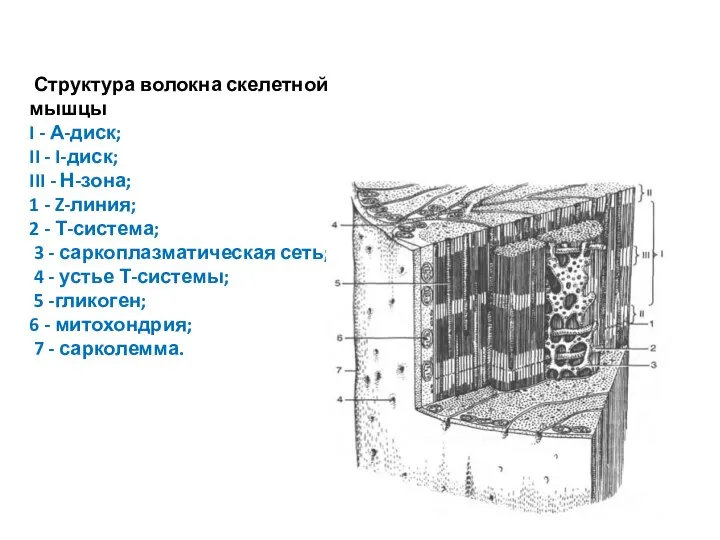
- 6. Структура волокна скелетной мышцы I - А-диск; II - I-диск; III - Н-зона; 1 - Z-линия;
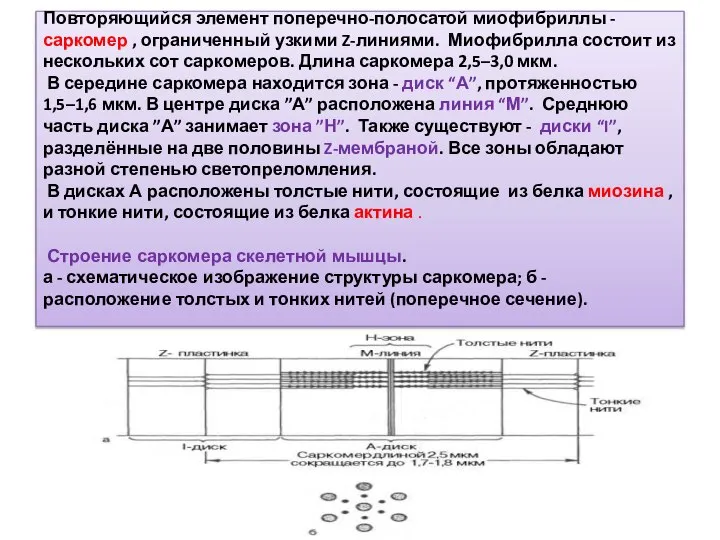
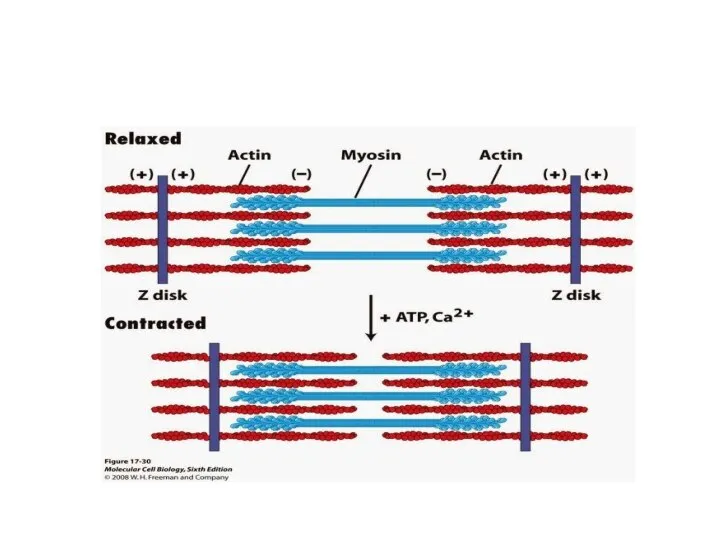
- 7. Повторяющийся элемент поперечно-полосатой миофибриллы - саркомер , ограниченный узкими Z-линиями. Миофибрилла состоит из нескольких сот саркомеров.
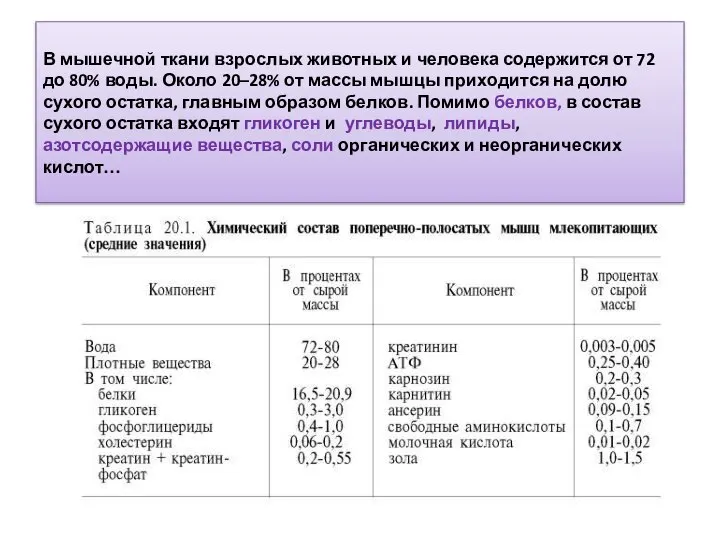
- 8. В мышечной ткани взрослых животных и человека содержится от 72 до 80% воды. Около 20–28% от
- 9. Мышечные белки. Белки мышечной ткани делят на три основные группы: миофибриллярные – 45% саркоплазматические -35% белки
- 10. Важнейшие белки миофибрилл: Сократительные – миозин, актин, актомиозин. Регуляторные- тропомиозин, тропонин.
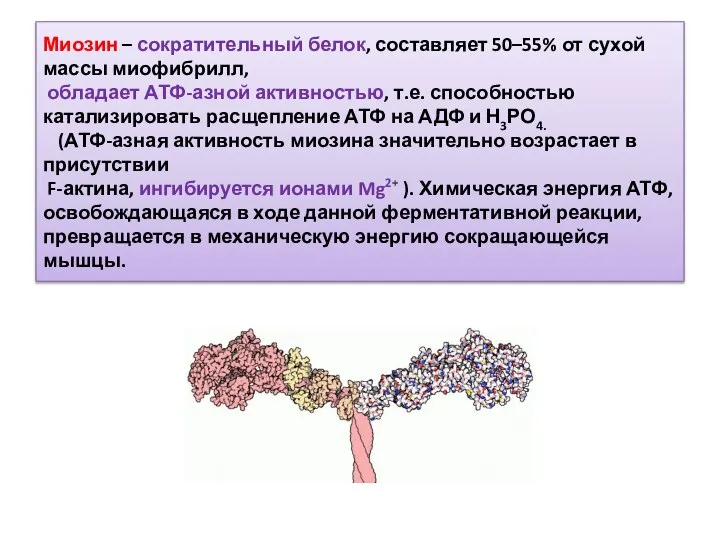
- 11. Миозин – сократительный белок, составляет 50–55% от сухой массы миофибрилл, обладает АТФ-азной активностью, т.е. способностью катализировать
- 12. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена на субъединицы: две
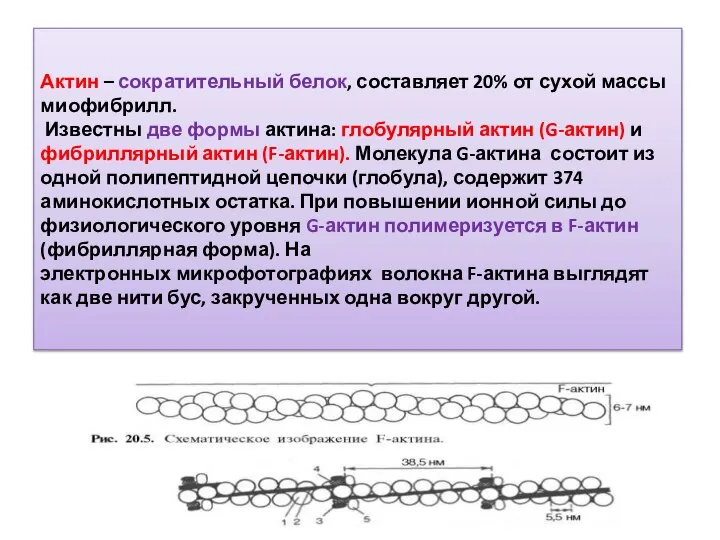
- 13. Актин – сократительный белок, составляет 20% от сухой массы миофибрилл. Известны две формы актина: глобулярный актин
- 14. Актомиозин -образуется при соединении миозина с F-актином., обладает АТФ-азной активностью. Актомиозин активируется ионами Mg2+ и ингибируется
- 15. Тропонин — регуляторный глобулярный белок. Составляет 2% от всех миофибриллярных белков. Содержится в скелетных мышцах и
- 16. В биохимии тропонин используется как диагностический маркер заболеваний миокарда. Два вида тропонинов - тропонин-I и тропонин-T
- 17. Тропомиозин — регуляторный фибриллярный белок (70 кДа). Состоит из двух перевитых α-спиралей. Тропомиозин связывается в единый
- 18. Белки саркоплазмы - протеины, растворимые в солевых средах с низкой ионной силой. К числу саркоплазматических белков
- 19. Миоглобин. Молекула миоглобина образована единичной полипептидной цепью (153 АК) и железосодержащим гемом, сходна по строению и
- 20. Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином.
- 21. Небелковые вещества мышечной ткани.
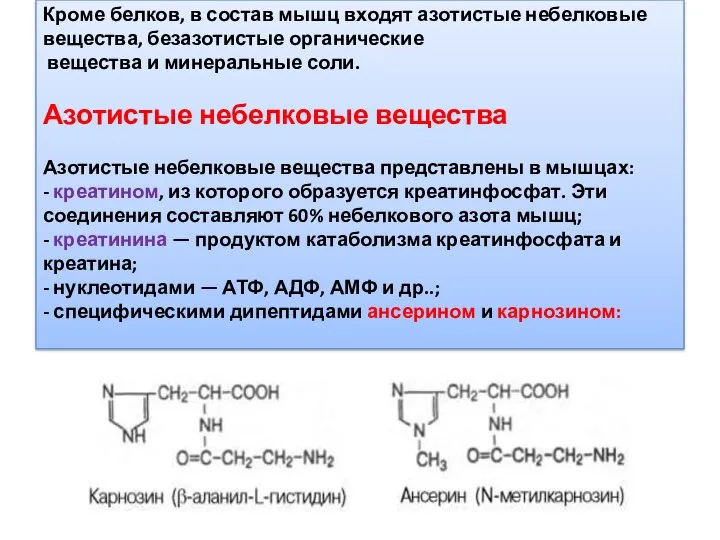
- 22. Кроме белков, в состав мышц входят азотистые небелковые вещества, безазотистые органические вещества и минеральные соли. Азотистые
- 23. Карнозин и ансерин увеличивают амплитуду мышечного сокращения, которая предварительно была снижена утомлением, путем повышения эффективности работы
- 24. Безазотистые органические вещества . представлены углеводами и липидами. Гликоген — до 2%, Свободная глюкоза —в следовых
- 25. Минеральные соли . 0,1 - 1,5% мышечной массы , представлены различными ионами. Из катионов преобладают К
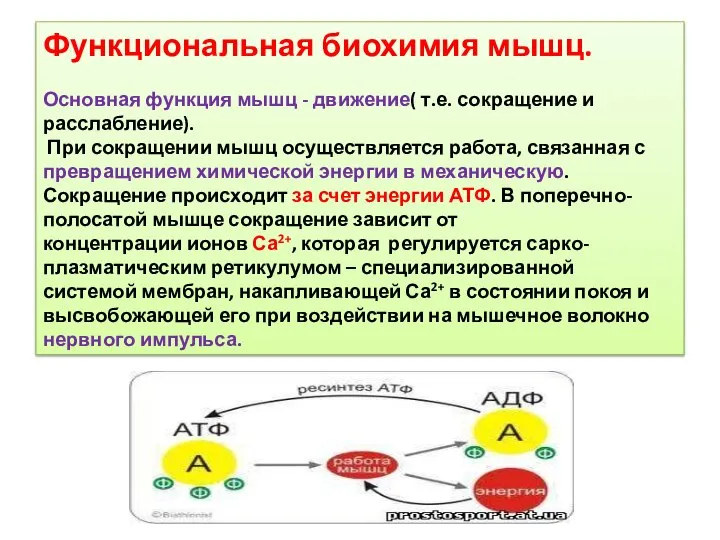
- 26. Функциональная биохимия мышц. Основная функция мышц - движение( т.е. сокращение и расслабление). При сокращении мышц осуществляется
- 27. Источники энергии для мышечных сокращений. Креатинфосфат и АТФ –высокоэнергетические соединения мышц. Креатинфосфат содержится преимущественно в возбудимых
- 28. Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход
- 29. Некоторое количество АТФ может ресинтезироваться в ходе аденилаткиназной (миокиназной) реакции
- 30. Запасы креатинфосфата в мышце невелики, расход его постоянно возмещается синтезом АТФ. Для любой ткани есть два
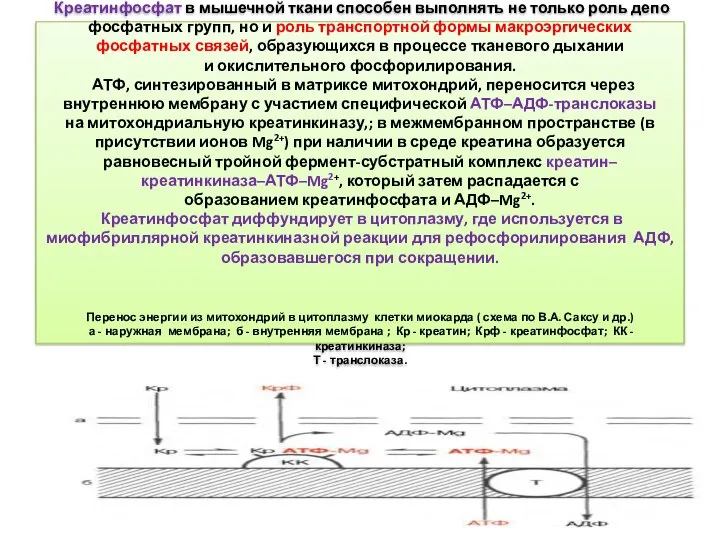
- 31. Креатинфосфат в мышечной ткани способен выполнять не только роль депо фосфатных групп, но и роль транспортной
- 32. При умеренной нагрузке мышца может покрывать свои энергетические затраты за счет аэробных реакций. При больших нагрузках,
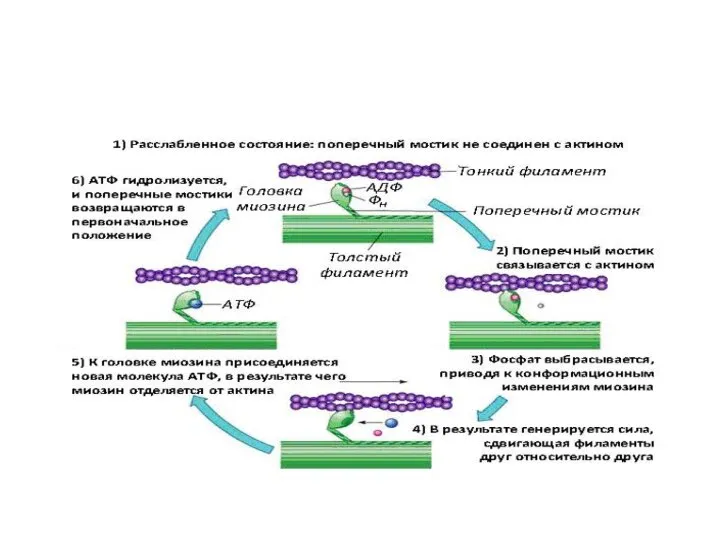
- 33. Механизм мышечного сокращения. Скольжение миозина относительно актина. Головки миозина расщепляют АТФ и за счет высвобождающейся энергии
- 36. - Источником энергии для мышечного сокращения являются молекулы АТФ. - Гидролиз АТФ катализируется при мышечном сокращении
- 37. В продвижении актиновых нитей вдоль миозиновых важную роль играют временно замыкающиеся между нитями поперечные мостики, которые
- 38. Биохимические изменения в мышцах при патологии Общими для большинства заболеваний мышц (мышечные дистрофии, атрофия, полимиозит, некоторые
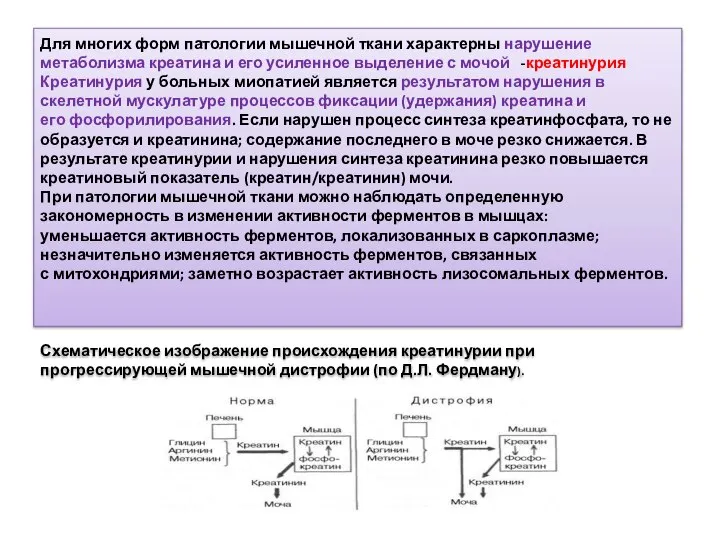
- 39. Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой
- 40. Миокард. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ
- 41. Нарушение метаболизма сердечной мышцы при ишемической болезни При ишемии миокарда снижено окислительное фосфорилирование и повышен анаэробный
- 42. Размер повреждения миокарда при возникновении ишемии, можно оценить по активности ферментов сыворотки крови- Креатинкиназа -. Содержится
- 44. Скачать презентацию






























 Роль показателей в реализации статистических методов изучения правонарушений
Роль показателей в реализации статистических методов изучения правонарушений Разработка гастрономического тура выходного дня в Таджикистане
Разработка гастрономического тура выходного дня в Таджикистане Vorbereitung für die kontrollarbeit (2)
Vorbereitung für die kontrollarbeit (2) Экономические показатели предприятия
Экономические показатели предприятия  Артикуляционный отдел
Артикуляционный отдел  Современная деревянная архитектура и традиции
Современная деревянная архитектура и традиции Микрофлора организма человека
Микрофлора организма человека «Практика применения вывозных таможенных пошлин (на примере нефти сырой и нефтепродуктов» Выполнили студенты 3 курса Гр.
«Практика применения вывозных таможенных пошлин (на примере нефти сырой и нефтепродуктов» Выполнили студенты 3 курса Гр.  Культура Месопотамии
Культура Месопотамии Место и роль динамической метеорологии
Место и роль динамической метеорологии  Трансформатор для дуговой электросварки
Трансформатор для дуговой электросварки  Спеціалізований туризм. Екстремальний туризм
Спеціалізований туризм. Екстремальний туризм ПОДГОТОВКА К ПЕДАГОГИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ ПРЕПОДАВАТЕЛЕЙ В ММА им. И.М. Сеченова
ПОДГОТОВКА К ПЕДАГОГИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ ПРЕПОДАВАТЕЛЕЙ В ММА им. И.М. Сеченова  Школьный кошелек. Оплата питания в школе без проблем
Школьный кошелек. Оплата питания в школе без проблем История футбола
История футбола Презентация Соление рыбы. Мороженная рыба.
Презентация Соление рыбы. Мороженная рыба. выполнил: студентка 13 гр. филологич.фак-та Савинова Татьяна проверил: Шереметьева О. А.
выполнил: студентка 13 гр. филологич.фак-та Савинова Татьяна проверил: Шереметьева О. А. Всемирное наследие в России
Всемирное наследие в России Файлы
Файлы Наноэлектроника. Физические основы. Методы формирования наноразмерных структур. Перенос носителей заряда
Наноэлектроника. Физические основы. Методы формирования наноразмерных структур. Перенос носителей заряда Пословицы и поговорки как выражение народной мудрости
Пословицы и поговорки как выражение народной мудрости НАДЕЛЕНИЕ ОРГАНОВ МЕСТНОГО САМОУПРАВЛЕНИЯ ОТДЕЛЬНЫМИ ГОСУДАРСТВЕННЫМИ ПОЛНОМОЧИЯМИ
НАДЕЛЕНИЕ ОРГАНОВ МЕСТНОГО САМОУПРАВЛЕНИЯ ОТДЕЛЬНЫМИ ГОСУДАРСТВЕННЫМИ ПОЛНОМОЧИЯМИ Мышечная ткань
Мышечная ткань Тренер в Зеленограде. Самбо. Дзюдо. Джиу-джитсу. ММА. Бокс. Художественная гимнастика. Самооборона. Йога
Тренер в Зеленограде. Самбо. Дзюдо. Джиу-джитсу. ММА. Бокс. Художественная гимнастика. Самооборона. Йога Любовь
Любовь Об особенностях финансовой поддержки экспорта услуг Подготовил Ивантей М. группа Т-093
Об особенностях финансовой поддержки экспорта услуг Подготовил Ивантей М. группа Т-093  Презентация "Оборудование предприятий" - скачать презентации по Экономике
Презентация "Оборудование предприятий" - скачать презентации по Экономике Жизнь средневекового человека
Жизнь средневекового человека