Содержание
- 2. Ферменты. История. Манассеина в споре с Бюхнером c доказывает, что ферменты могут работать как в клетке,
- 3. Ферменты Практически все реакции в клетке идут при участии ферментов. Ферменты –катализаторы белковой природы. Ферменты –простые
- 4. Сходство и различие с неорганическими катализаторами Ферменты –как и неорганические катализаторы : выходят из реакции в
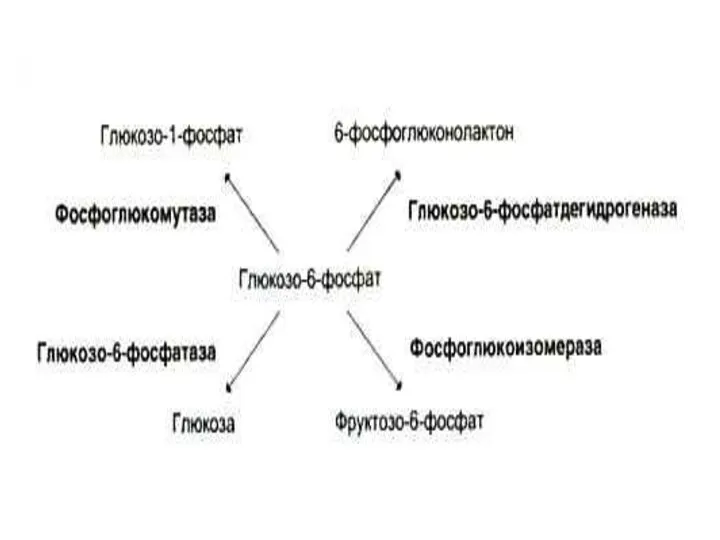
- 5. Субстратная специфичность ферментов Абсолютная (фермент катализирует реакцию только с одним субстратом):аргиназа, уреаза, ДНК-полимераза, аденилатциклаза Относительная или
- 7. Ферменты Конститутивные (синтезируются постоянно): ферменты гликолиза, окисления жирных кислот ит.д. Адаптивные, индуцибельные (синтезируются в определенных ситуациях,
- 8. Организация и структурированность ферментов Ферменты экскретируемые (работают во внешней среде, вне клеток): гидролазы пищеварительного тракта Ферменты
- 9. Ферменты клеточного метаболизма Растворимые (в цитозоле, матриксе лизосом, митохондрий): фосфофруктокиназа, кислая фосфатаза, малатдегидрогеназа) «Структурированные», ассоциированные с
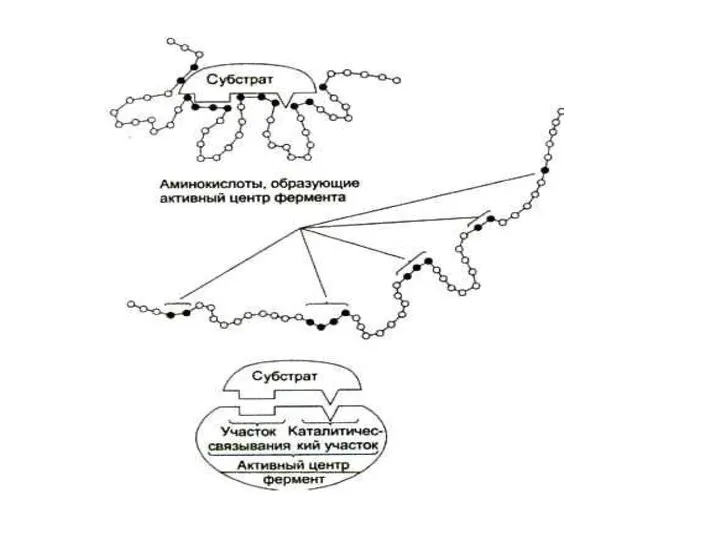
- 10. СТРОЕНИЕ ФЕРМЕНТОВ Активный центр (субстратный + каталитический участки) Аллостерические ферменты имеют еще регуляторный центр Активный центр
- 11. СТРОЕНИЕ ФЕРМЕНТОВ Каталитический центр «отвечает» за механизм катализа, большие группы ферментов могут иметь одинаковое строение каталитического
- 13. КАТАЛИТИЧЕСКИЙ УЧАСТОК ФЕРМЕНТОВ Каталитический центр простых ферментов состоит из реакционоспособных аминокислот: серин, треонин (ОН), аргинин (гуанидин),
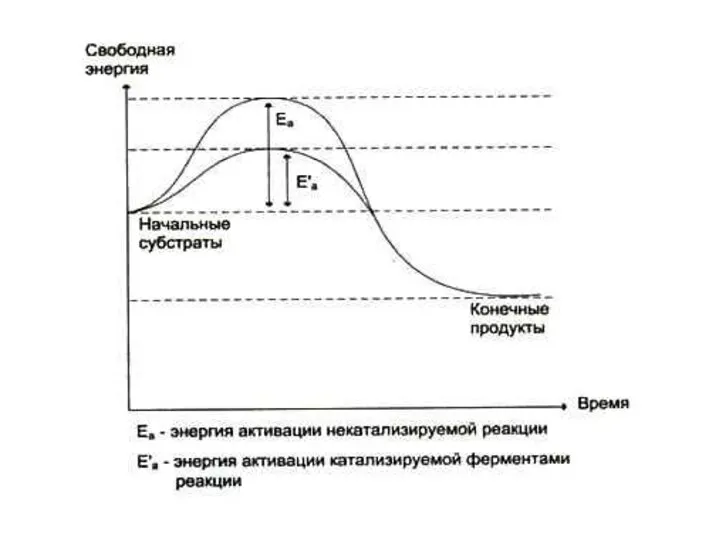
- 14. Как работают ферменты? Снижают энергию активации молекул субстрата. Скорость реакции пропорциональна количеству молекул, свободная энергия которых
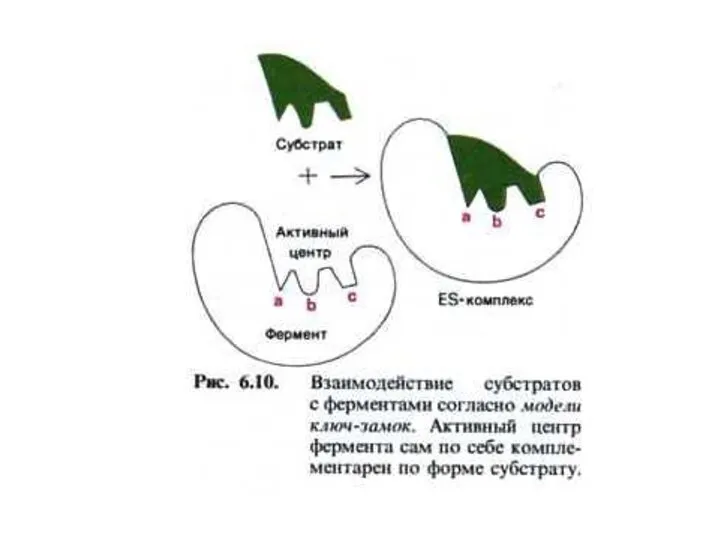
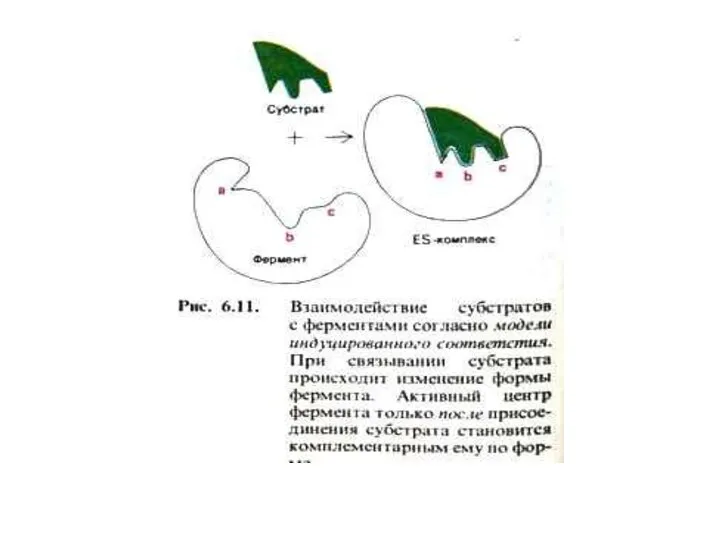
- 17. Механизмы катализа (гипотезы) Э.Фишер, 1890г. – гипотеза «шаблона», (ключ-замок). Объясняет только абсолютную специфичность ферментов. Кошланд –
- 20. Химизм катализа Кислотно-основной: молекулы ферментов в активном центре содержат функциональные группы, служащие донорами или акцепторами протонов
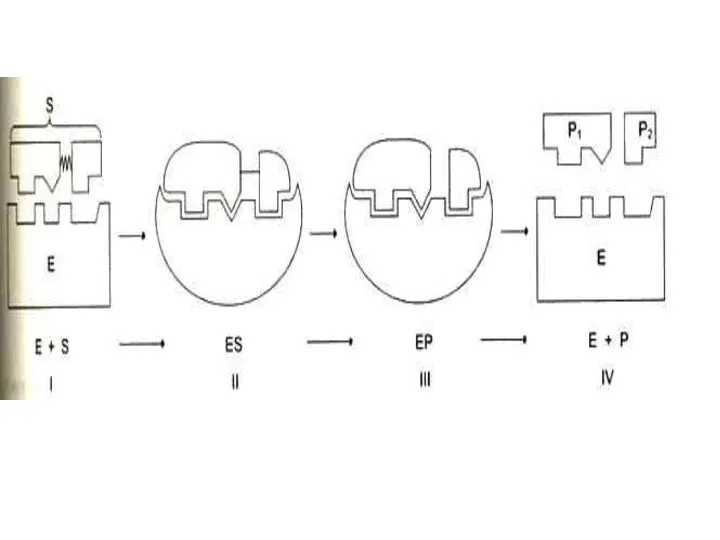
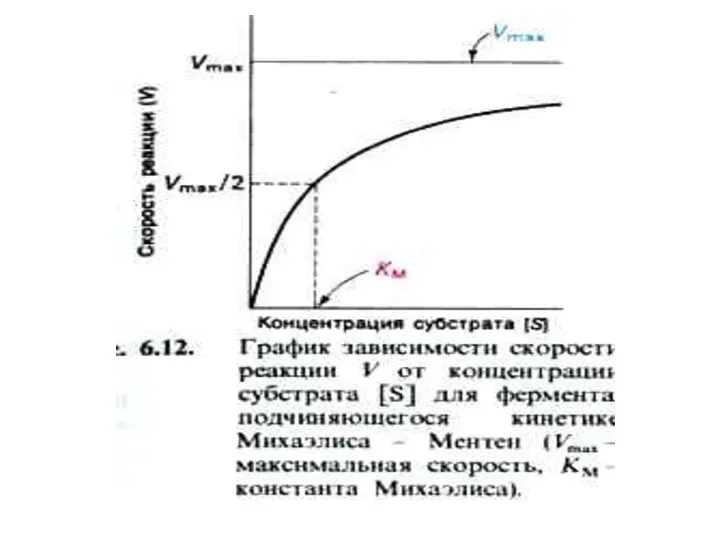
- 21. КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА L.Michaelis, M.Menten,1913г. k1 k3 S + E ES E + P k2 k4
- 22. КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА Л. Михаэлис и М. Ментен решают уравнение относительно [ES], когда реакция находится в
- 24. КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА [E] [S] [ES] = [S] + (k3 + k2) / k1 k3 +
- 26. Классификация ферментов JUBMB ввел международную классификацию ферментов . Шифр каждого фермента состоит из 4 цифр: 1.
- 27. Классификация ферментов. 1.ОКСИДОРЕДУКТАЗЫ 1.1 Дегидрогеназы SH2 + S* = S + S*H2 (ЛДГ,МДГ,АДГ) 1.2 Оксидазы SH2
- 28. Классификация ферментов 2.ТРАНСФЕРАЗЫ 2.1. Аминотрансферазы 2.2. Фосфотрансферазы 2.3. Метилтрансферазы 2.4. Глюкуронилтрансферазы 2.5. Сульфотрансферазы 2.7. РНК- и
- 29. Классификация ферментов 3. ГИДРОЛАЗЫ 3.1.Эстеразы 3.2 Гликозидазы 3.3. Пептидазы 3.4. Тиолазы 3.5. Рибонуклеазы 3.6. Амидазы 3.7.
- 30. Классификация ферментов 4. ЛИАЗЫ Отщепление каких-либо групп негидролитическим и неокислительным путем или присоединение групп (чаще всего
- 31. Классификация ферментов 5. ИЗОМЕРАЗЫ Внутримолекулярные превращения: внутримолекулярный перенос групп; перенос связей. Изомеразы, Мутазы, Рацемазы.
- 32. Классификация ферментов 6. ЛИГАЗЫ (СИНТЕТАЗЫ) Соединение 2-х молекул с использованием знергии гидролиза макроэргической связи АТФ (синтетаза,
- 33. Определение активности ферментов Содержание (количество) фермента определить невозможно. Определяют активность фермента = скорость реакции. Для этого
- 34. Единицы ферментативной активности Общая активность : количество молей субстрата (или продукта) за единицу времени.(моль/час, ммоль/мин, мкмоль/сек).
- 35. Единицы ферментативной активности 1МЕ соответствует количеству фермента, катализирующего превращение 1 мкмоля субстрата за 1 мин 1
- 36. Регуляция активности ферментов Скорость ферментативных реакций (активность ферментов) зависит от: [ E ], [S ], [
- 37. Регуляция активности ферментов Количество фермента находится под генетическим контролем, определяется скоростью синтеза и распада ферментных молекул.
- 38. Регуляция активности ферментов Зависимость от рН среды –специфическое свойство биокатализаторов. Каждый фермент имеет opt значение рН
- 39. Регуляция активности ферментов Зависимость активности ферментов от t0 среды подчиняется законам термодинамики. Для ферментов коэффициент Q10
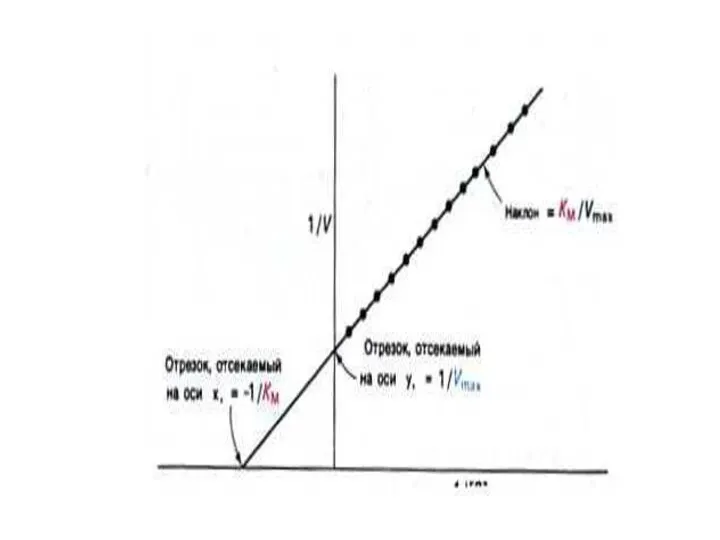
- 40. Регуляция активности ферментов Зависимость скорости реакции от [S] различна для «Михаэлисовских» ферментов и аллостерических. Для всех
- 41. Регуляция активности ферментов Зависимость скорости реакции от [P]: На начальных этапах реакции, когда [P] мала, равновесие
- 42. Регуляция активности ферментов Профермент – активный фермент: Лимитированный протеолиз Ковалентная модификация (фосфорилирование, ацетилирование, аденилирование и т.д.)
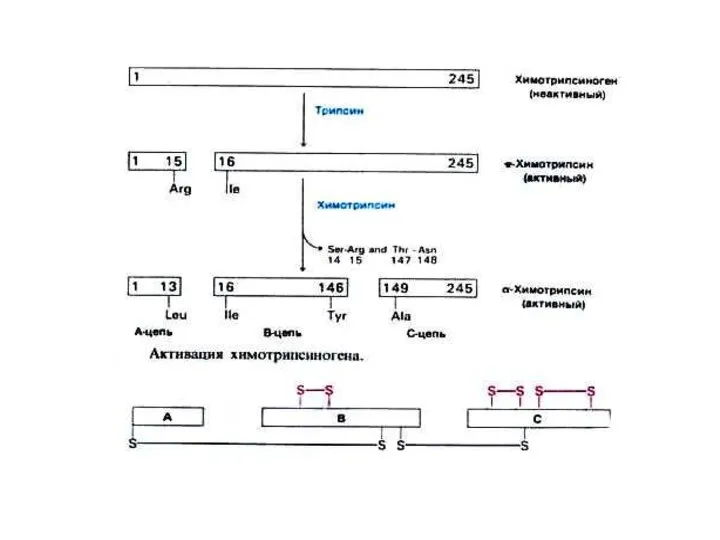
- 43. Регуляция активности ферментов Лимитированный (ограниченный) протеолиз: Профермент синтезируется в виде крупной молекулы –предшественника Подвергается гидролизу специфическими
- 45. Регуляция активности ферментов Ковалентная модификация: Е – ОН ? Е – О-РО3 (протеинфосфотранфераза фосфорилирует ферментный белок
- 47. Регуляция активности ферментов Белок –белковые взаимодействия: Ассоциация – диссоциация белковых субъединиц: G – белковый комплекс, фосфопротеинкиназа
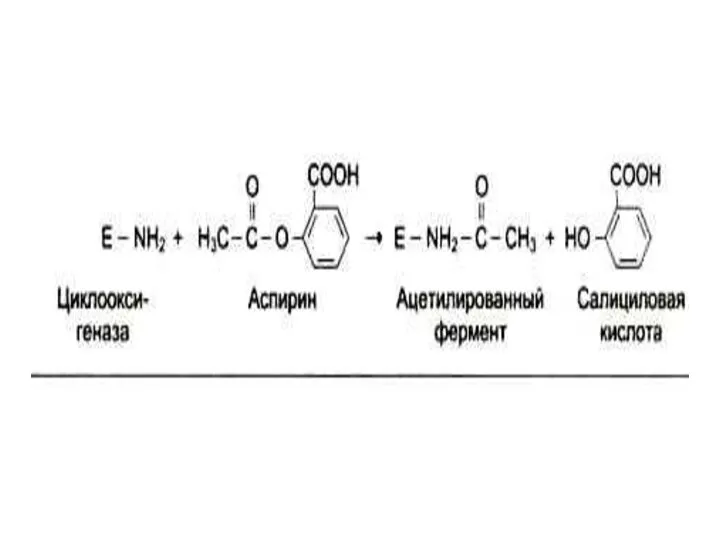
- 48. Регуляция активности ферментов Действие активаторов и ингибиторов: Ингибиторы по прочности связывания с ферментом м.б. необратимыми (комплекс
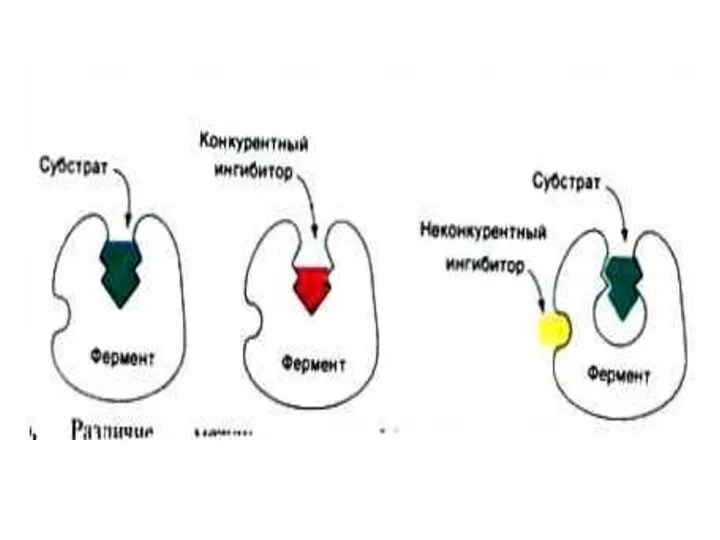
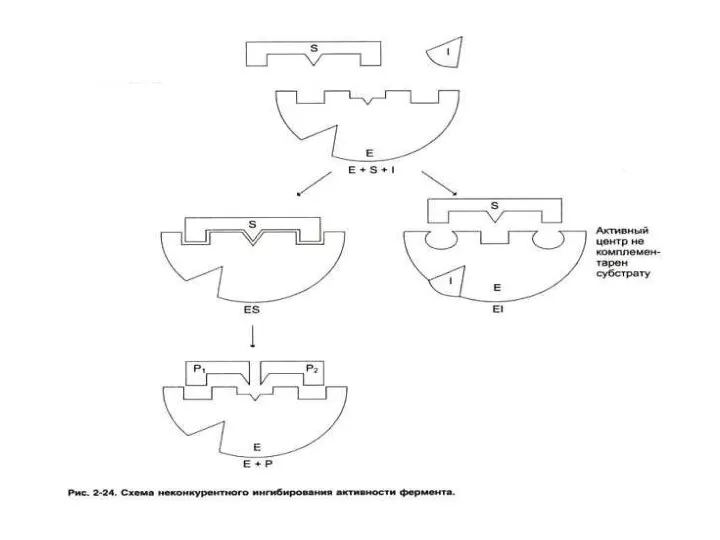
- 50. Регуляция активности ферментов Ингибиторы по механизму действия: Конкурентные (ингибитор- структурный аналог субстрата, связывается в активном центре
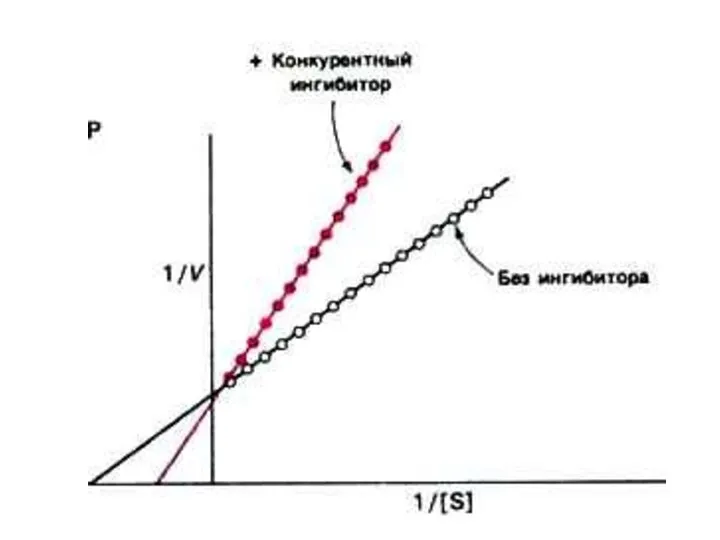
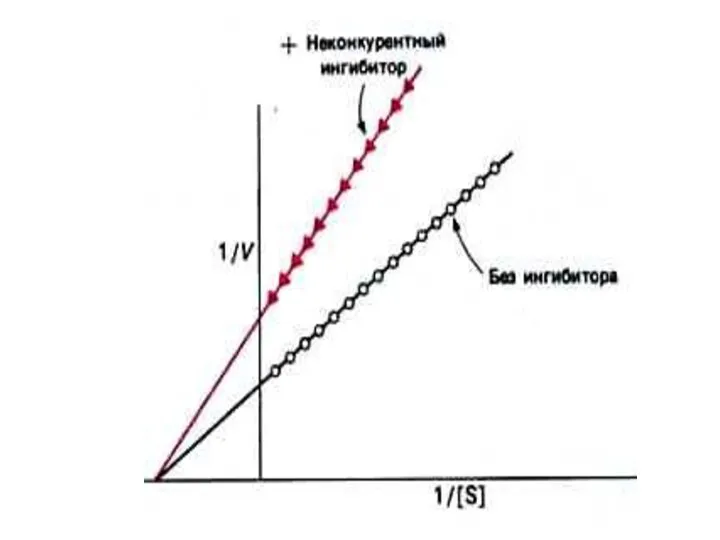
- 52. Конкурентное и неконкурентное ингибирование активности ферментов Кинетика конкурентного и неконкурентного ингибирования различна: Конкурентный ингибитор снижает сродство
- 54. Конкурентное и неконкурентное ингибирование активности ферментов Неконкурентный ингибитор снижает скорость реакции до величины Vmax / (1
- 57. Изоферменты –молекулярные формы ферментов Разные молекулярные формы одного фермента (катализируют одну и ту же реакцию) в
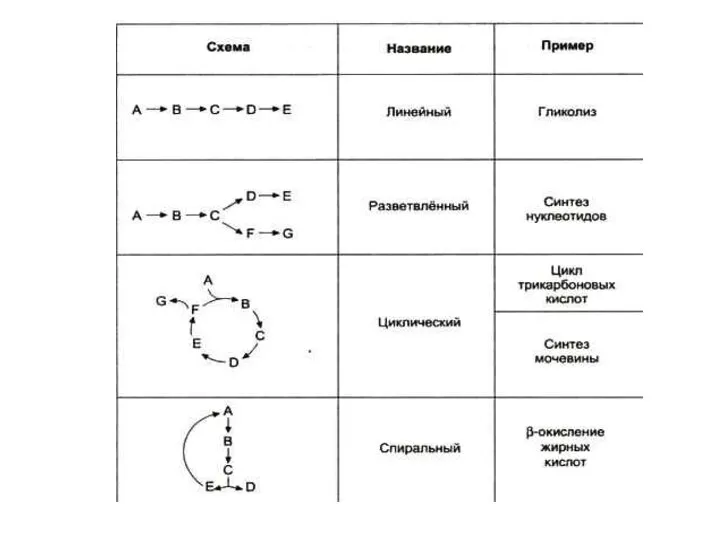
- 58. Компартментализация Важный момент регуляции скорости метаболических путей в эукариотической клетке. Участие мембран заключается и в интеграции
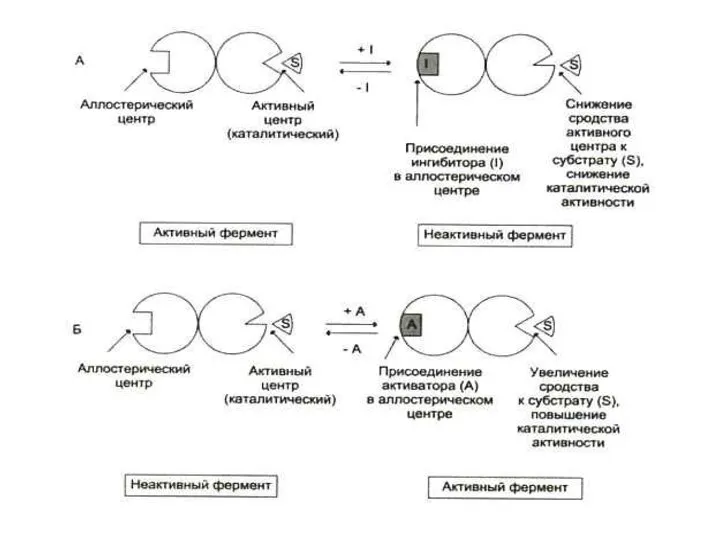
- 59. Аллостерические ферменты «ИНЫЕ»! Не подчиняются кинетике Михаэлиса – Ментен. Кроме каталитического центра имеют еще один, другой
- 60. Аллостерические ферменты Эффекторами чаще всего служат метаболиты данного ферментативного процесса. Неспецифическими регуляторами часто служат нуклеотиды: NAD,
- 62. Аллостерические ферменты Как правило, аллостерические ферменты катализируют ключевые (лимитирующие скорость) реакции метаболических путей. Аллостерические ферменты катализируют
- 64. Кофакторы и коферменты Холофермент = кофермент (кофактор) + + апофермент. Коферменты (кофакторы) – низкомолекулярные, термостабильные простетические
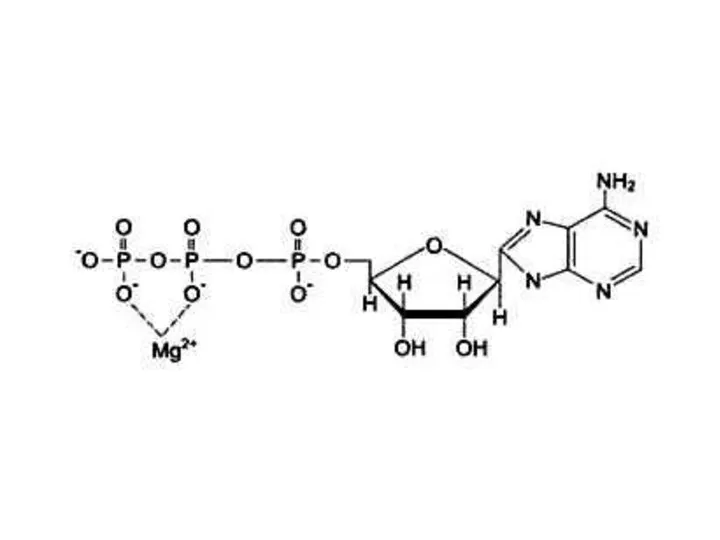
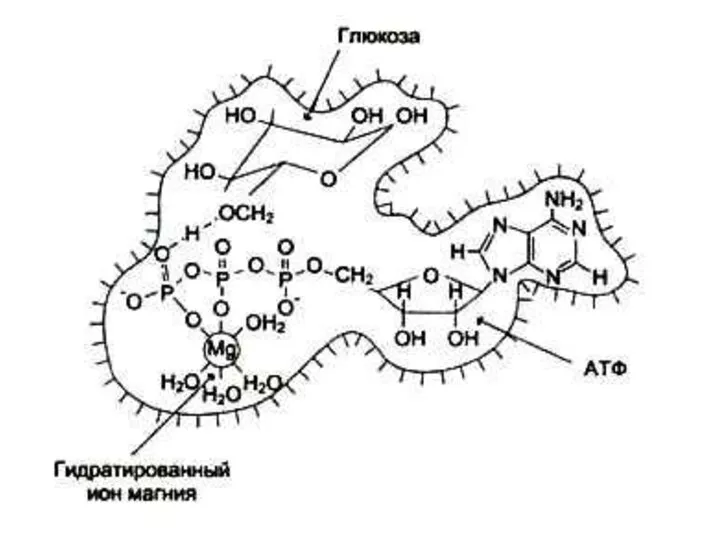
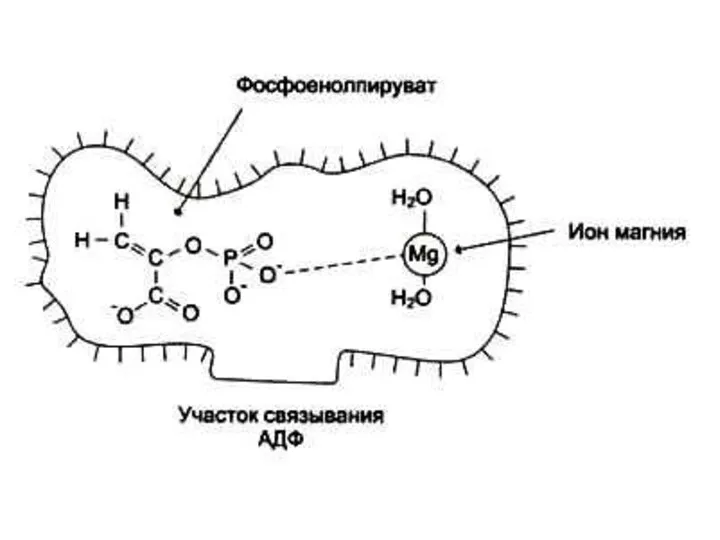
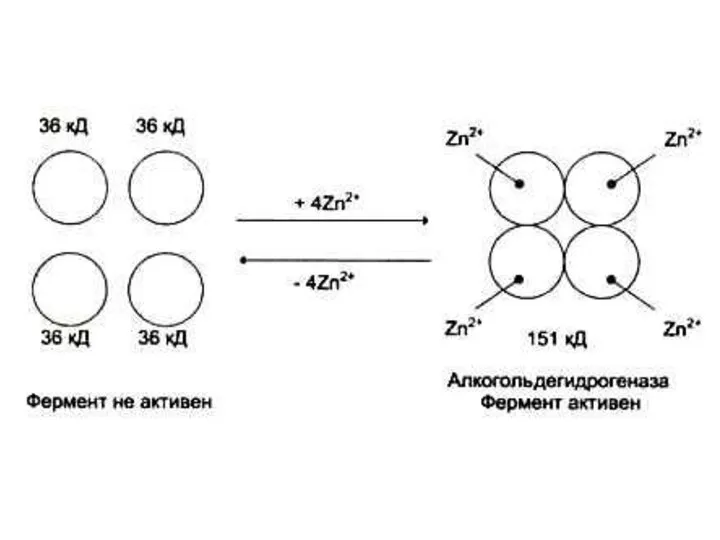
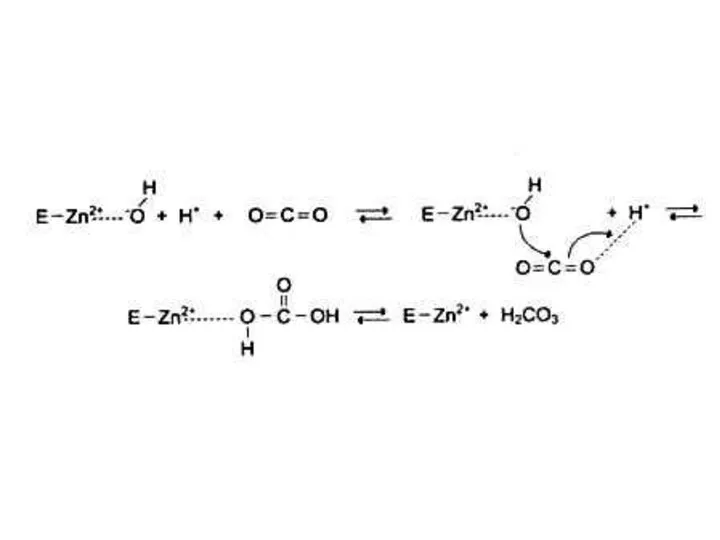
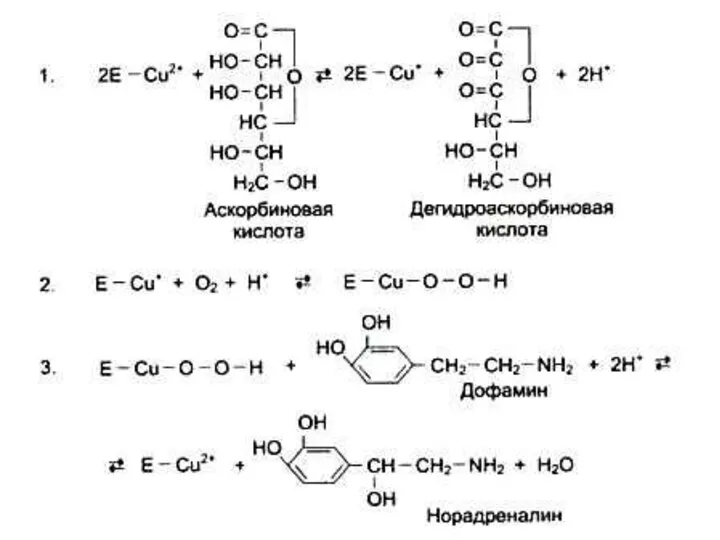
- 65. Кофакторы) (неорганической природы) Ионы металлов: Стабилизируют субстрат (Е – S – Me), Mg2+- АТФ. Стабилизируют активный
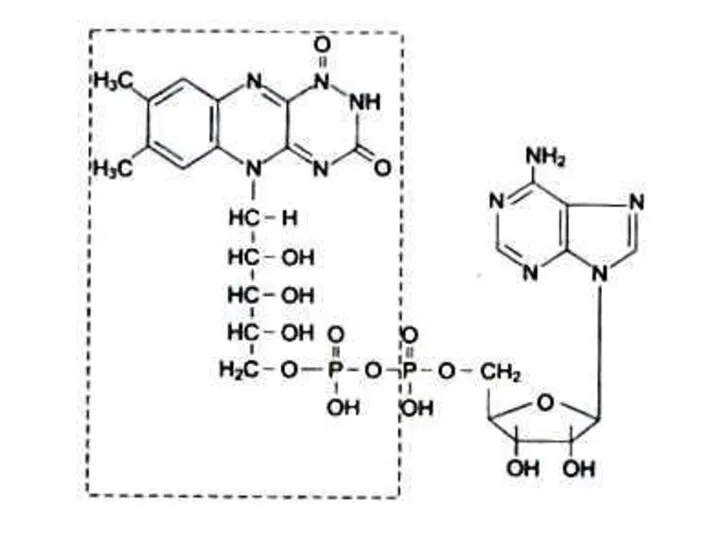
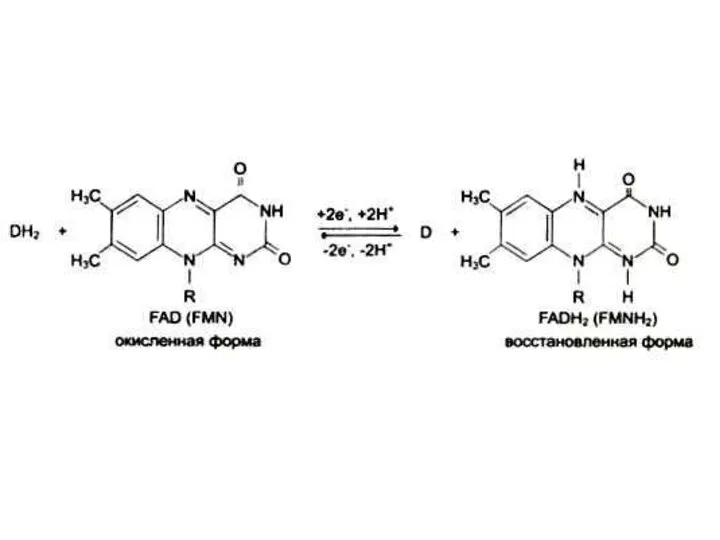
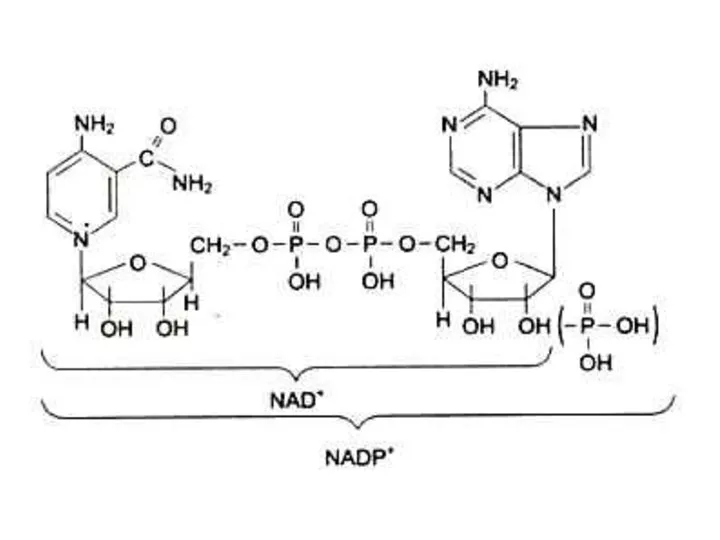
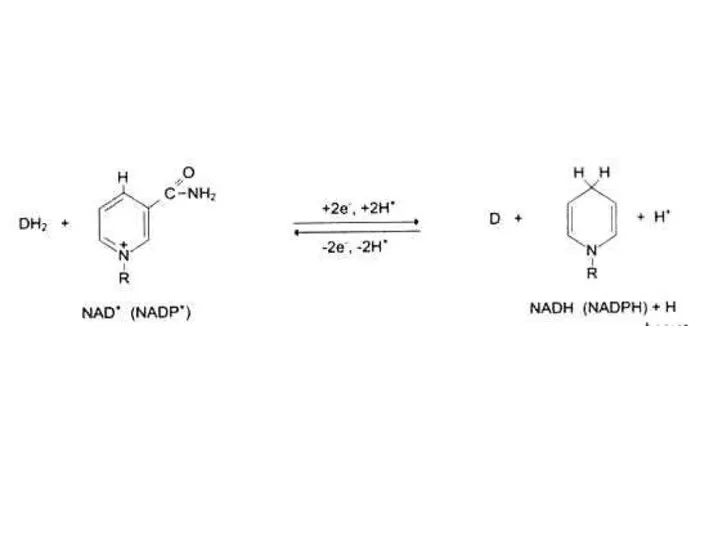
- 72. Коферменты Производные витаминов (фосфорилированные: пиридоксальфосфат, тиаминпирофосфат или аденилированные: НАД, ФМН, ФАД) Гем (ы) Нуклеотиды (АТР, ГТР)
- 73. ВИТАМИНЫ Низкомолекулярные органические вещества различного строения, которые животные должны получать извне полностью или частично (микронутриенты). Не
- 74. Из истории витаминологии Научные основы витаминологии – начало 19 века: Н.И. Лунин, Ф. Мажанди, К. Танаки
- 75. История витаминологии А.Виндаус, 1928 г. – открытие витамина Д и холестерола. У.Хеворс и П. Каррер,1937 г.
- 76. Номенклатура витаминов Буквенные символы (А, В,С…) Химические названия (тиамин,рибофлавин, никотинамид….) Биологическая классификация (антирахитический, антигеморрагический, антиневритный…) Жиро
- 77. Биохимические функции витаминов 1. Обеспечивают активность ферментов (кофакторная ф –ция): В1,В2.,В6 ,РР, Н, К, фолиевая кислота,
- 83. Метаболизм витаминов Обмен очень интенсивный. Не накапливаются! (Исключение – жирорастворимые витамины, частично депонируются в печени и
- 84. Источники витаминов: Пищевые: желток яиц, печень, икра, проростки злаков, дрожжи. Микрофлора кишечника. КАК СОХРАНИТЬ ВИТАМИНЫ В
- 85. Причины гиповитаминозов: Первичный (экзогенный) гипо- или авитаминоз: алиментарная недостаточность. Голодание, «однобокая» диета, потребление «рафинированных» продуктов. Вторичные
- 86. Причины гиповитаминозов: Нарушение всасывания в ЖКТ жирорастворимых витаминов (снижение желчеобразования); В12 (недостаток фактора Касла). Нарушение микрофлоры
- 87. Взаимодействие витаминов Витамин влияет на метаболизм другого витамина (Токоферол препятствует переокислению витамина А; полиеновые кислоты (витамин
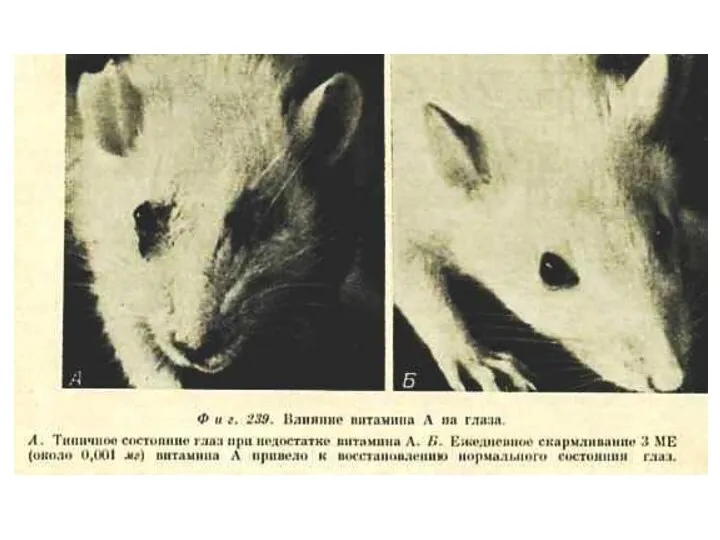
- 88. ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ. А (ретинол, ретиналь), антиксерофтальмический. Источник: продукты животного происхождения (печень рыб);растительные продукты содержат каротин –предшественник
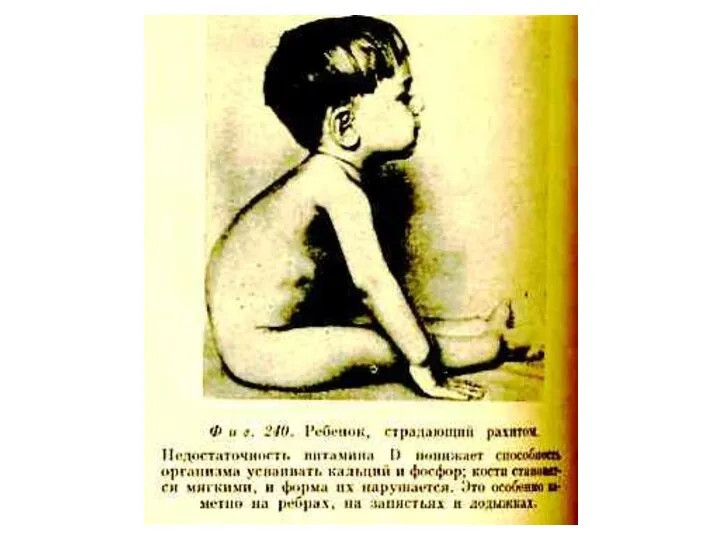
- 89. ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ. Д (кальциферол), антирахитический. Источники: эндогенный синтез (УФ), продукты животного происхождения, дрожжи содержат эргостерин. Увеличивает
- 90. ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ. Е (токоферол), антистерильный Источники: растительные масла. Обеспечивает стабильность клеточных мембран, являясь антиоксидантом и снижая
- 91. ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ. К (филлохиноны), антигеморрагический Источники: зелень, печень, дрожжи, синтез микрофлорой. Является кофактором карбоксилазы глутамата ,
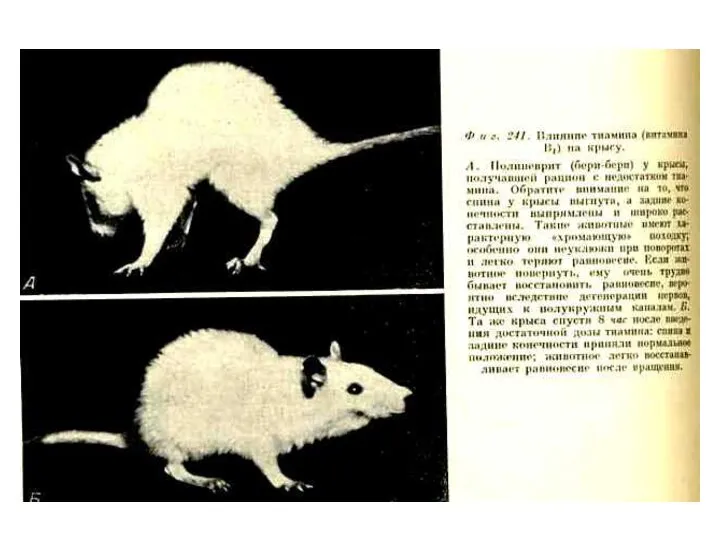
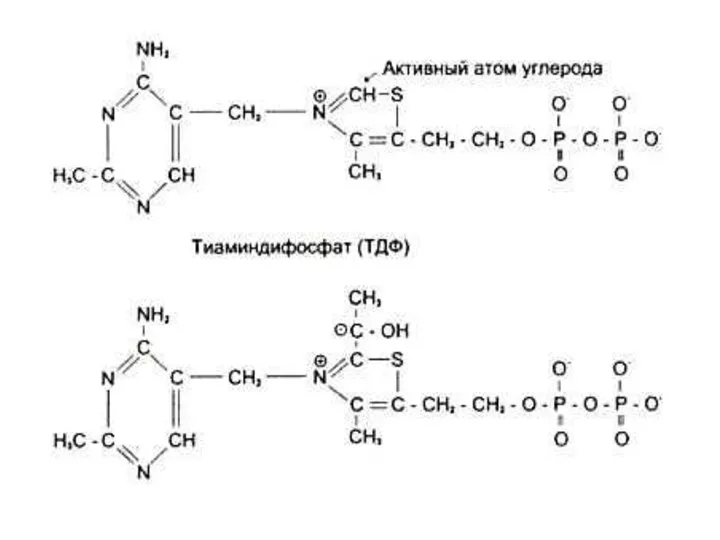
- 92. Водорастворимые витамины. В1 (тиамин), антиневритный Кофакторная форма – ТДФ (тиаминдифосфат) Работает в составе дегидрогеназных комплексов, обеспечивая
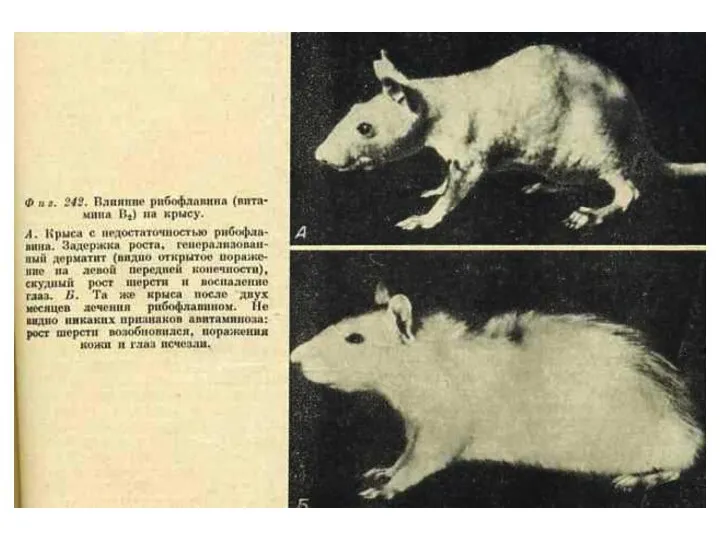
- 94. Водорастворимые витамины. В2 (рибофлавин), витамин роста Образует кофакторы ФМН, ФАД. Работает в составе анаэробных дегидрогеназ различных
- 97. Водорастворимые витамины. В3 (пантотеновая кислота), универсальный витамин. Входит в состав КоА, активатора и переносчика ацетильных и
- 98. Водорастворимые витамины. В5, РР (никотинамид), антипеллагрический. Образует кофакторы НАД, НАДФ. Входит в состав анаэробных дегидрогеназ, обратимо
- 101. Водорастворимые витамины. В6(пиридоксаль), антидерматитный Образует кофактор пиридоксальфосфат. Входит в состав трансфераз и декарбоксилаз аминокислот, моно- и
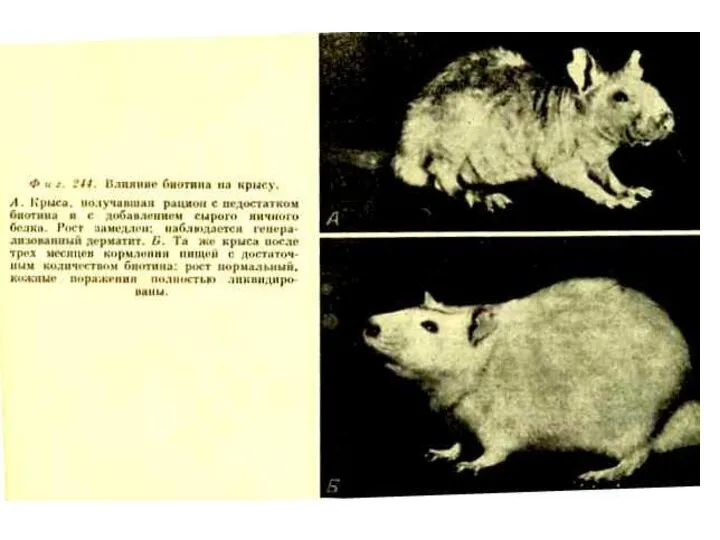
- 102. Водорастворимые витамины. Н (биотин), антисеборейный.
- 104. Скачать презентацию















![КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА [E] [S] [ES] = [S] + (k3 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302977/slide-23.jpg)














![Регуляция активности ферментов Зависимость скорости реакции от [S] различна для «Михаэлисовских»](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302977/slide-39.jpg)
![Регуляция активности ферментов Зависимость скорости реакции от [P]: На начальных этапах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302977/slide-40.jpg)





































 Факторы, влияющие на потребность организации в персонале
Факторы, влияющие на потребность организации в персонале Оптимизация полномочий субъектов Российской Федерации и муниципальных образований
Оптимизация полномочий субъектов Российской Федерации и муниципальных образований Программирование на алгоритмическом языке. Часть III (9 класс)
Программирование на алгоритмическом языке. Часть III (9 класс) Организация технического обслуживания и ремонта автомобиля Тойота Ленд Крузер 200
Организация технического обслуживания и ремонта автомобиля Тойота Ленд Крузер 200 Экономика Франции
Экономика Франции Поэзия второй половины XIX века
Поэзия второй половины XIX века  Механизмы ввода и вывода информации. Понятие сериализации
Механизмы ввода и вывода информации. Понятие сериализации Спид и спид- индикаторные болезни человека
Спид и спид- индикаторные болезни человека Кафедра «Финансы и налоги» Преподаватель: Просалова Вероника Сергеевна, к.э.н., доцент «БЮДЖЕТНОЕ ПЛАНИРОВАНИЕ И ПРОГНОЗИРОВА
Кафедра «Финансы и налоги» Преподаватель: Просалова Вероника Сергеевна, к.э.н., доцент «БЮДЖЕТНОЕ ПЛАНИРОВАНИЕ И ПРОГНОЗИРОВА Аттестационная работа. Индивидуальная карта развития в области культуры здоровья
Аттестационная работа. Индивидуальная карта развития в области культуры здоровья Презентация Источники финансирования инвестиций
Презентация Источники финансирования инвестиций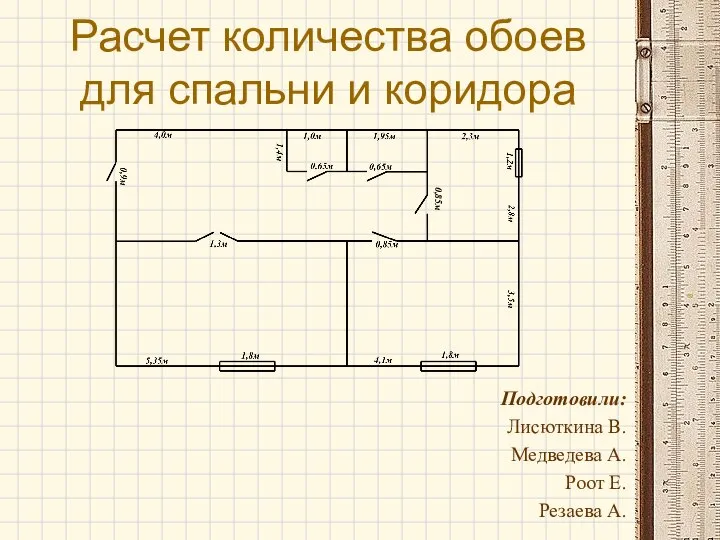 Расчет количества обоев для спальни и коридора
Расчет количества обоев для спальни и коридора 100 шагов Президента
100 шагов Президента Проект «За страницами учебника» Творческое название проекта – ПТИЦЫ В КАРТИНАХ РУССКИХ ХУДОЖНИКОВ. Выполнил ученик 11 б класса
Проект «За страницами учебника» Творческое название проекта – ПТИЦЫ В КАРТИНАХ РУССКИХ ХУДОЖНИКОВ. Выполнил ученик 11 б класса  ВВЕДЕНИЕ В ВЫЧИСЛИТЕЛЬНУЮ МАТЕМАТИКУ Лекция 3 22 сентября 2009 ВЫЧИСЛИТЕЛЬНАЯ ЛИНЕЙНАЯ АЛГЕБРА
ВВЕДЕНИЕ В ВЫЧИСЛИТЕЛЬНУЮ МАТЕМАТИКУ Лекция 3 22 сентября 2009 ВЫЧИСЛИТЕЛЬНАЯ ЛИНЕЙНАЯ АЛГЕБРА  Компенсация реактивной мощности. (БСК). Лекция 04
Компенсация реактивной мощности. (БСК). Лекция 04 Международные конфликты: причины и сущность
Международные конфликты: причины и сущность Бизнес-план компьютерной мастерской
Бизнес-план компьютерной мастерской Кодирование
Кодирование Биохимия ферментов-2
Биохимия ферментов-2 Поступление в БПОУ ВО «Грязовецкий политехнический техникум»
Поступление в БПОУ ВО «Грязовецкий политехнический техникум»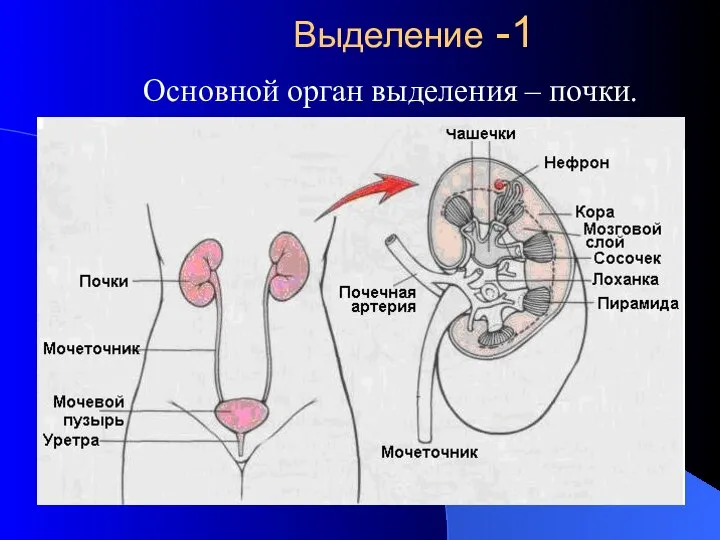 Выделение
Выделение  Городецкая роспись как средство арт терапии и цветотерапии Выполнили ученицы 6Б класса МОУ Школы №55 Бочкарёва Анна Мельникова
Городецкая роспись как средство арт терапии и цветотерапии Выполнили ученицы 6Б класса МОУ Школы №55 Бочкарёва Анна Мельникова  Развитие территориального общественного самоуправления в Юсьвинском сельском поселении
Развитие территориального общественного самоуправления в Юсьвинском сельском поселении Общие сведения о зубчатых передачах
Общие сведения о зубчатых передачах Информация о NOVADAN (www.NOVADAN.DK) NOVADAN (Дания) является одним из европейских лидеров среди производителей моющих средств, дезинфектантов
Информация о NOVADAN (www.NOVADAN.DK) NOVADAN (Дания) является одним из европейских лидеров среди производителей моющих средств, дезинфектантов  Продвижение интернет-магазина: бюджетный маркетинг
Продвижение интернет-магазина: бюджетный маркетинг Сахарный диабет
Сахарный диабет