Содержание
- 2. Люминесценция – способность многих органичес-ких и неорганических веществ к самостоятельному свечению, которое возникает в результате различ-ных
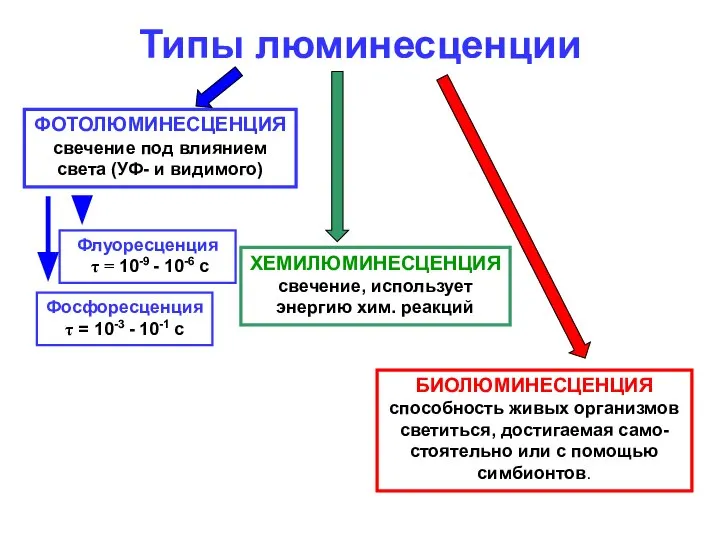
- 3. Типы люминесценции ФОТОЛЮМИНЕСЦЕНЦИЯ свечение под влиянием света (УФ- и видимого) Флуоресценция τ = 10-9 - 10-6
- 4. Флуоресценция (частный случай люминесценции), широко распространена в природе и может происхо- дить в газах, растворах и
- 5. Флуорофор – молекула или фрагмент молекулы, придающий ей флуоресцентные свойства. Как правило, флуорофором является карбо- или
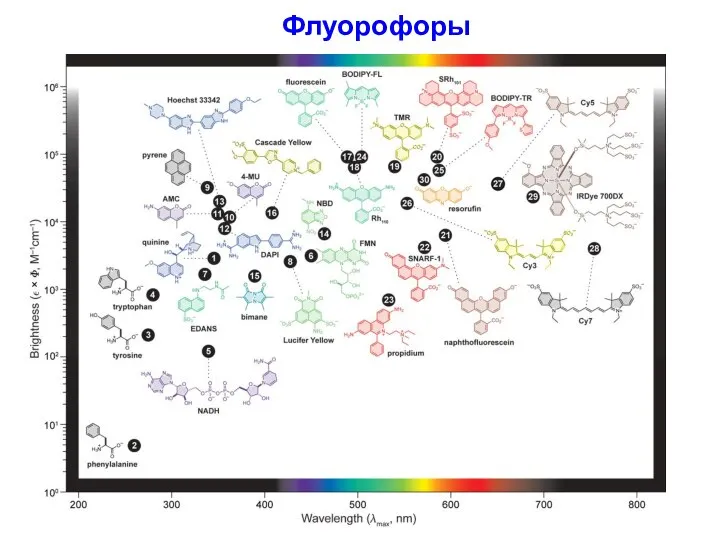
- 6. Флуорофоры
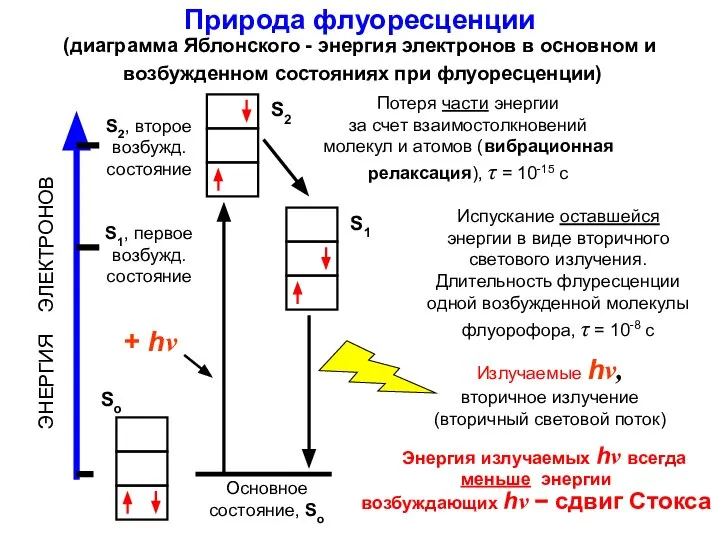
- 7. Природа флуоресценции (диаграмма Яблонского - энергия электронов в основном и возбужденном состояниях при флуоресценции) ЭНЕРГИЯ ЭЛЕКТРОНОВ
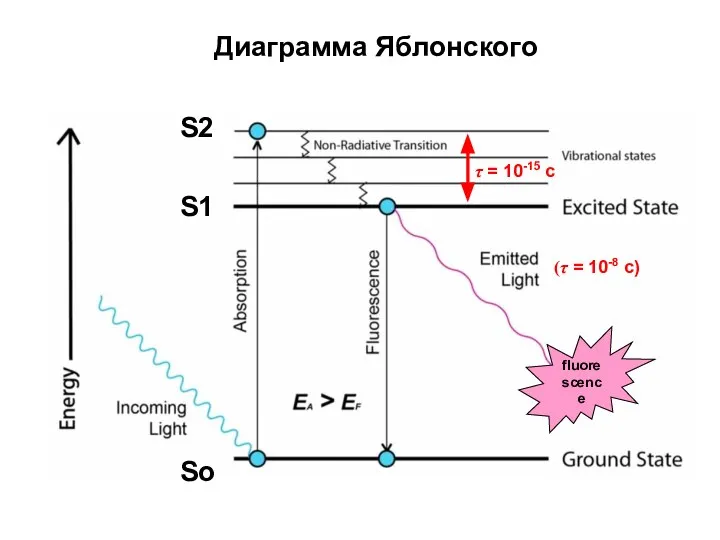
- 8. Диаграмма Яблонского So S2 S1 fluorescence τ = 10-15 с (τ = 10-8 с)
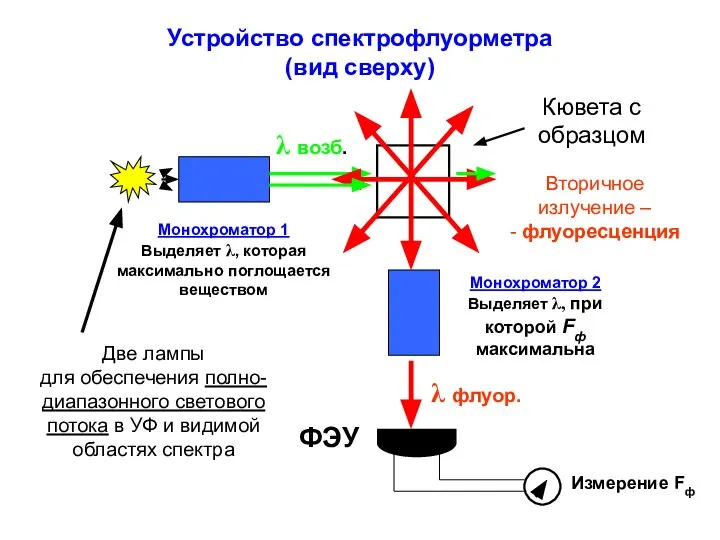
- 9. Устройство спектрофлуорметра (вид сверху) Монохроматор 1 Выделяет λ, которая максимально поглощается веществом Монохроматор 2 Выделяет λ,
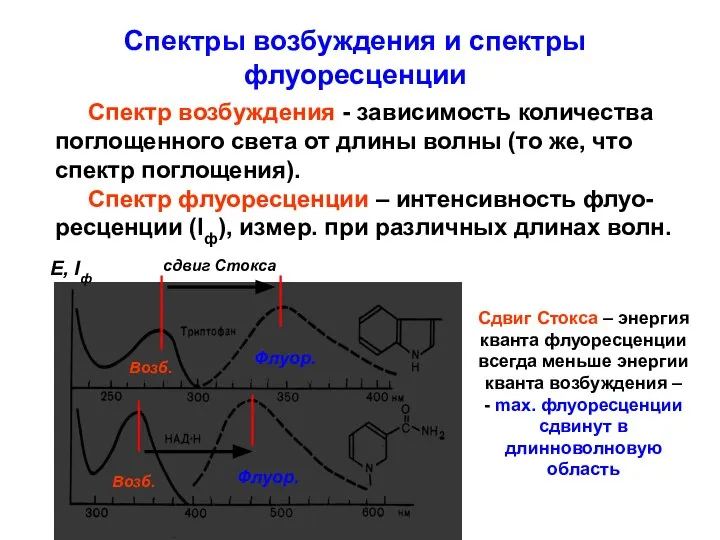
- 10. Спектры возбуждения и спектры флуоресценции Спектр возбуждения - зависимость количества поглощенного света от длины волны (то
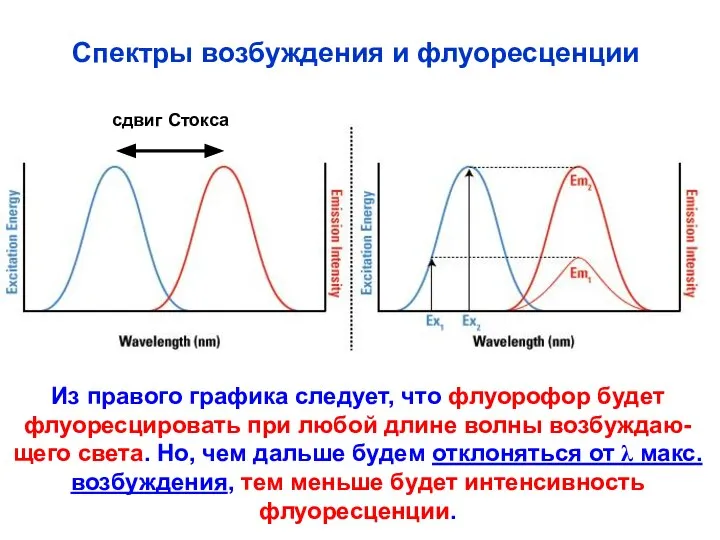
- 11. Спектры возбуждения и флуоресценции сдвиг Стокса Из правого графика следует, что флуорофор будет флуоресцировать при любой
- 12. Спектры возбуждения (поглощения), как и спектры флуоресценции могут существенно меняться при изменении концентрации раствора, его кислотности
- 13. Основные закономерности флуоресценции Флуоресценция происходит при любой длине волны возбуждающего света. 2. Q (квантовый выход флуоресценции):
- 14. Зависимость интенсивности флуоресценции (Fф) от концентрации вещества Fф = Io x Q x C Io –
- 15. Интенсивность флюоресценции (Fф) флуорофора линейно зависит от его концентрации (С) только в области малых концентраций (10-11
- 16. Классификация флуорофоров: 1. Биологические флуорофоры. Пиридиновые нукле- отиды (кофакторы), ароматические аминокислоты в составе белков (90% флуоресценции
- 17. Антрацен Флуоресцеин Родамин 6G Структурные формулы некоторых флуорофоров Большинство малых органических флуорофоров, нашедших практическое применение в
- 18. 3. Особой группой флуоресцентных соединений явля- ются квантовые точки (полупроводниковые нано- кристаллы). При уменьшении физических размеров
- 19. Квантовые точки одного и того же химического стро- ения, в зависимости от своих размеров, дают флуорес-
- 20. Материалы, из которых изготавливаются квантовые точки (Cd, Pb и др.) токсичны для клеток. Для умень-шения токсичности
- 21. Флуоресцентные вещества, применяемые в биоло-гии, можно условно разделить на две большие группы: 1. Флуоресцентные метки -
- 22. 2. Флуоресцентные зонды. Это молекулярная конструкция, которая может существовать в двух со-стояниях: «выключенном» и «включённом». Эти
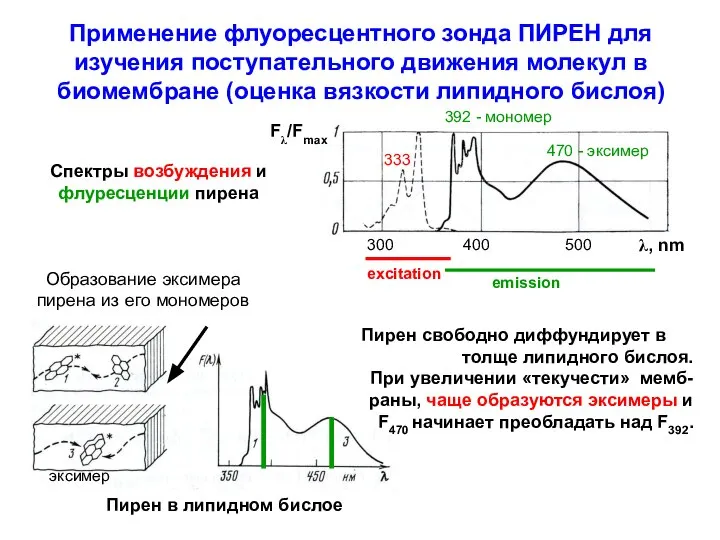
- 23. Применение флуоресцентного зонда ПИРЕН для изучения поступательного движения молекул в биомембране (оценка вязкости липидного бислоя) 300
- 24. Тушение (гашение) флуоресценции. Тушение флуоресценции происходит вследствие того, что излучаемая флуорофором энергия передается молекулам других веществ,
- 25. Основные факторы, вызывающие тушение флуоресценции Увеличение температуры - температурное тушение. С повышением температуры частота столкновений возбужденных
- 26. 3. Присутствие в растворе посторонних примесей, которые могут изменить рН раствора, что также приводит к тушению
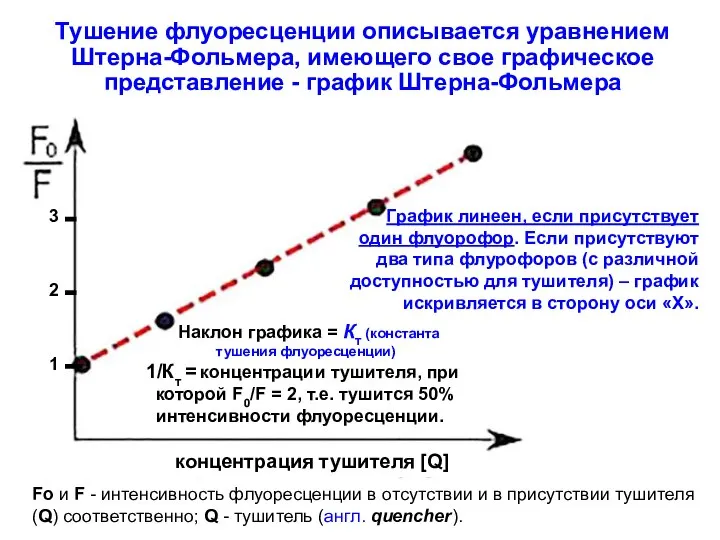
- 27. Тушение флуоресценции описывается уравнением Штерна-Фольмера, имеющего свое графическое представление - график Штерна-Фольмера Fo и F -
- 28. Для того, чтобы в полной мере реализовать высо- кую чувствительность, свойственную флуориметрии, необходимо: возбуждать флуоресценцию при
- 30. Скачать презентацию


















 Действия населения в зоне химического поражения
Действия населения в зоне химического поражения Снаряжение для туристских походов
Снаряжение для туристских походов Теориялық механика
Теориялық механика Что в имени твоём заключено? - презентация для начальной школы_
Что в имени твоём заключено? - презентация для начальной школы_ Опорно поворотные устройства специального назначения
Опорно поворотные устройства специального назначения Христос
Христос TrischiniZmitsnennya.ppt
TrischiniZmitsnennya.ppt Электромобиль с силовой гибридной установкой
Электромобиль с силовой гибридной установкой Традиционная одежда народов Севера
Традиционная одежда народов Севера Тема: « Развитие речи младших школьников на уроках русского языка и литературного чтения. Пути усиления языковой и
Тема: « Развитие речи младших школьников на уроках русского языка и литературного чтения. Пути усиления языковой и  Гидрогеохимические классификации
Гидрогеохимические классификации Интегрированная система SCAD Office — инструментарий инженера-проектировщика
Интегрированная система SCAD Office — инструментарий инженера-проектировщика САМОИНДУКЦИЯ И ВЗАИМНАЯ ИНДУКЦИЯ
САМОИНДУКЦИЯ И ВЗАИМНАЯ ИНДУКЦИЯ Аттестационная работа. Создание исследовательского проекта «Народный костюм и его интерпретация в современной моде» (5 класс)
Аттестационная работа. Создание исследовательского проекта «Народный костюм и его интерпретация в современной моде» (5 класс) Презентация "Абстракционизм Кандинского" - скачать презентации по МХК
Презентация "Абстракционизм Кандинского" - скачать презентации по МХК Основы обучения движениям в физическом воспитании
Основы обучения движениям в физическом воспитании Технология приготовления блюд обеда для туристов из Белоруссии
Технология приготовления блюд обеда для туристов из Белоруссии Языки программирования. Язык Паскаль
Языки программирования. Язык Паскаль Диод Шоттки
Диод Шоттки Урок «Расскажи о друге» 2 класс Учитель английского языка МБОУ «Большеигнатовская СОШ» Большеигнатовского муниципального район
Урок «Расскажи о друге» 2 класс Учитель английского языка МБОУ «Большеигнатовская СОШ» Большеигнатовского муниципального район Новая
Новая Наборы тяжелый2
Наборы тяжелый2 Случайная величина. Закон распределения случайной величины
Случайная величина. Закон распределения случайной величины  Wyrusz z Chrystusem na drogę krzyżową
Wyrusz z Chrystusem na drogę krzyżową Зачет по «Спортивным сооружениям»
Зачет по «Спортивным сооружениям» Оперативное хранение документов в текущей деятельности предприятия
Оперативное хранение документов в текущей деятельности предприятия Презентация на тему "Компетентностные формы промежуточной аттестации в 5-8 классах как один из механизмов достижения качества с
Презентация на тему "Компетентностные формы промежуточной аттестации в 5-8 классах как один из механизмов достижения качества с Основы цифровой электроники
Основы цифровой электроники