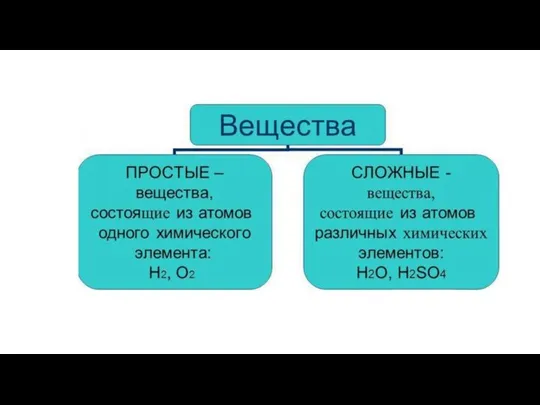
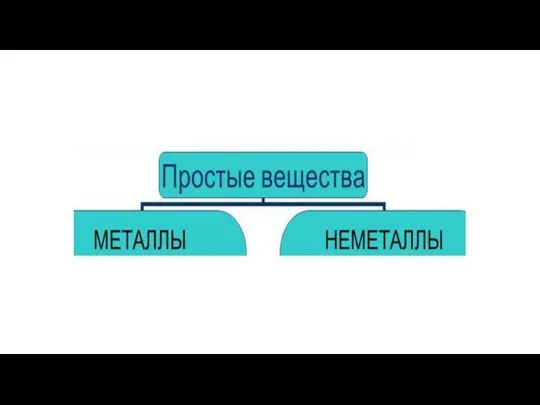
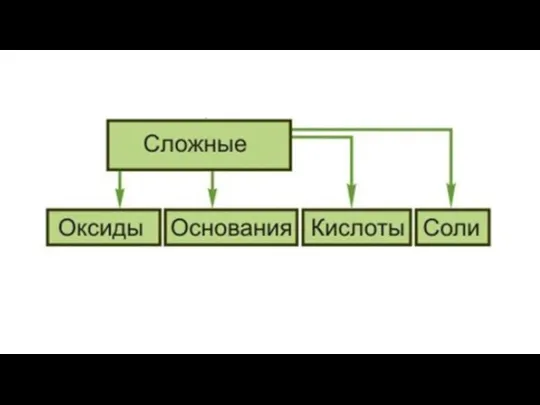
Атомно-молекулярная теория
Автор этой теории английский химик Джон Дальтон. Его атомистическая теория,
опубликованная в 1803-1807 годах, прочно основывалась на экспериментальных данных.
Ее основные постулаты заключались в следующем:
Каждый химический элемент состоит из чрезвычайно мелких частиц, называемых атомами;
Все атомы одного элемента одинаковы;
Атомы различных элементов обладают разными свойствами (в том числе имеют разные массы);
Атомы одного элемента в результате химических реакций не превращаются в атомы других элементов; атомы не создаются и не разрушаются в химических реакциях;
Химические соединения образуются в результате комбинаций атомов двух или нескольких элементов;
В данном соединении относительные количества атомов различных сортов, а также сорта этих атомов всегда постоянны.




























 Проектирование строительного генерального плана. Графическая часть. (Занятие 3)
Проектирование строительного генерального плана. Графическая часть. (Занятие 3) Профилактическая беседа: «Заведомо ложное сообщение об акте терроризма.»
Профилактическая беседа: «Заведомо ложное сообщение об акте терроризма.» Политические организации и политические движения
Политические организации и политические движения Социальная инженерия как способ совершения компьютерного преступления
Социальная инженерия как способ совершения компьютерного преступления Презентация "А что такое гражданин? Отечества достойный сын" - скачать презентации по МХК
Презентация "А что такое гражданин? Отечества достойный сын" - скачать презентации по МХК Ландшафтное проектирование. Основы композиции озелененных территорий
Ландшафтное проектирование. Основы композиции озелененных территорий Организация лечебно-эвакуационных меропирятий населения при ЧС
Организация лечебно-эвакуационных меропирятий населения при ЧС ФВ в школах-интернатах, спортивных клубах
ФВ в школах-интернатах, спортивных клубах Alexander McQueen. Атрибутивные и денотативные ценности бренда
Alexander McQueen. Атрибутивные и денотативные ценности бренда Дифференциальная диагностика и принципы лечения синдрома Корнелии Де ЛАНГЕ Выполнила:клин.ординатор 2-го года обучения
Дифференциальная диагностика и принципы лечения синдрома Корнелии Де ЛАНГЕ Выполнила:клин.ординатор 2-го года обучения  Етнокультурна мозаїка України
Етнокультурна мозаїка України Презентация Преамбула договора
Презентация Преамбула договора  Біоетичні проблеми смерті: аутопсія, смерть головного мозку, евтаназія. Трансплантація органів та тканин
Біоетичні проблеми смерті: аутопсія, смерть головного мозку, евтаназія. Трансплантація органів та тканин Автоматизация тестирования
Автоматизация тестирования Проект ТВОРЧЕСКОЕ ЛЕТО
Проект ТВОРЧЕСКОЕ ЛЕТО Магматизм
Магматизм  Самоконтроль занимающихся физическими упражнениями. (Лекция 6)
Самоконтроль занимающихся физическими упражнениями. (Лекция 6) (Дружба Чехова и Левитана)
(Дружба Чехова и Левитана) Мини-футбол
Мини-футбол Организация развивающей предметно-пространственной среды в ДОУ
Организация развивающей предметно-пространственной среды в ДОУ Презентация Покупательское поведение на рынках
Презентация Покупательское поведение на рынках Изучение статистических связей между явлениями
Изучение статистических связей между явлениями Углеводы
Углеводы  Проектирование и создание профориентационного веб-узла
Проектирование и создание профориентационного веб-узла Тайны чисел - презентация для начальной школы_
Тайны чисел - презентация для начальной школы_ Презентация возможностей. - презентация
Презентация возможностей. - презентация Молетроника. Спинтроника
Молетроника. Спинтроника Конституція про Святу Літургію
Конституція про Святу Літургію