Содержание
- 2. Задачи: Образовательные: изучить механизм образования ковалентной химической связи; научиться составлять электронные формулы молекул веществ; Развивающие: закрепить
- 3. Ход урока 1.Организационный момент. Взаимное приветсвие,проверка посещаемости, начать урок 2.Сообщение темы урока, цели и задачи 3.Актуализация
- 4. 1.Изучение нового материала. Химическая связь может образовываться различными путями, познакомимся с одним из них. Тема сегодняшнего
- 5. 1.Начертите схемы образования молекул N2 и NH3. Укажите тип ковалентной связи. 2. Используя табличные данные, сделайте
- 6. 2.Демонстрационный опыт: Атом водорода имеет один электрон на внешнем электронном уровне, поэтому должен проявлять высокую химическую
- 7. 3.Проблемная задача Наблюдения и опыты позволили вам убедиться в реальности существования простых веществ - водорода, кислорода,
- 8. 4.Закрепление изученного материала. 1. Тест « Химическая связь» А). Присоединение двух электронов характерно для атома: А)
- 10. Скачать презентацию
Задачи:
Образовательные:
изучить механизм образования ковалентной химической связи;
научиться составлять электронные формулы молекул веществ;
Развивающие:
закрепить
Задачи:
Образовательные:
изучить механизм образования ковалентной химической связи;
научиться составлять электронные формулы молекул веществ;
Развивающие:
закрепить
формировать умения написания электронных формул веществ;
Воспитательные:
воспитывать умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.
Оборудование и реактивы:
периодическая система химический элементов Д.И.Менделеева;
учебник;
аппликация;
прибор для получения и собирания газов;
лабораторный штатив, пробирки
Ход урока
1.Организационный момент. Взаимное приветсвие,проверка посещаемости, начать урок
2.Сообщение темы урока, цели
Ход урока
1.Организационный момент. Взаимное приветсвие,проверка посещаемости, начать урок
2.Сообщение темы урока, цели
3.Актуализация опорных знаний
1.Изучение нового материала.
Химическая связь может образовываться различными путями, познакомимся с одним
1.Изучение нового материала.
Химическая связь может образовываться различными путями, познакомимся с одним
Тема сегодняшнего урока «Ковалентная связь».
Каждый атом стремится завершить свой внешний электронный уровень, чтобы уменьшить потенциальную энергию. Поэтому ядро одного атома притягивается к себе электронную плотность другого атома и наоборот, происходит наложение электронных облаков двух соседних атомов.
Демонстрация аппликации и схемы образования ковалентной неполярной химической связи в молекуле водорода. (Учащиеся записывают и зарисовывают схемы).
Вывод:
Связь между атомами в молекуле водорода осуществляется за счет общей электронной пары. Такая связь называется ковалентной.
Составление электронных формул молекул простых веществ неметаллов:
•• ••
•• CI •• CI •• - электронная формула молекулы хлора,
•• ••
CI -- CI - структурная формула молекула хлора.
••
•• N •• N •• - электронная формула молекулы азота,
••
N ≡ N - структурная формула молекулы азота.
1.Начертите схемы образования молекул N2 и NH3. Укажите тип ковалентной связи.
2.
1.Начертите схемы образования молекул N2 и NH3. Укажите тип ковалентной связи.
2.
Расположите вещества в ряд по увеличению полярности связей в них.
3. Какая связь более длинная:
а) HI или HBr, б) О2 или N2?
2.Демонстрационный опыт:
Атом водорода имеет один электрон на внешнем электронном уровне, поэтому
2.Демонстрационный опыт: Атом водорода имеет один электрон на внешнем электронном уровне, поэтому
3.Проблемная задача
Наблюдения и опыты позволили вам убедиться в реальности существования простых
3.Проблемная задача
Наблюдения и опыты позволили вам убедиться в реальности существования простых
Возникает вопрос, как атомы водорода, кислорода и азота связываются в двухатомные молекулы.
Рассмотрим процесс образования молекул водорода.
Два атома водорода при их сближении и взаимодействии друг с другом могут образовывать двухатомную молекулу. Каждый атом водорода имеет по одному неспаренному электрону.
При взаимодействии атомов водорода электроны «объединяются» и становятся общими для обоих атомов, у которых формируется завершенный внешний электронный слой, подобный завершенному уровню атома гелия.
Итак, химическая связь между атомами водорода осуществляется обобществленной парой электронов. Из-за одинаковой электроотрицательности атомов водорода отдача электронов одним атомом и присоединение их другим произойти не могут. Электроны оказываются на одинаковом расстоянии от ядер обоих атомов. При этом образуются общая электронная пара, связывающая атомы.
Образование молекул водорода из атомов водорода можно представить так:
Н∙ + Н∙ → Н : Н
В молекуле водорода атомы связаны одной общей электронной парой. Такую связь называют одинарной.
Если электронные пары, осуществляющие химическую связь, обозначить черточками, получается структурная формула вещества
Н - Н
Химическую связь, возникающую в результате образования общих (связывающих) электронных пар, называют ковалентной связью.
Химическая связь между атомами в молекулах может быть образована с помощью большего числа электронных пар. Это зависит от строения взаимодействующих атомов.
4.Закрепление изученного материала.
1. Тест « Химическая связь»
А). Присоединение двух электронов характерно
4.Закрепление изученного материала.
1. Тест « Химическая связь»
А). Присоединение двух электронов характерно
А) F Б) CI В) S Г) N
Б). Отдача одного электрона характерна для атома:
А) АI Б) К В) Мg Г) Ве
В). Один неспаренный электрон в атоме:
А) С Б) Р В) S Г) F
Г). Число неспаренных электронов в атоме кислорода равно:
А) 6 Б) 2 В) 3 Г) 1
2. Какая химическая связь называется ковалентной связью?
3. Сколько общих электронных пар содержит
а) молекула фтора: 2; 1; 3
б) молекула кислорода: 3; 1; 2
в) молекула азота: 1; 3; 2
5.Итоги урока.
Тест. Как я усвоил материал.
А) Получил прочные знания, усвоил весь материал.
Б) Усвоил материал частично.
В) Мало что понял, необходимо еще поработать.
6.Домашнее задание
1. § 41 учебника.
2. Ответить на вопросы после текста параграфа.







 Довольный клиентНедовольный клиентСледствие88% туристов говорят, что делают свой выбор в пользу конкретной гостиницы основываясь
Довольный клиентНедовольный клиентСледствие88% туристов говорят, что делают свой выбор в пользу конкретной гостиницы основываясь  Wybór
Wybór Пастырские послания
Пастырские послания Компрессоры ГТД
Компрессоры ГТД Презентация на тему "" Один день из жизни нашей группы"" - скачать презентации по Педагогике
Презентация на тему "" Один день из жизни нашей группы"" - скачать презентации по Педагогике МАРГАРИН
МАРГАРИН Принцип комплаентности – залог успешного лечения хронических воспалительных заболеваний половых органов у женщин фертильного в
Принцип комплаентности – залог успешного лечения хронических воспалительных заболеваний половых органов у женщин фертильного в создание сайта
создание сайта  Физиологические основы спортивной работоспособности в особых условиях внешней среды
Физиологические основы спортивной работоспособности в особых условиях внешней среды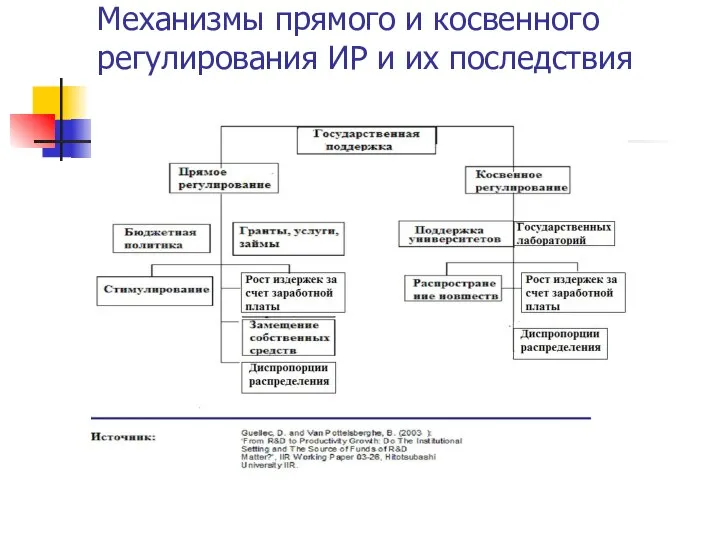 Механизмы прямого и косвенного регулирования ИР и их последствия
Механизмы прямого и косвенного регулирования ИР и их последствия Понятие и источники гражданского права
Понятие и источники гражданского права Приєднання електроустановок до електричних мереж
Приєднання електроустановок до електричних мереж Этапы проведения измерений. Классификация видов измерения
Этапы проведения измерений. Классификация видов измерения Природа как один из источников вдохновения эпохи модерна
Природа как один из источников вдохновения эпохи модерна Основные метрологические характеристики средств измерений. Средства измерений военного назначения и их поверка
Основные метрологические характеристики средств измерений. Средства измерений военного назначения и их поверка БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ Курс «Логистика закупок». Модуль 1. Общие положения
Курс «Логистика закупок». Модуль 1. Общие положения Роль цифровой логистики в развитии экспорта
Роль цифровой логистики в развитии экспорта Физиология сердца. Свойства сердечной мышцы
Физиология сердца. Свойства сердечной мышцы Лечебная физкультура в школе
Лечебная физкультура в школе Стратегия модернизации в Российской Федерации
Стратегия модернизации в Российской Федерации Теория вероятности и математическая статистика
Теория вероятности и математическая статистика  Томская федерация спортивного туризма. Техника движения (снег, лед)
Томская федерация спортивного туризма. Техника движения (снег, лед) Дом-музей Элиаса Лённрота
Дом-музей Элиаса Лённрота Deutsche Schulen. Wie sind sie? 8 класс
Deutsche Schulen. Wie sind sie? 8 класс МинаеваВН
МинаеваВН Система питания двигателя внутреннего сгорания с искровым зажиганием
Система питания двигателя внутреннего сгорания с искровым зажиганием Ведущие педагогические идеи и концепции в истории человечества на разных этапах его развития.
Ведущие педагогические идеи и концепции в истории человечества на разных этапах его развития.