Содержание
- 2. E0 MnO4-/Mn2+ =+1,52 В M(1/Z KMnO4)= M/5=158/5=31,6(г) Определения проводят в 3%-ой H2 SO4 Определение восстановителей :
- 3. 2 Fe2+-2е →2 Fe3+ MnO4-+8H++5e →Mn2+ +4HOH M(1/Z Fe SO4)= M/Z= 152/1= 152 г. m(Fe2+)= T
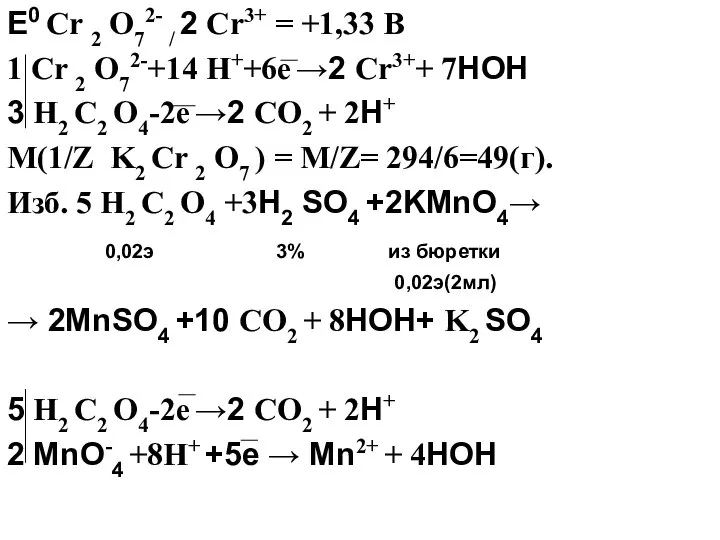
- 4. Е0 Cr 2 O72- / 2 Cr3+ = +1,33 B 1 Cr 2 O72-+14 H++6e →2
- 5. Расчёты: Изб. H2 C2 O4 /KMnO4 =0,02∙V KMnO4/0,02= =2(мл) 2.V H2 C2 O4 / K2 Cr
- 6. J2- чисто ков. соединение. J2+KJ↔ KJ3. Условно J2; E0 J2 / 2 J- = +0,54В. 2
- 7. Е0 H2 S / S0 +2Н+= -0,14В. 1 H2 S-2е → S ↓+2Н+ 1 J20+2e →
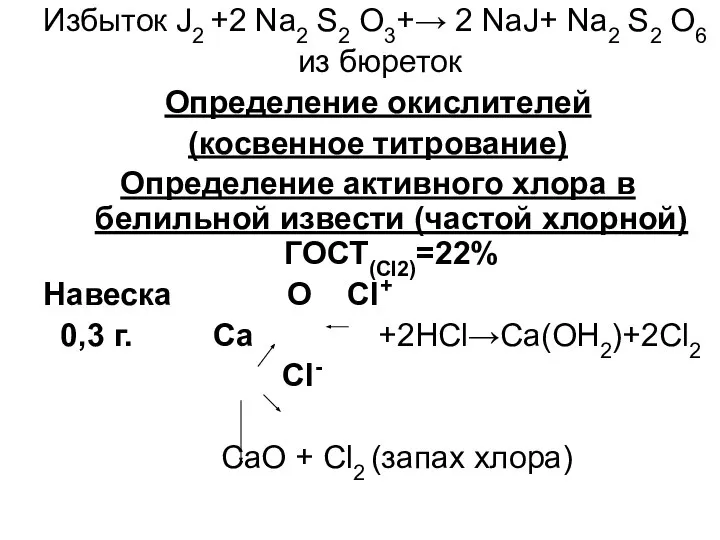
- 8. Избыток J2 +2 Na2 S2 O3+→ 2 NaJ+ Na2 S2 O6 из бюреток Определение окислителей (косвенное
- 9. ок-ль Cl2 +2 KJ →J20 + KCl пробиркой в избытке 1 Cl20 +2 е → 2
- 11. Скачать презентацию






 Классическая модель разработки программного обеспечения. Модификации модели, жизненный цикл, достоинства и недостатки
Классическая модель разработки программного обеспечения. Модификации модели, жизненный цикл, достоинства и недостатки Патрис Эмери Лумумба - первый премьер-министр Демократической Республики Конго
Патрис Эмери Лумумба - первый премьер-министр Демократической Республики Конго Штамповые испытания нежестких дорожных конструкций
Штамповые испытания нежестких дорожных конструкций Поход на Елисеевский карьер
Поход на Елисеевский карьер Аппаратные и программные средства видеонаблюдения
Аппаратные и программные средства видеонаблюдения Числовые последовательности - презентация по Алгебре
Числовые последовательности - презентация по Алгебре Производство в суде апелляционной инстанции. Исполнение приговора
Производство в суде апелляционной инстанции. Исполнение приговора  ИСКУССТВО СЕВЕРНОГО ВОЗРОЖДЕНИЯ А. ДЮРЕР
ИСКУССТВО СЕВЕРНОГО ВОЗРОЖДЕНИЯ А. ДЮРЕР Работа - как жизненный путь
Работа - как жизненный путь 1. К участковому стоматологу обратилась бабушка ребенка 2 мес. с незарощением верхней губы. 1. К участковому стоматологу обратил
1. К участковому стоматологу обратилась бабушка ребенка 2 мес. с незарощением верхней губы. 1. К участковому стоматологу обратил Среда визуального программирования. Интегрированная среда разработки приложений
Среда визуального программирования. Интегрированная среда разработки приложений Где живут белые медведи - презентация Окружающий мир_
Где живут белые медведи - презентация Окружающий мир_ Политическая элита и политическое лидерство
Политическая элита и политическое лидерство Проблемы современной миграционной политики стран Западной Европы
Проблемы современной миграционной политики стран Западной Европы Презентация на тему "Как помочь ребёнку в учёбе" - скачать презентации по Педагогике
Презентация на тему "Как помочь ребёнку в учёбе" - скачать презентации по Педагогике Государственные информационные ресурсы и их основные задачи
Государственные информационные ресурсы и их основные задачи Презентация Рынок мяса в России
Презентация Рынок мяса в России  Логическое мышление
Логическое мышление  Жан Батист Мольер (Поклен) (1622 – 1673)
Жан Батист Мольер (Поклен) (1622 – 1673) Государственный природный заповедник «Красноярские Столбы» Каширо Маргарита Александровна старший лаборант кафедры географии Т
Государственный природный заповедник «Красноярские Столбы» Каширо Маргарита Александровна старший лаборант кафедры географии Т Other political “Actors”. (Week 9)
Other political “Actors”. (Week 9) Разработка веб-сервиса для управления контекстной рекламой в системе Яндекс.Директ
Разработка веб-сервиса для управления контекстной рекламой в системе Яндекс.Директ Сообщение о Юрие Цолаковиче Оганесян
Сообщение о Юрие Цолаковиче Оганесян Küche der Welt. Japanisch Küche
Küche der Welt. Japanisch Küche Halloween. Ogtober, 31
Halloween. Ogtober, 31 Оcнови роботи в пакеті Scilab
Оcнови роботи в пакеті Scilab История ложки
История ложки Компьютеры в медицине
Компьютеры в медицине