Содержание
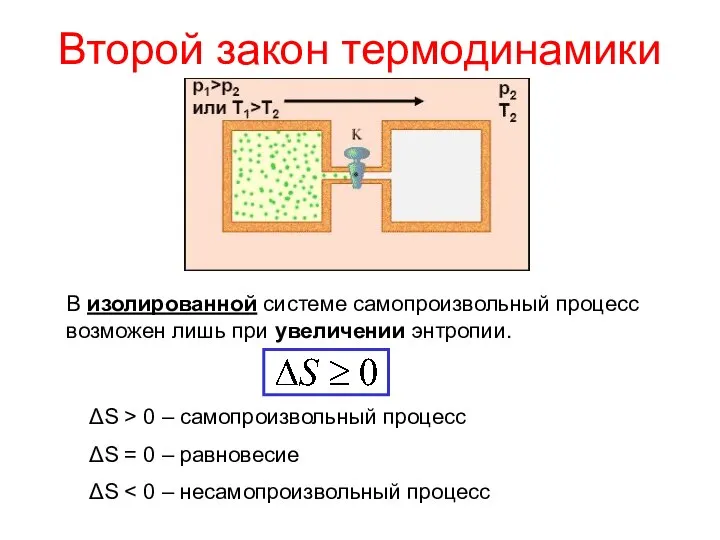
- 2. Второй закон термодинамики В изолированной системе самопроизвольный процесс возможен лишь при увеличении энтропии. ΔS > 0
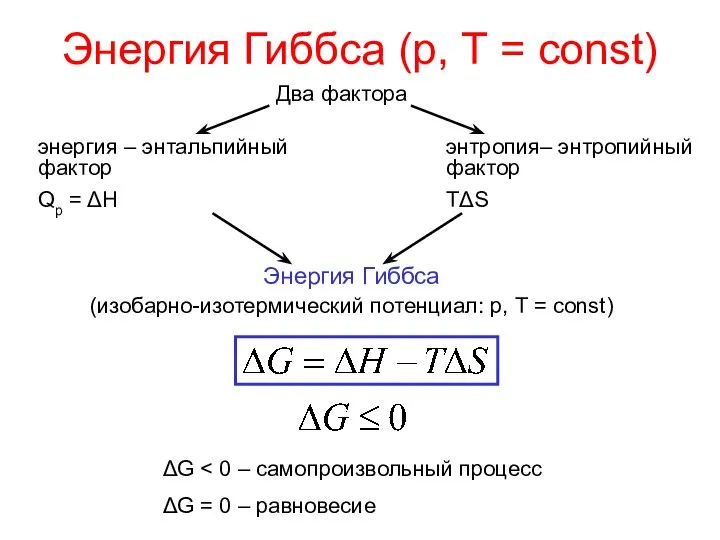
- 3. Энергия Гиббса (р, Т = const) Два фактора энергия – энтальпийный фактор Qp = ΔH энтропия–
- 4. II закон т.д. для химических процессов ΔH 0 – самопроизвольный процесс. 2С(тв.) + О2(г) = 2СО(г)
- 5. Изменение энергии Гиббса Пример Вычислить стандартное изменение энергии Гиббса при 25 °С для термического разложения CaCO3,
- 6. Лекция № 4 Кинетика химических реакций
- 7. Термодинамика и кинетика 2NO (г) + O2(г) = 2NO2 (г); ΔG0298= -70 кДж 2H2 (г) +
- 8. Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций Механизм реакции
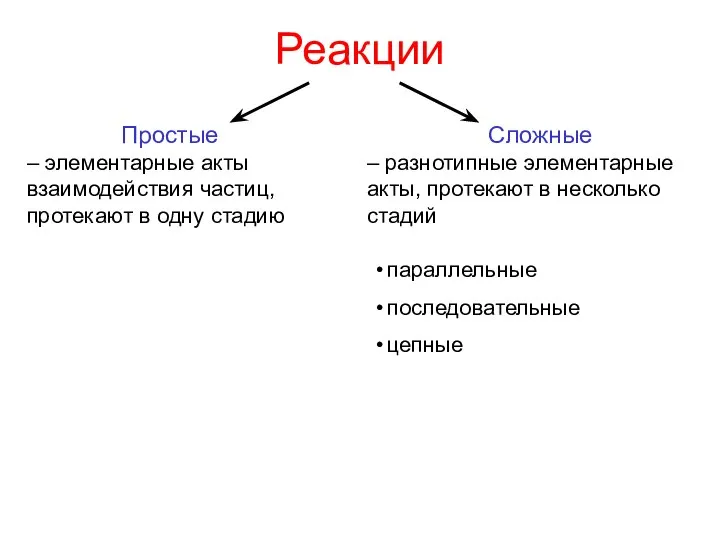
- 9. Реакции Простые – элементарные акты взаимодействия частиц, протекают в одну стадию Сложные – разнотипные элементарные акты,
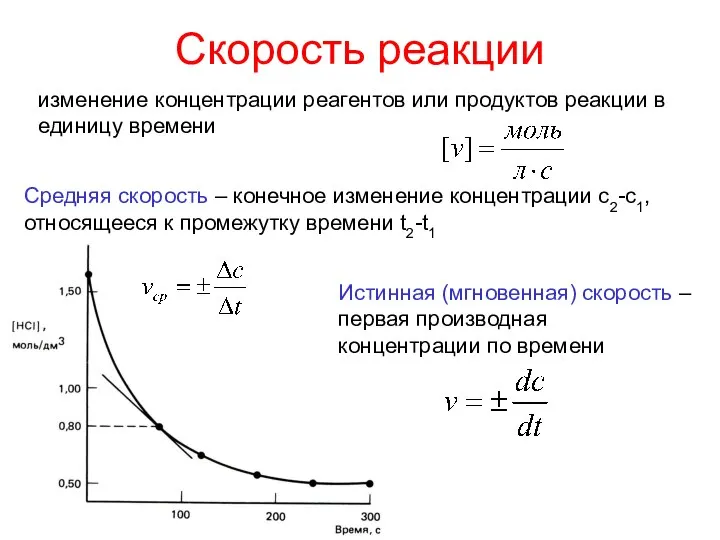
- 10. Скорость реакции изменение концентрации реагентов или продуктов реакции в единицу времени Средняя скорость – конечное изменение
- 11. Скорость реакции зависит от природы реагирующих веществ от температуры от концентрации от давления (для газов) от
- 12. Основной постулат химической кинетики 1867 г. Гульдберг, Вааге – закон действующих масс: скорость элементарной реакции пропорциональна
- 13. Влияние температуры на скорость Правило Вант-Гоффа – при увеличении температуры на 10 °С скорость реакции увеличивается
- 14. Уравнение Аррениуса Энергия активации – минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести
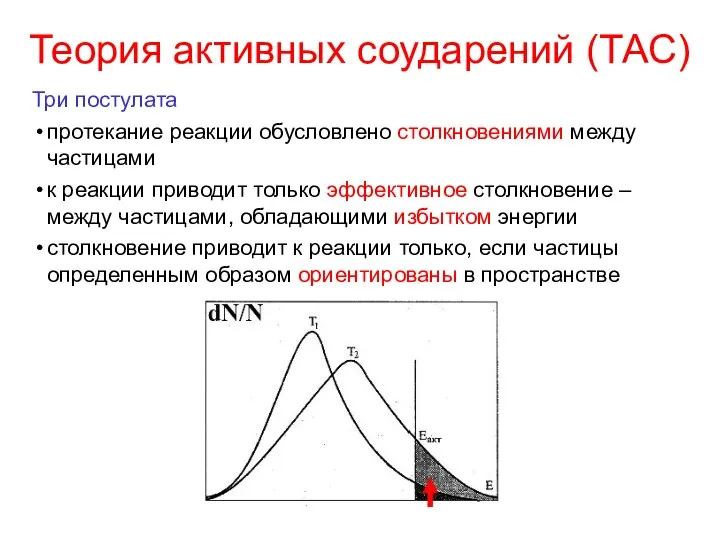
- 15. Теория активных соударений (ТАС) Три постулата протекание реакции обусловлено столкновениями между частицами к реакции приводит только
- 16. Стерический фактор (Р) Z – число всех соударений P – стерический фактор, доля соударений, благоприятных в
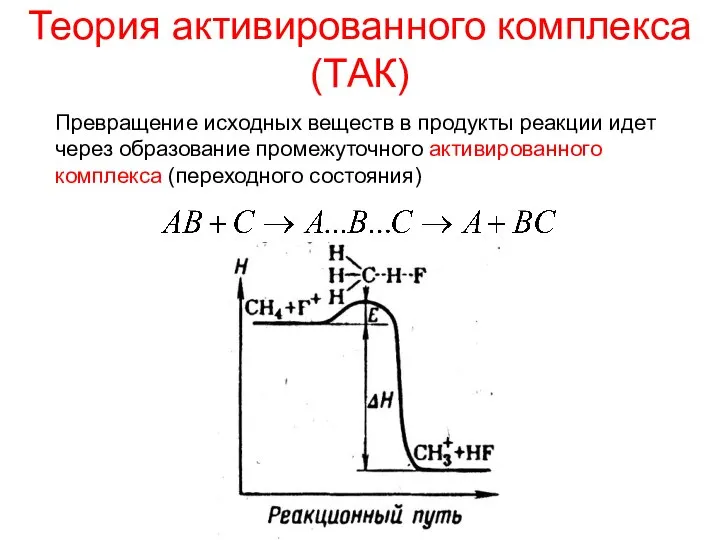
- 17. Теория активированного комплекса (ТАК) Превращение исходных веществ в продукты реакции идет через образование промежуточного активированного комплекса
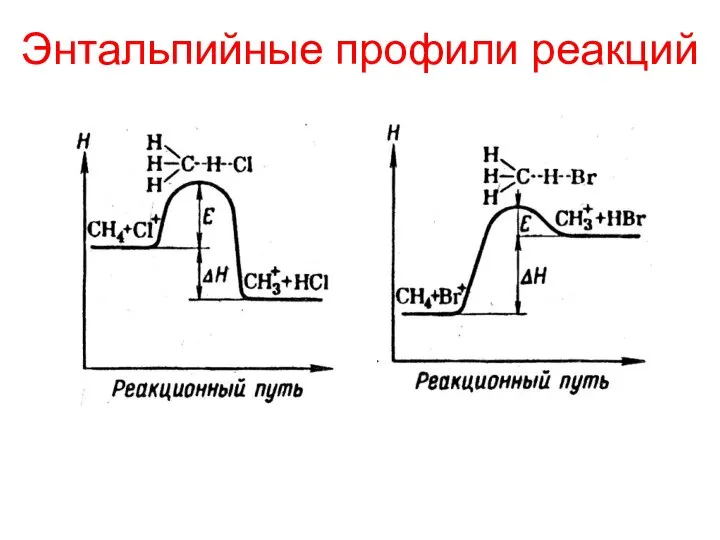
- 18. Энтальпийные профили реакций
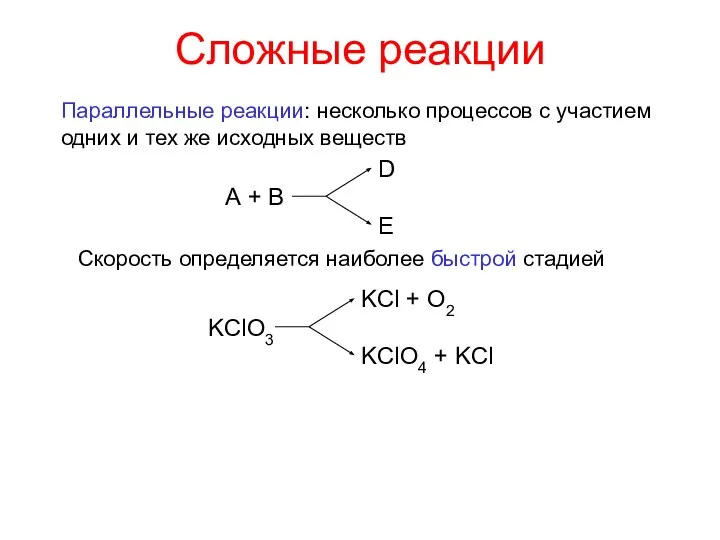
- 19. Сложные реакции Параллельные реакции: несколько процессов с участием одних и тех же исходных веществ Скорость определяется
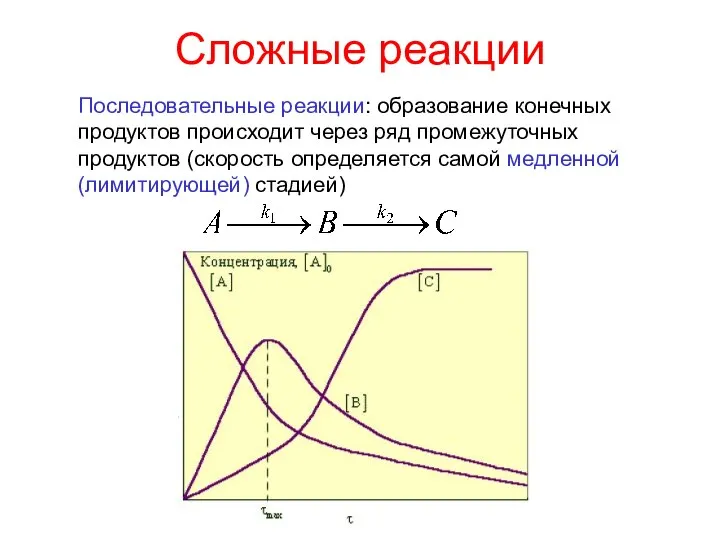
- 20. Сложные реакции Последовательные реакции: образование конечных продуктов происходит через ряд промежуточных продуктов (cкорость определяется самой медленной
- 21. Цепные реакции – реакции, которые вызываются свободными радикалами, под действием которых неактивные молекулы превращаются в активные
- 22. Цепные реакции Разветвленные ц. р. Зарождение цепи (инициирование): Развитие цепи: Разветвление цепи: Обрыв цепи (в том
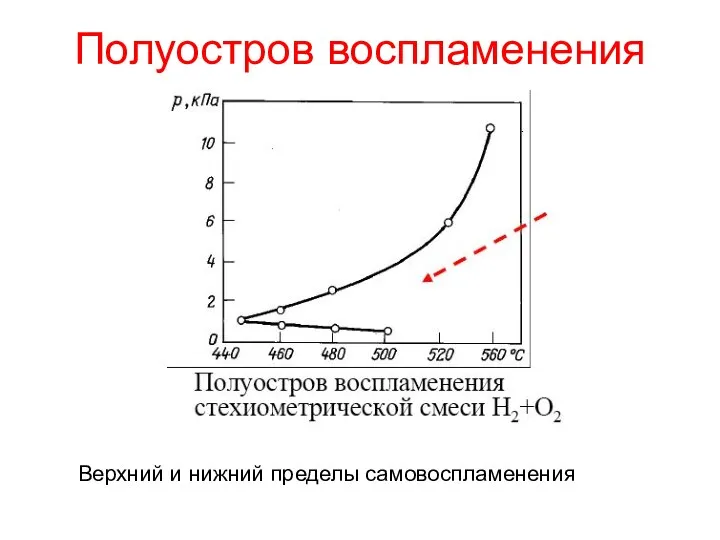
- 23. Полуостров воспламенения Верхний и нижний пределы самовоспламенения
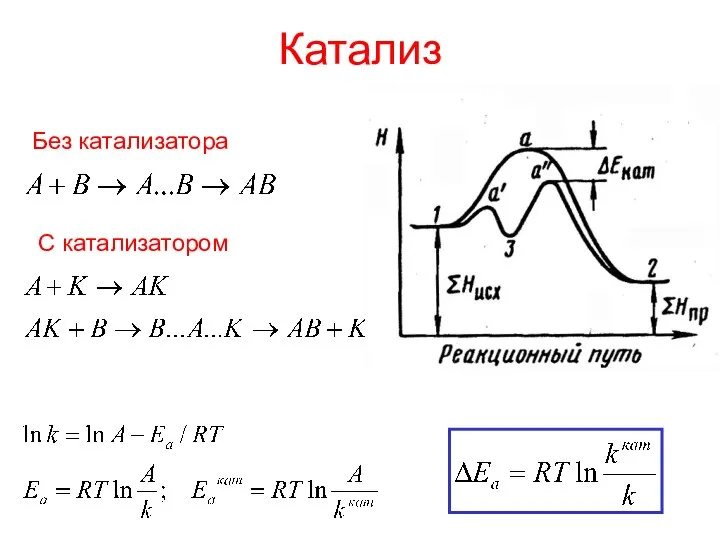
- 24. Катализ Катализаторы – вещества, ускоряющие химическую реакцию. Ингибиторы – вещества, замедляющие химическую реакцию. Катализ – изменение
- 25. Катализ Без катализатора С катализатором
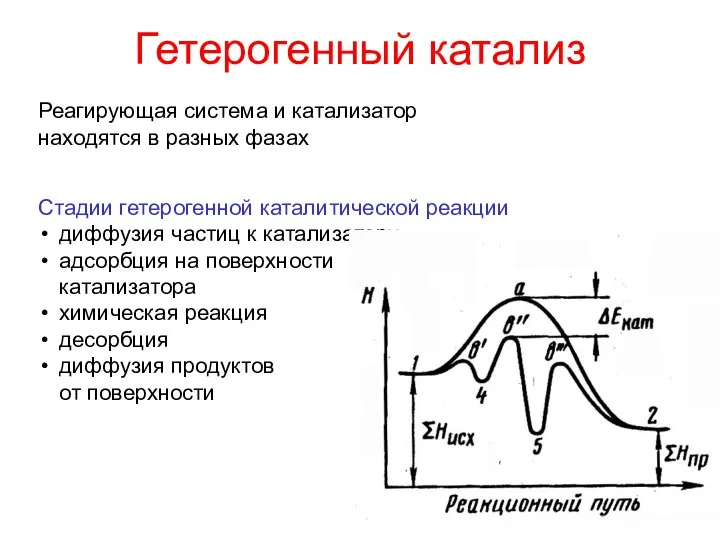
- 26. Гетерогенный катализ Реагирующая система и катализатор находятся в разных фазах Стадии гетерогенной каталитической реакции диффузия частиц
- 27. Химическое равновесие – для растворов – для газов Константа равновесия (К) – мера глубины протекания процесса
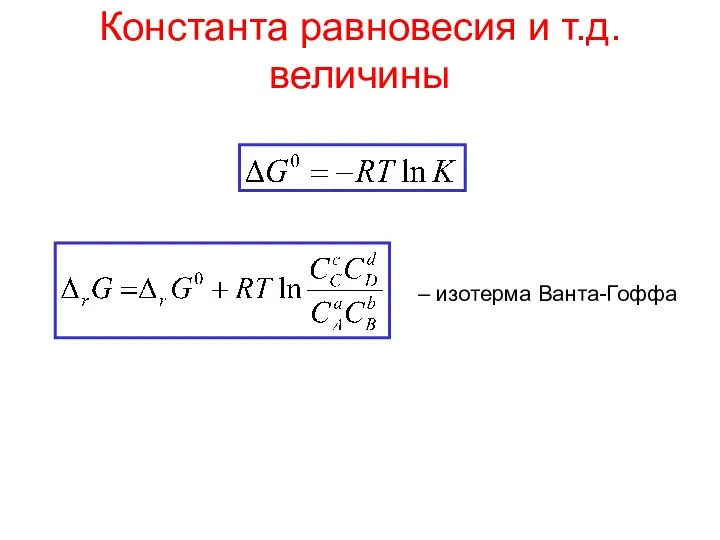
- 28. Константа равновесия и т.д. величины – изотерма Ванта-Гоффа
- 29. Принцип Ле-Шателье Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то в системе возникает
- 30. Влияние внешних условий на равновесие Концентрация В систему добавлено исходное вещество: равновесие смещается вправо В систему
- 31. Влияние внешних условий на равновесие Общее давление (для газовых реакций) Увеличение общего давления смещает равновесие в
- 33. Скачать презентацию

















 Тема 6. МАКРОЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ В СИСТЕМЕ НАЦИОНАЛЬНЫХ СЧЕТОВ 6.1. Понятие системы национальных счетов и ее состав Систе
Тема 6. МАКРОЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ В СИСТЕМЕ НАЦИОНАЛЬНЫХ СЧЕТОВ 6.1. Понятие системы национальных счетов и ее состав Систе Оборудование Данфосс в инженерных системах зданий. Радиаторные терморегуляторы
Оборудование Данфосс в инженерных системах зданий. Радиаторные терморегуляторы Презентация "Особенности финансов кредитных организаций" - скачать презентации по Экономике
Презентация "Особенности финансов кредитных организаций" - скачать презентации по Экономике Введение в предмет черчения
Введение в предмет черчения Future graphics in games
Future graphics in games технологии и механизмы регулирования профессионального развития должностных лиц таможенных органов Петрова Маргарита Куркина
технологии и механизмы регулирования профессионального развития должностных лиц таможенных органов Петрова Маргарита Куркина лекция Метрология
лекция Метрология Культура и религия древнего Египта
Культура и религия древнего Египта Frankfurt
Frankfurt Электрический тельфер
Электрический тельфер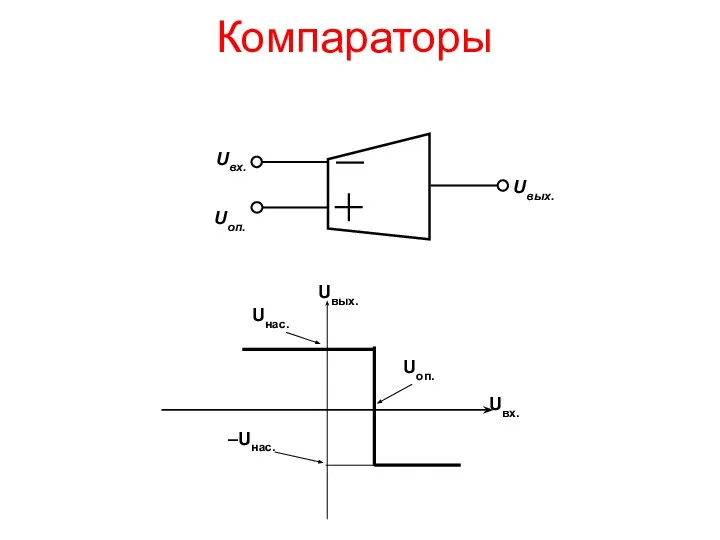 Компараторы
Компараторы Презентация Количественные и качественные показатели рынка рыбы
Презентация Количественные и качественные показатели рынка рыбы  Презентация Модель М. Портера
Презентация Модель М. Портера Возможности с Rejuvital
Возможности с Rejuvital Сущность ислама и его место в современном мире и Казахстане
Сущность ислама и его место в современном мире и Казахстане ОРГАНИЗАЦИЯ СПЕЦИАЛЬНЫХ СОБЫТИЙ: Церемонии открытия Приемы
ОРГАНИЗАЦИЯ СПЕЦИАЛЬНЫХ СОБЫТИЙ: Церемонии открытия Приемы Электропривод и автоматизация оборудования лесного комплекса
Электропривод и автоматизация оборудования лесного комплекса Глобализация
Глобализация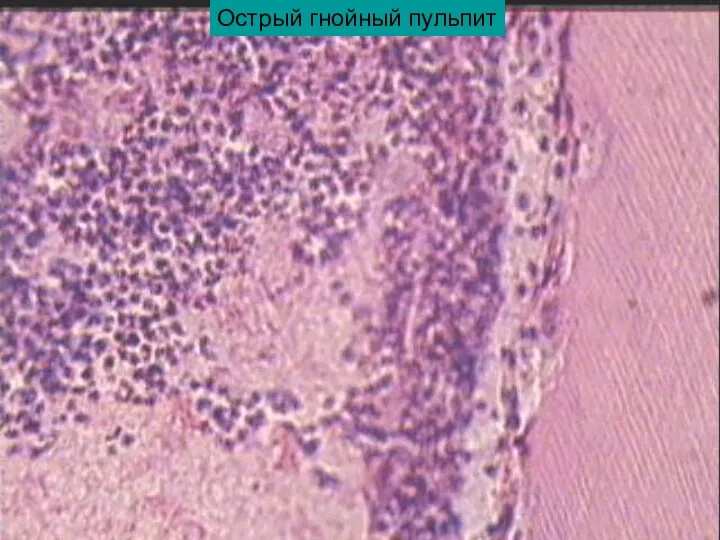 7 занятие_стом.ppt
7 занятие_стом.ppt Франсуа Війон
Франсуа Війон Сравнительный анализ применения типовых проектов при строительстве, ремонте и реконструкции автомобильных дорог и проектов
Сравнительный анализ применения типовых проектов при строительстве, ремонте и реконструкции автомобильных дорог и проектов Об истории возникновения и развития лизинга
Об истории возникновения и развития лизинга Права и свободы человека и гражданина
Права и свободы человека и гражданина Знакомство с языком С
Знакомство с языком С Этапы строительства. Содержание этапов работ ООО «МайЛэнд»
Этапы строительства. Содержание этапов работ ООО «МайЛэнд» Средневековая деревня и её обитатели
Средневековая деревня и её обитатели Объединённые Арабские Эмираты
Объединённые Арабские Эмираты Дыхание
Дыхание