Содержание
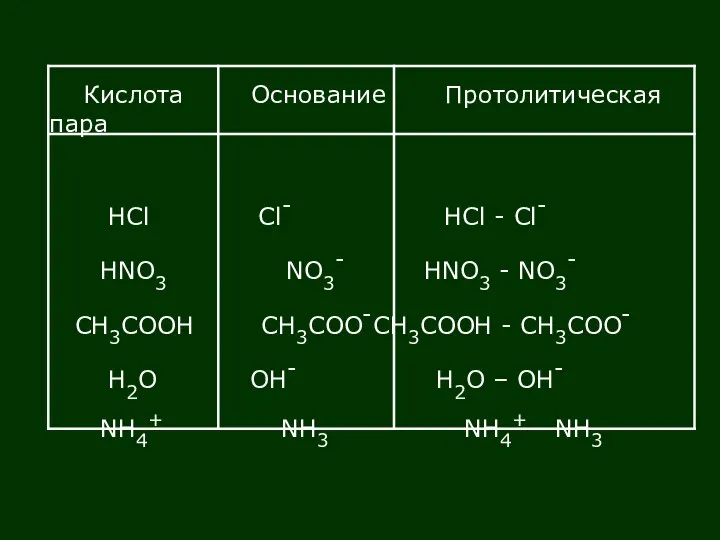
- 2. Кислота Основание Протолитическая пара HCl Cl- HCl - Cl- HNO3 NO3- HNO3 - NO3- CH3COOH CH3COO-
- 3. Автопротолиз Н2О + Н2О ↔ Н3О+ + ОН- ион гидроксония гидроксид - ион В общем случае:
- 4. При Т = const, аH2O = const: К ∙ аH2O2 = Kw = KH2O – константа
- 5. Водородный показатель: рН = - lg aH+ Приближенное выражение: рН = - lg [H+], pOH =
- 6. Сила кислот и оснований НА + Н2О ↔ Н3О+ + А- или НА ↔ Н+ +
- 7. КA ∙ КВ = [Н+] ∙ [ОН-] = 10-14 = Kw = KH2O КA ∙ КВ
- 8. Вычисление рН сильных кислот и оснований НА ↔ Н+ + А- Обозначим: СН+ - общая концентрация
- 9. Пример 1. Рассчитать рН раствора 0.01М раствора HCl. С(HCl) = 0.01 моль/л рН = -lg [H+]
- 10. Вычисление рН слабых кислот и оснований НА ↔ Н+ + А- Обозначим: Х – концентрация =
- 11. -lg [H+] = -1/2 lgK – 1/2 lgCHA рН = 1/2 рК - 1/2 lgCHA Для
- 12. Буферные растворы СН3СООН + СН3СООNa – ацетатный буфер NH4OH + NH4Cl – аммиачный буфер СН3СООNa +
- 13. [СH3СОО-] ∙ [Н+] CH+ ∙ CCH3COO- CH+ ∙ (Cсоли + Х) КНА = = = [СН3СООН]
- 14. Равновесие в аммиачном буфере: рН буферного раствора слабого основания и его соли: Cоснования Cоснования рОН =
- 16. Скачать презентацию




![КA ∙ КВ = [Н+] ∙ [ОН-] = 10-14 = Kw](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1293270/slide-6.jpg)



![-lg [H+] = -1/2 lgK – 1/2 lgCHA рН = 1/2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1293270/slide-10.jpg)

![[СH3СОО-] ∙ [Н+] CH+ ∙ CCH3COO- CH+ ∙ (Cсоли + Х)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1293270/slide-12.jpg)

 Этапы работы над рефератом Советы членам ШНОУ «ЮНИКС» Руководители НОУ: Бударева Л.А., Бельская О.А. 2007-2008 учебный год
Этапы работы над рефератом Советы членам ШНОУ «ЮНИКС» Руководители НОУ: Бударева Л.А., Бельская О.А. 2007-2008 учебный год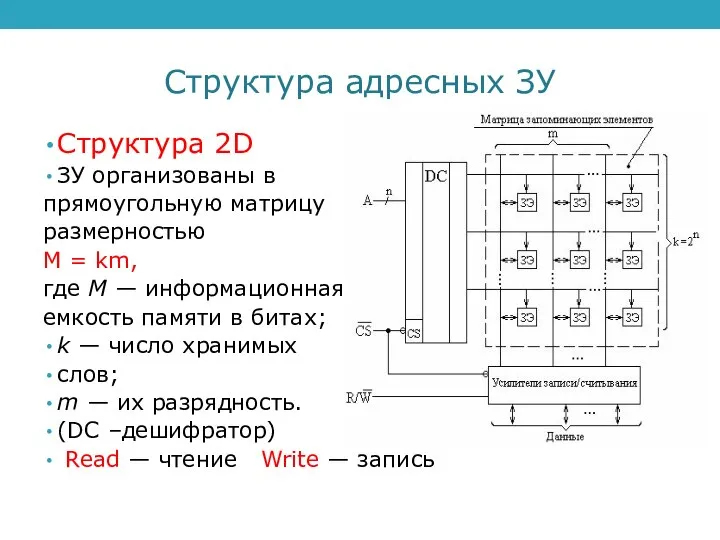 Структура адресных ЗУ
Структура адресных ЗУ Объектно-ориентированное программирование
Объектно-ориентированное программирование Typological classification of languages
Typological classification of languages Мораль, право и политика в социологии международных отношений
Мораль, право и политика в социологии международных отношений Tiere
Tiere ТСС РНП (Радиолокация) Часть 2
ТСС РНП (Радиолокация) Часть 2 Физиологические механизмы и закономерности развития физических качеств и двигательных навыков
Физиологические механизмы и закономерности развития физических качеств и двигательных навыков Жизненный цикл организации Петрова М. Зедеев А.
Жизненный цикл организации Петрова М. Зедеев А. Программирование на языке Паскаль. Символьные строки
Программирование на языке Паскаль. Символьные строки Презентация "Рынки факторов производства" - скачать презентации по Экономике
Презентация "Рынки факторов производства" - скачать презентации по Экономике Презентация на тему "Причины неуспеваемости по отношению к школьнику" - скачать презентации по Педагогике
Презентация на тему "Причины неуспеваемости по отношению к школьнику" - скачать презентации по Педагогике МЕСОПОТАМИЯ
МЕСОПОТАМИЯ Туган җирем, мәктәбем
Туган җирем, мәктәбем заболевания парадонта - презентация для начальной школы
заболевания парадонта - презентация для начальной школы По математической сказке… МОУ «Сорская СОШ №3 с УИОП» Учитель: Канаева Татьяна Анатольевна
По математической сказке… МОУ «Сорская СОШ №3 с УИОП» Учитель: Канаева Татьяна Анатольевна Постановка и решение вспомогательной задачи
Постановка и решение вспомогательной задачи Классификация проектов и разновидности проектного управления. Глава 3
Классификация проектов и разновидности проектного управления. Глава 3 Образ России в произведениях искусства
Образ России в произведениях искусства Психологическая служба школы Психолог Соловьенко А.В.
Психологическая служба школы Психолог Соловьенко А.В. исследование 4 кл. - презентация для начальной школы
исследование 4 кл. - презентация для начальной школы Педагогический проект
Педагогический проект Правила планирования преемственности
Правила планирования преемственности Шанхайская организация сотрудничества (ШОС)
Шанхайская организация сотрудничества (ШОС) Социально-исторические предпосылки государства и права. Возникновение государства и права
Социально-исторические предпосылки государства и права. Возникновение государства и права Синтез искусств в архитектуре. Витраж
Синтез искусств в архитектуре. Витраж Как помочь ребенку справиться с эмоциями
Как помочь ребенку справиться с эмоциями L1-Akusherstvo_kak_nauka
L1-Akusherstvo_kak_nauka