Содержание
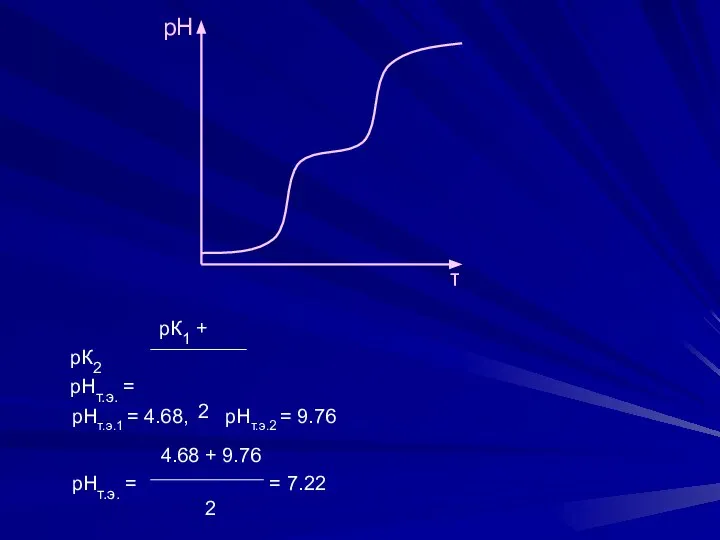
- 2. рН τ рК1 + рК2 рНт.э. = 2 рНт.э.1 = 4.68, рНт.э.2 = 9.76 4.68 +
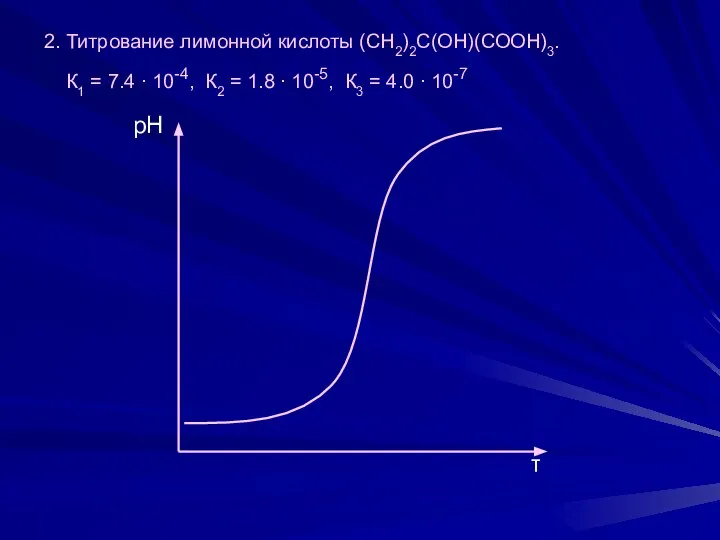
- 3. 2. Титрование лимонной кислоты (СН2)2С(ОН)(СООН)3. К1 = 7.4 ∙ 10-4, К2 = 1.8 ∙ 10-5, К3
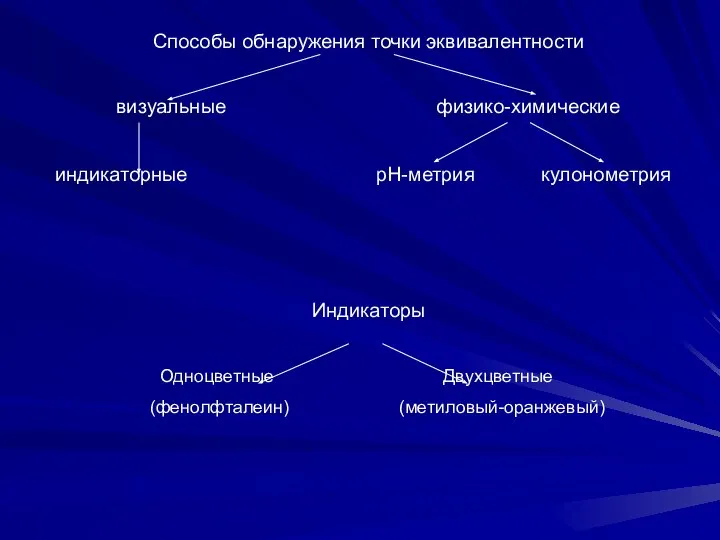
- 4. Способы обнаружения точки эквивалентности визуальные физико-химические индикаторные рН-метрия кулонометрия Индикаторы Одноцветные Двухцветные (фенолфталеин) (метиловый-оранжевый)
- 5. Для метилового-оранжевого: HInd + H2O ↔ Ind- + H3O+ красная (рН 4) [Ind-] ∙ [H3O+] KInd
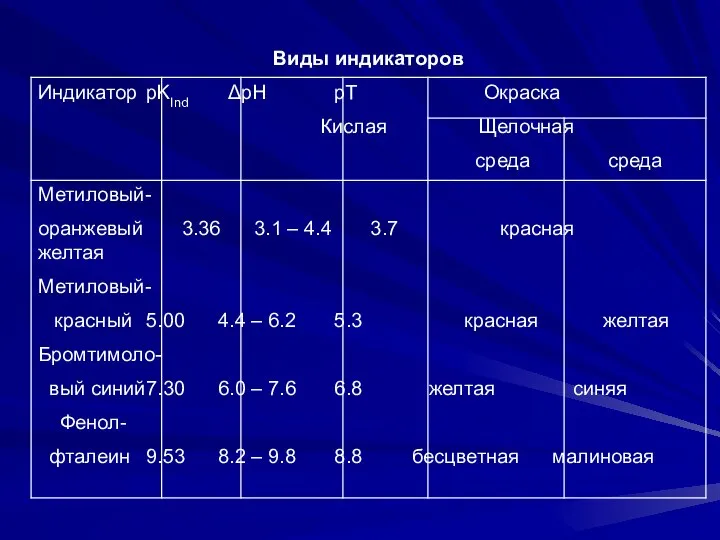
- 6. Виды индикаторов Индикатор pKInd ΔрН рТ Окраска Кислая Щелочная среда среда Метиловый- оранжевый 3.36 3.1 –
- 7. Окислительно – восстановительное титрование (редоксиметрия) Реакция восстановления: Ох1 + ne- → Red1 Реакция окисления: Red2 -
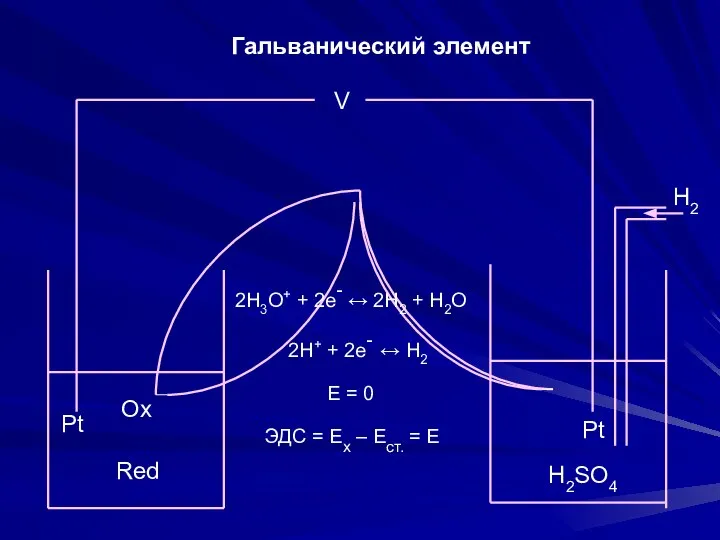
- 8. Н2 V Pt Ox Red Pt H2SO4 2H3O+ + 2e- ↔ 2H2 + H2O 2H+ +
- 9. Уравнение Нернста: RT aOx Е = Е0 + ∙ ln nF aRed Если RT/F = const,
- 10. Если aOх = aRed = 1 моль/л, то Е = Е0 – стандартный ОВ-потенциал – справочная
- 11. Условия протекания ОВ-реакций 0.059 aOx1 Ox1 + n1e- → Red1, n1, Е1 = Е10 + ∙
- 12. Е1 = Е2: 0.059 aOx1 0.059 aOx2 Е10 + ∙ lg = Е20 + ∙ lg
- 14. Скачать презентацию






 Операционно-технологическая карта сборки и сварки металлоконструкции
Операционно-технологическая карта сборки и сварки металлоконструкции Динамические типы данных. Списки
Динамические типы данных. Списки К СОЗДАНИЮ ОБРАЗОВАТЕЛЬНО-ПРОФЕССИОНАЛЬ НЫХ ПРОГРАММ НА МОДУЛЬНОЙ ОСНОВЕ
К СОЗДАНИЮ ОБРАЗОВАТЕЛЬНО-ПРОФЕССИОНАЛЬ НЫХ ПРОГРАММ НА МОДУЛЬНОЙ ОСНОВЕ Значение системы «антиплагиат» для обеспечения качества научно-исследовательской работы. Выполнил: Студент 2-го курса группы э121
Значение системы «антиплагиат» для обеспечения качества научно-исследовательской работы. Выполнил: Студент 2-го курса группы э121 Муниципальное образовательное учреждение средняя (полная) общеобразовательная школа № 6 г. Волжска Республики Марий Эл ПРОФИ
Муниципальное образовательное учреждение средняя (полная) общеобразовательная школа № 6 г. Волжска Республики Марий Эл ПРОФИ Россия в XVII веке: от Смуты к утверждению самодержавно-крепостнического строя
Россия в XVII веке: от Смуты к утверждению самодержавно-крепостнического строя Twitter : Діалог - валюта бізнесу
Twitter : Діалог - валюта бізнесу Анализ концепции таможенного оформления и таможенного контроля товаров в местах, приближенных к государственной границе Подг
Анализ концепции таможенного оформления и таможенного контроля товаров в местах, приближенных к государственной границе Подг ВКР: Разработка программного модуля проверки АРМ разработчика в среде Navisworks
ВКР: Разработка программного модуля проверки АРМ разработчика в среде Navisworks Марковские процессы с непрерывным временем. Теорема Колмогорова. (Лекция 3)
Марковские процессы с непрерывным временем. Теорема Колмогорова. (Лекция 3) Основы методики самостоятельных занятий физическими упражнениями
Основы методики самостоятельных занятий физическими упражнениями Метрология. Развитие стандартизации на Руси
Метрология. Развитие стандартизации на Руси Презентация "Архитектура Древней Греции Типы храмов Ордер" - скачать презентации по МХК
Презентация "Архитектура Древней Греции Типы храмов Ордер" - скачать презентации по МХК Лес Сезонные изменения Зима - презентация для начальной школы_
Лес Сезонные изменения Зима - презентация для начальной школы_ Банковская система
Банковская система  Муниципальное казённое образовательное учреждение дополнительного образования детей «ДЮСШ Хохольского района»
Муниципальное казённое образовательное учреждение дополнительного образования детей «ДЮСШ Хохольского района» Понятие, состав и структура оборотных средств. Производственные оборотные фонды.
Понятие, состав и структура оборотных средств. Производственные оборотные фонды. Словарный диктант «Имена собственные и нарицательные»
Словарный диктант «Имена собственные и нарицательные» Воспрепятствование законной предпринимательской или иной деятельности
Воспрепятствование законной предпринимательской или иной деятельности Тайм-менеджмент
Тайм-менеджмент Цифровые вычислительные устройства и микропроцессоры приборных комплексов
Цифровые вычислительные устройства и микропроцессоры приборных комплексов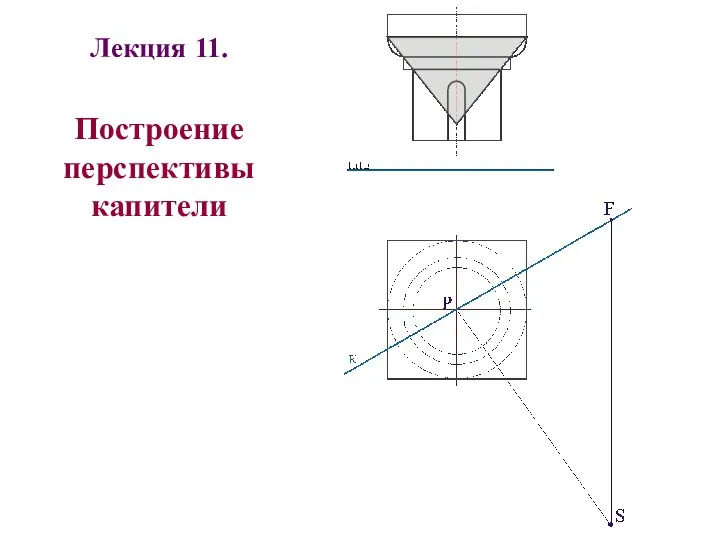 Построение перспективы капители
Построение перспективы капители Современный музей как фактор развития территории (на примере муниципальных музеев Республики Башкортостан)
Современный музей как фактор развития территории (на примере муниципальных музеев Республики Башкортостан) Состав и выбор методов ИСУ
Состав и выбор методов ИСУ Тема лекции СНГ: интеграция в условиях переходной экономики
Тема лекции СНГ: интеграция в условиях переходной экономики Конкурс День Народного Единства. Хоккейный клуб "Волхов" (фото)
Конкурс День Народного Единства. Хоккейный клуб "Волхов" (фото) Тренажёр - презентация для начальной школы
Тренажёр - презентация для начальной школы АЛГОРИТМЫ И МОДЕЛИ ТРАССИРОВКИ ПЕЧАТНЫХ СОЕДИНЕНИЙ В ЭА
АЛГОРИТМЫ И МОДЕЛИ ТРАССИРОВКИ ПЕЧАТНЫХ СОЕДИНЕНИЙ В ЭА