Содержание
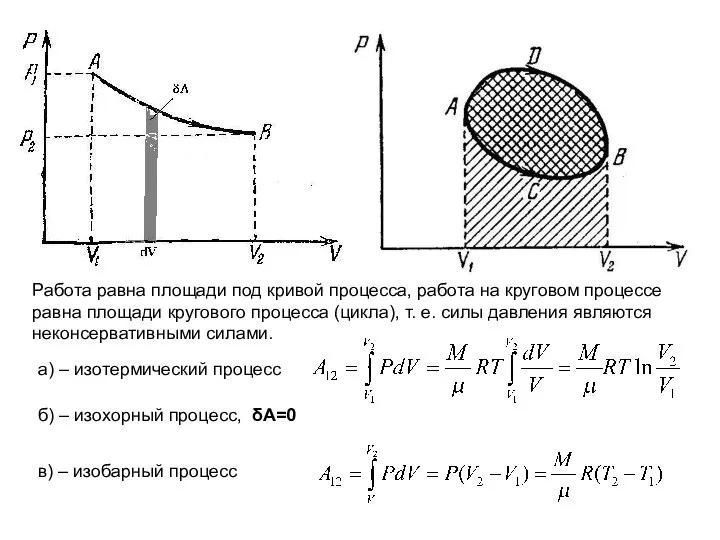
- 2. Работа равна площади под кривой процесса, работа на круговом процессе равна площади кругового процесса (цикла), т.
- 3. 2. Теплопередача (теплообмен) – форма обмена энергией, в основе которого лежит прямое взаимодействие между частицами системы
- 4. Первое начало термодинамики 1. Для круговых процессов Отношение количества тепла, полученного системой на круговом процессе, к
- 5. Теплоемкость идеального газа: а) при постоянном объеме б) при постоянном давлении Адиабатический процесс и его уравнения
- 7. График адиабатного процесса и работа газа. Классическая теория теплоемкости твердых тел (кристаллов) Правило Дюлонга и Пти
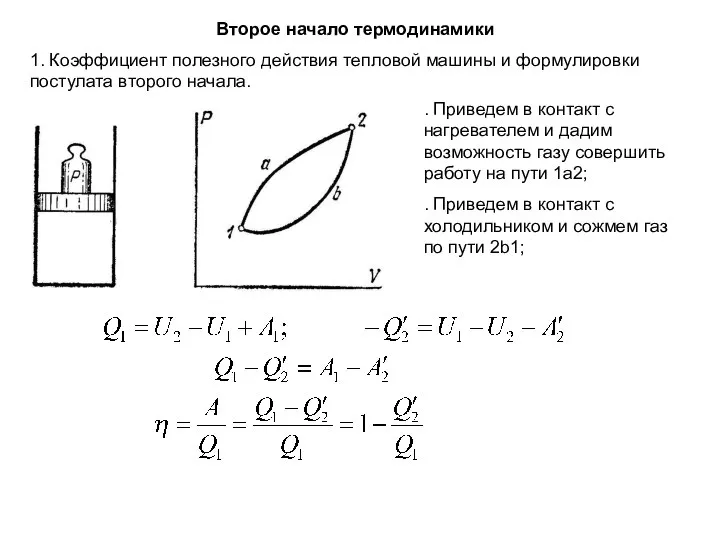
- 8. Второе начало термодинамики 1. Коэффициент полезного действия тепловой машины и формулировки постулата второго начала. . Приведем
- 9. Вильям Томсон (лорд Кельвин) 1851 г. «невозможен круговой процесс, единственным результатом которого было бы производство работы
- 10. 3. Цикл Карно и теорема Карно (1-2) – изотермическое расширение при Т1, получает от нагревателя Q1;
- 11. Термодинамическое неравенство и равенство Клаузиуса Произвольная термодинамическая система обменивается с окружающей средой энергией в процессе теплопередачи
- 12. Для обратимого процесса неравенство Клаузиуса переходит в равенство. Для прямого процесса Для обратного процесса Это возможно
- 13. Энтропия Энтропия системы есть функция ее состояния, определенная с точностью до произвольной постоянной. Разность энтропий в
- 14. Закон возрастания энтропии 1 и 2 – равновесные состояния системы, а процесс перехода 1I2 – необратимый.
- 15. Термодинамические функции Гипотеза тепловой смерти вселенной Р. Клаузиуса «Энтропия Вселенной стремится к максимуму». Когда будет достигнут
- 16. 2. Свободная энергия При изотермическом процессе dT=0, поэтому dΨ = -PdV = -δA. Т.е. А =
- 17. Энтропия и вероятность Согласно термодинамическим представлениям все процессы в замкнутой системе происходят в направлении возрастания энтропии.
- 18. Обобщим расчет, пусть V0 – объем всего сосуда, а V – объем какой – либо его
- 19. Пусть Р1 иР2 изменяются так, что их произведение остается постоянным f(P1)+f(P2)=const P1⋅P2=const Дифференцируя эти соотношения, получим
- 20. Для установления значения постоянной k рассчитаем независимыми способами две величины: разность энтропий системы в двух состояниях
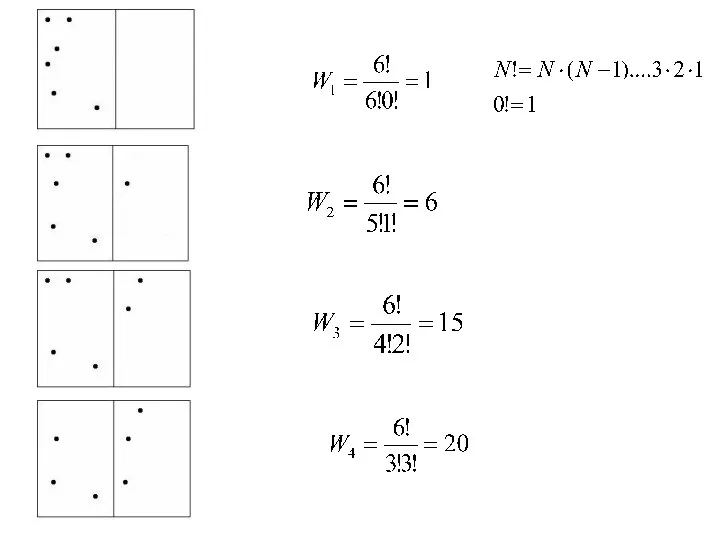
- 21. Макро- и микросостояния системы. Термодинамическая вероятность макросостояния системы (статистический вес). Микросостояние системы задается указанием значений координат
- 22. В качестве примера рассмотрим распределение по пространственным ячейкам. Для этого разобьем мысленно объем V на малые
- 24. Что же остается от необратимости процессов и второго начала термодинамики? 1. Закон возрастания энтропии утрачивает свою
- 25. Это возможно только при СР→0, если Т→0. Теорема Нернста не может быть истолкована классически. Объясняет ее
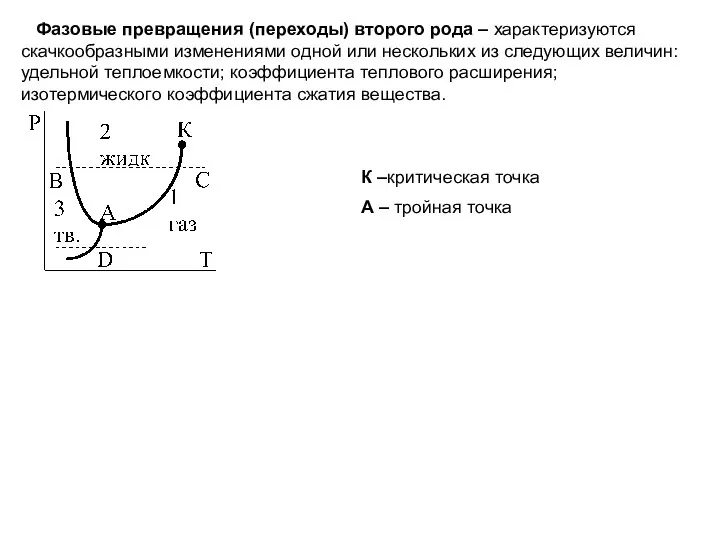
- 26. Фазовые превращения (переходы) второго рода – характеризуются скачкообразными изменениями одной или нескольких из следующих величин: удельной
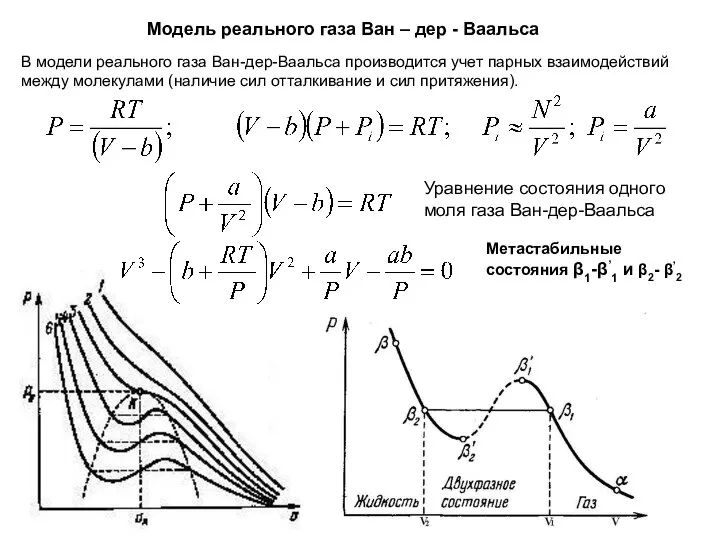
- 27. Модель реального газа Ван – дер - Ваальса В модели реального газа Ван-дер-Ваальса производится учет парных
- 29. Скачать презентацию





















 Оказание государственных услуг в области промышленной безопасности РГУ Департамента КИРПБ МИР РК
Оказание государственных услуг в области промышленной безопасности РГУ Департамента КИРПБ МИР РК Поведение фирмы на рынке совершенной конкуренции в краткосрочном периоде
Поведение фирмы на рынке совершенной конкуренции в краткосрочном периоде Методы монтажа конструкций зданий и сооружений
Методы монтажа конструкций зданий и сооружений Информационная модель ЛДП
Информационная модель ЛДП Проецирование. Тест
Проецирование. Тест Презентация Классификация овощей
Презентация Классификация овощей  ООП 2. Класс и Объект
ООП 2. Класс и Объект Презентация Я-концепция и самосознание личности
Презентация Я-концепция и самосознание личности  Методика обоснования управленческих решений на основе маржинального анализа
Методика обоснования управленческих решений на основе маржинального анализа Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №15 п. Березайка» «Гармония жилья с
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №15 п. Березайка» «Гармония жилья с  Наркоз
Наркоз Понятие консалтинга в области информационных технологий
Понятие консалтинга в области информационных технологий  Презентация "Оп-арт" - скачать презентации по МХК
Презентация "Оп-арт" - скачать презентации по МХК Леонардо да Винчи
Леонардо да Винчи Выполнили: Мельников Дмитрий, 204 группа Хмель Дмитрий, 203 группа
Выполнили: Мельников Дмитрий, 204 группа Хмель Дмитрий, 203 группа Зовнішньоекономічна діяльність підприємства
Зовнішньоекономічна діяльність підприємства План для свай
План для свай Электронные ресурсы в работе учителя математики
Электронные ресурсы в работе учителя математики Шаблон проекта
Шаблон проекта Таможня
Таможня Презентация Культура эпохи Возрождения
Презентация Культура эпохи Возрождения Антибактериальные химиотерапевтические средства. Принципы химиотерапии. Антибиотики.
Антибактериальные химиотерапевтические средства. Принципы химиотерапии. Антибиотики. Пасха. День чудесного воскресения Иисуса Христа
Пасха. День чудесного воскресения Иисуса Христа Развитие внимания на уроках - презентация для начальной школы_
Развитие внимания на уроках - презентация для начальной школы_ Промышленный шпионаж
Промышленный шпионаж Техника рисования быстрых рисунков - скетчинг
Техника рисования быстрых рисунков - скетчинг PHP #1.1. Введение. Быстрый старт
PHP #1.1. Введение. Быстрый старт Как принимать платежи Яндекс.Деньгами без подключения? Инструменты. Финансовые схемы. Примеры.
Как принимать платежи Яндекс.Деньгами без подключения? Инструменты. Финансовые схемы. Примеры.