Содержание
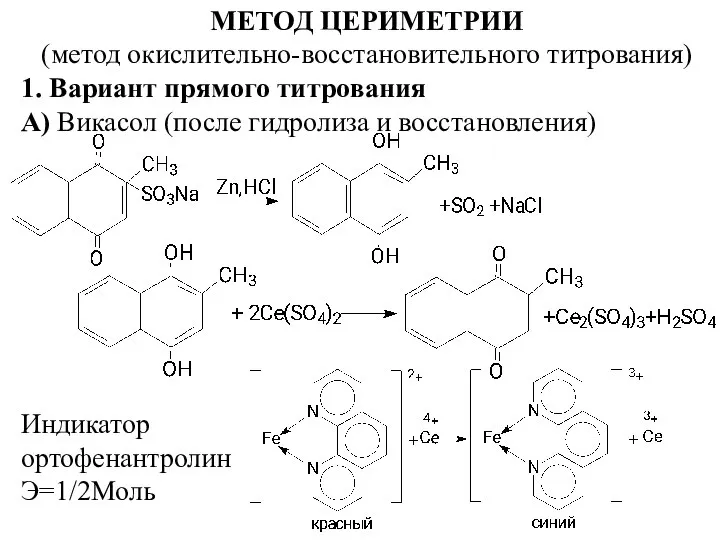
- 2. МЕТОД ЦЕРИМЕТРИИ (метод окислительно-восстановительного титрования) 1. Вариант прямого титрования А) Викасол (после гидролиза и восстановления) Индикатор
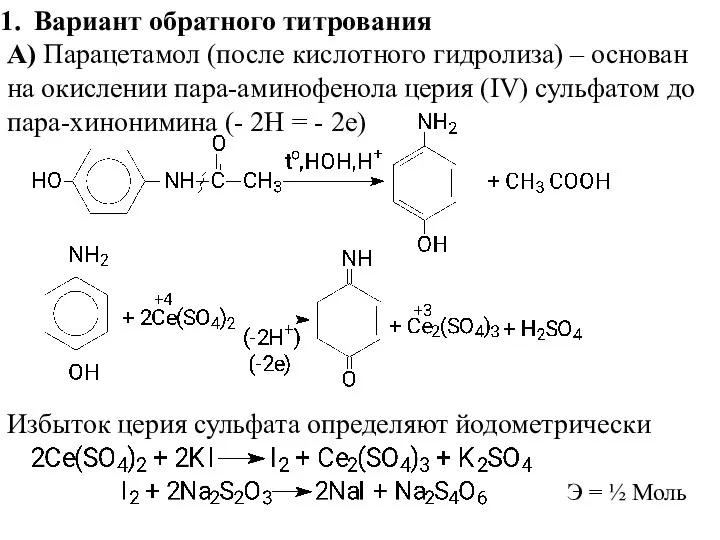
- 3. Вариант обратного титрования А) Парацетамол (после кислотного гидролиза) – основан на окислении пара-аминофенола церия (IV) сульфатом
- 4. Продолжение Б) Раствор формальдегида (вариант обратного титрования), основан на окислении формальдегида до Муравьиной (метановой) кислоты Э
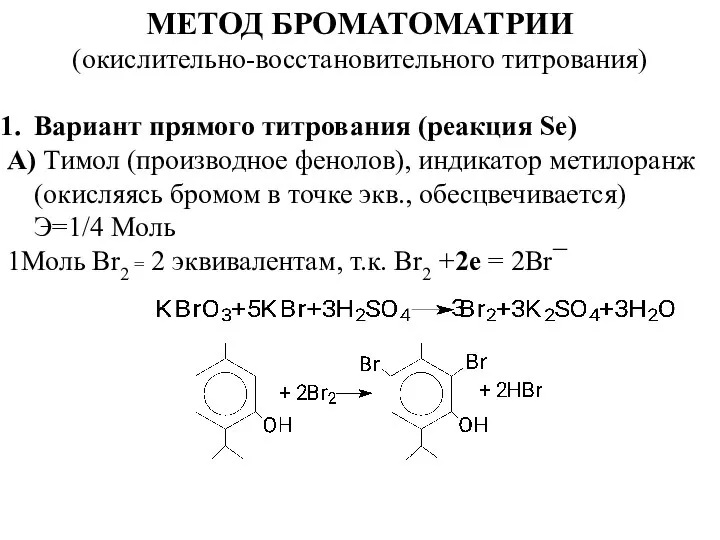
- 5. МЕТОД БРОМАТОМАТРИИ (окислительно-восстановительного титрования) Вариант прямого титрования (реакция Se) А) Тимол (производное фенолов), индикатор метилоранж (окисляясь
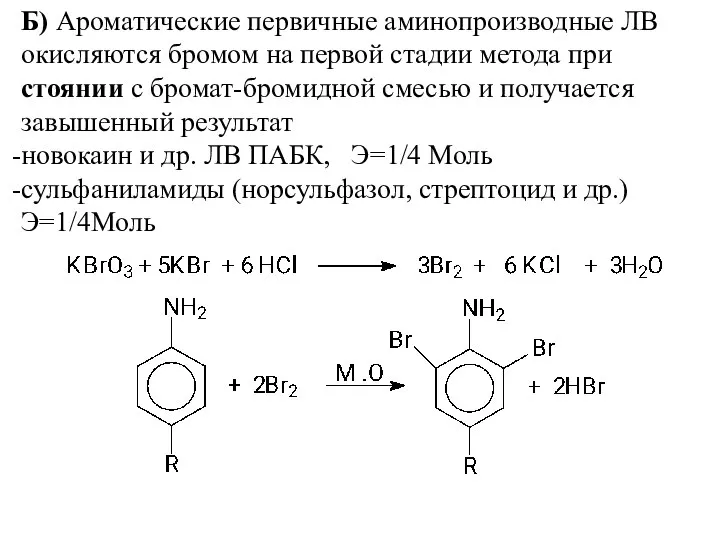
- 6. Б) Ароматические первичные аминопроизводные ЛВ окисляются бромом на первой стадии метода при стоянии с бромат-бромидной смесью
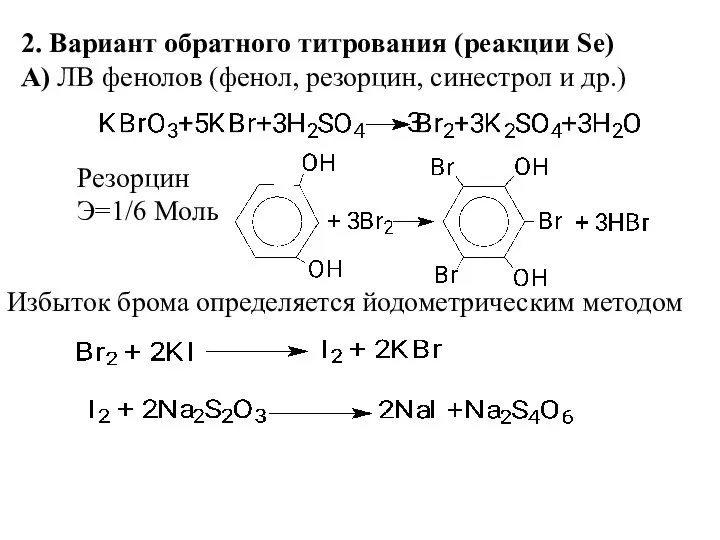
- 7. 2. Вариант обратного титрования (реакции Se) А) ЛВ фенолов (фенол, резорцин, синестрол и др.) Резорцин Э=1/6
- 8. Б) Салициловая кислота и ее Na соль, бромирование идет с декарбоксилированием, Э=1/6 Моль Натрия салицилат В)
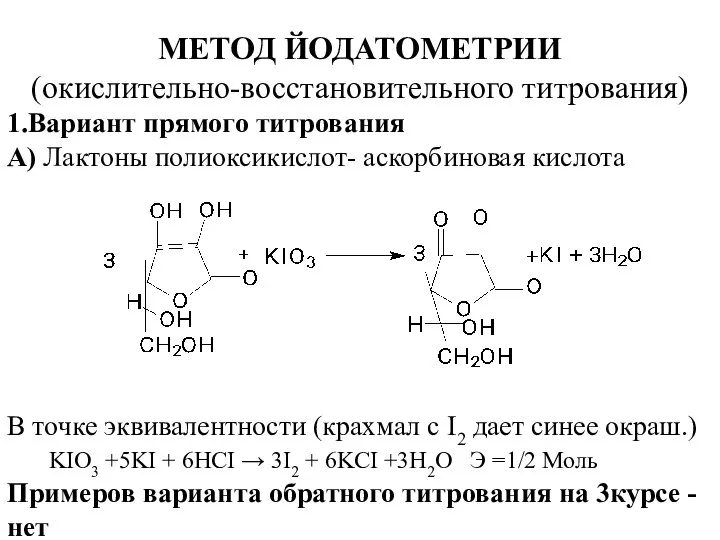
- 9. МЕТОД ЙОДАТОМЕТРИИ (окислительно-восстановительного титрования) 1.Вариант прямого титрования А) Лактоны полиоксикислот- аскорбиновая кислота В точке эквивалентности (крахмал
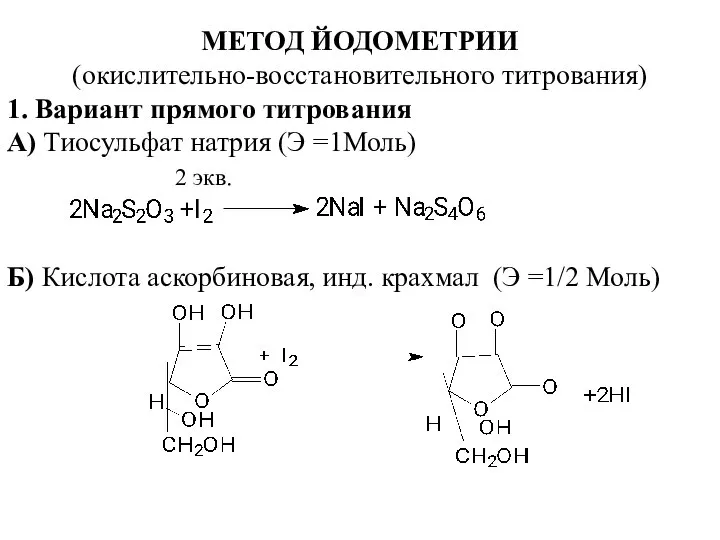
- 10. МЕТОД ЙОДОМЕТРИИ (окислительно-восстановительного титрования) 1. Вариант прямого титрования А) Тиосульфат натрия (Э =1Моль) 2 экв. Б)
- 11. 2. Вариант обратного титрования А) Альдегидопроизводные ЛВ, окисление в щелочной среде (формальдегид, хлоралгидрат в среде NaOH,
- 12. В) Вариант обратного титрования для органических оснований: первичных –норадреналин, вторичных –эфедрин и др. арилалкиламины, третичных –димедрол,
- 13. Д) Алифатические серосодержащие аминокислоты (цистеин, метионин), окисление по R-SH или R-S-R1 Цистеин, Э = 1 Моль
- 14. 3. Вариант косвенного титрования Меди сульфат, выделившийся йод титруют натрия тиосульфатом, восстановление меди(II) до меди(I), Э
- 15. МЕТОД ЙОДХЛОРМЕТРИИ Вариант обратного титрования А) Реакция Se – ЛВ фенолов (резорцин и др.), ароматических перв.
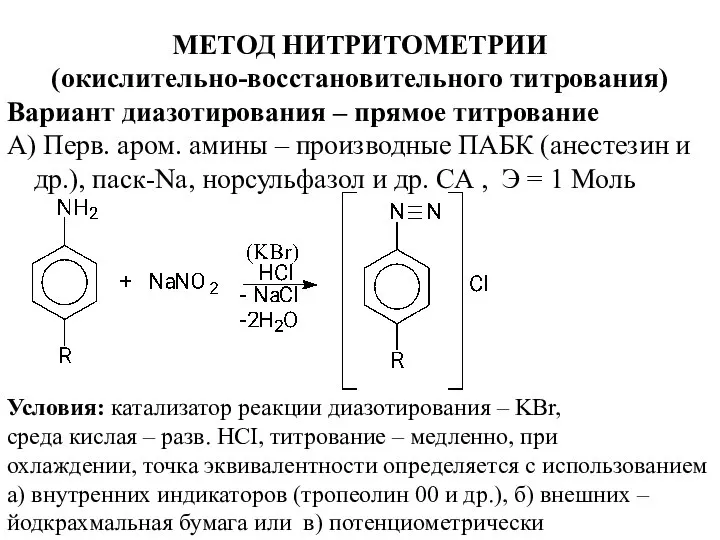
- 16. МЕТОД НИТРИТОМЕТРИИ (окислительно-восстановительного титрования) Вариант диазотирования – прямое титрование А) Перв. аром. амины – производные ПАБК
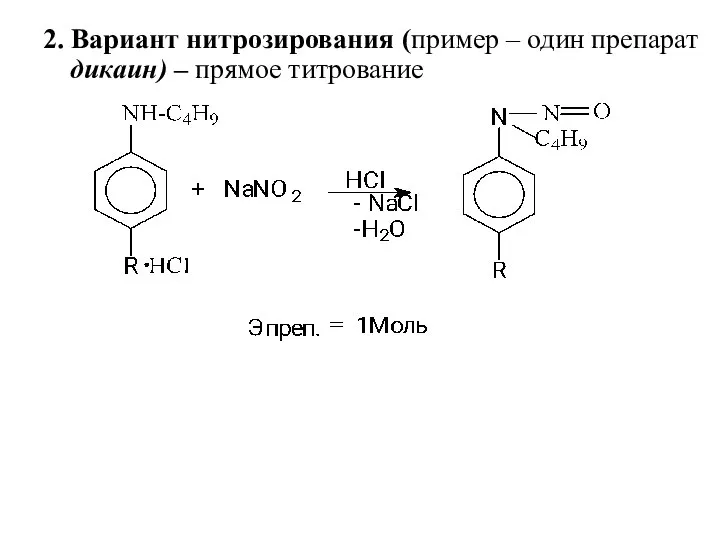
- 17. 2. Вариант нитрозирования (пример – один препарат дикаин) – прямое титрование
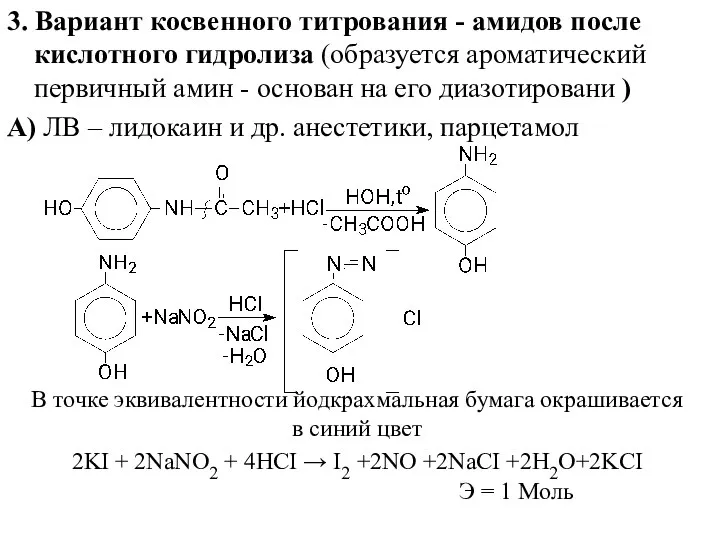
- 18. 3. Вариант косвенного титрования - амидов после кислотного гидролиза (образуется ароматический первичный амин - основан на
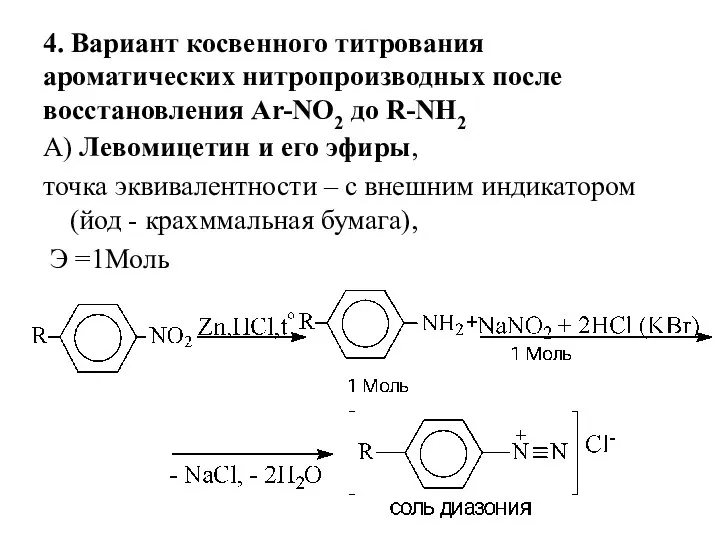
- 19. 4. Вариант косвенного титрования ароматических нитропроизводных после восстановления Ar-NO2 до R-NH2 А) Левомицетин и его эфиры,
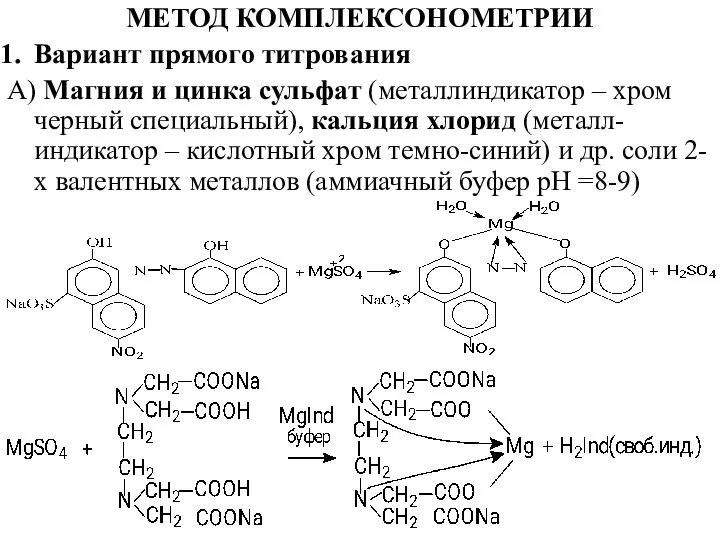
- 20. МЕТОД КОМПЛЕКСОНОМЕТРИИ Вариант прямого титрования А) Магния и цинка сульфат (металлиндикатор – хром черный специальный), кальция
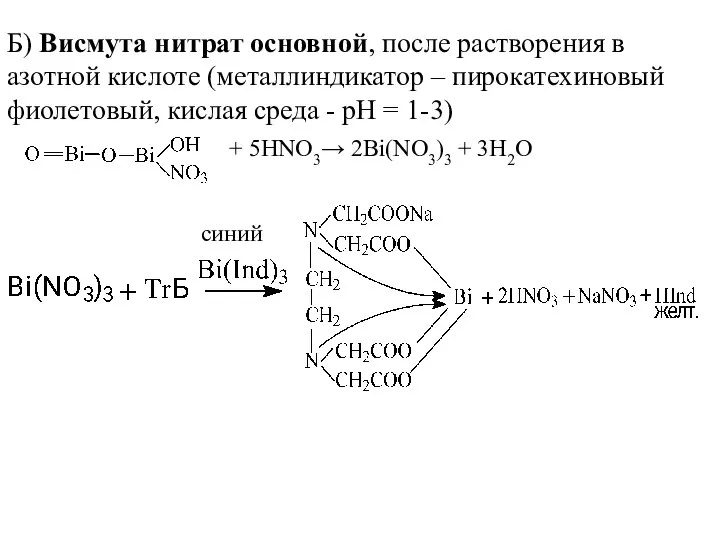
- 21. Б) Висмута нитрат основной, после растворения в азотной кислоте (металлиндикатор – пирокатехиновый фиолетовый, кислая среда -
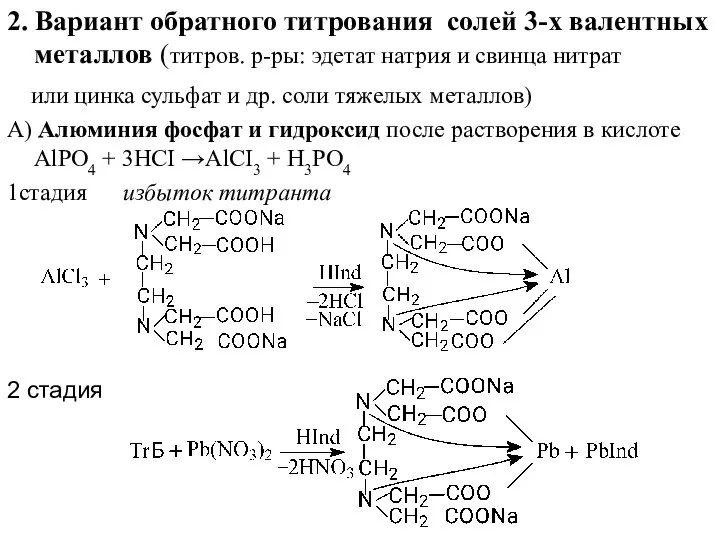
- 22. 2. Вариант обратного титрования солей 3-х валентных металлов (титров. р-ры: эдетат натрия и свинца нитрат или
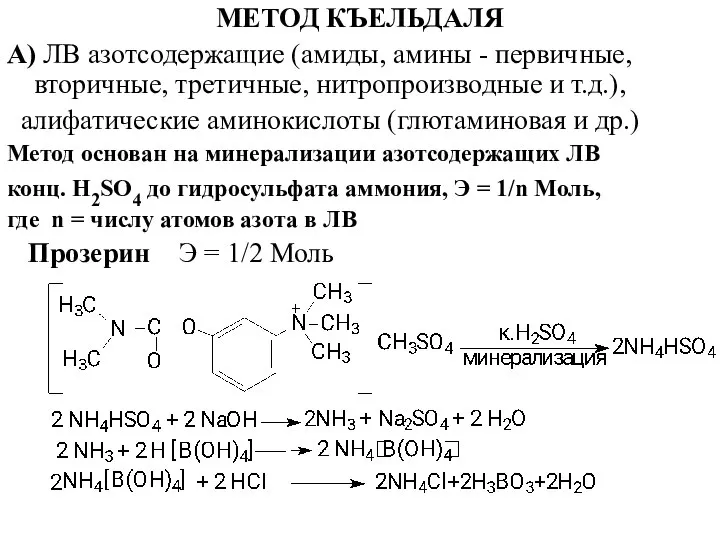
- 23. МЕТОД КЪЕЛЬДАЛЯ А) ЛВ азотсодержащие (амиды, амины - первичные, вторичные, третичные, нитропроизводные и т.д.), алифатические аминокислоты
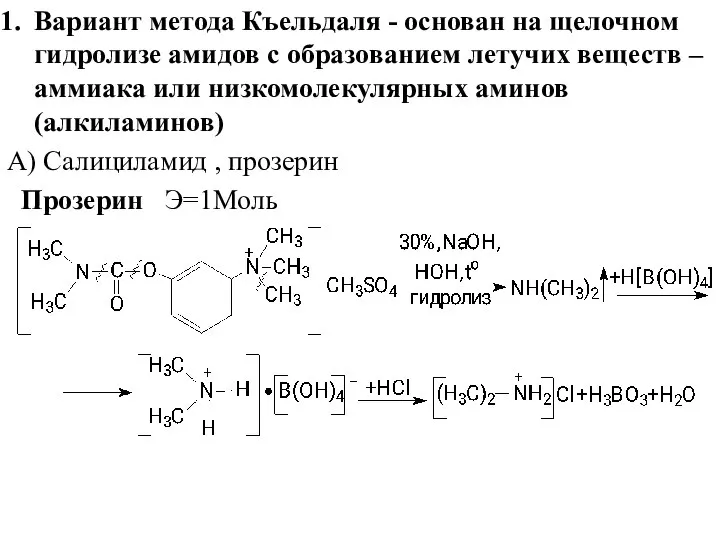
- 24. Вариант метода Къельдаля - основан на щелочном гидролизе амидов с образованием летучих веществ – аммиака или
- 25. МЕТОД МЕРКУРИМЕТРИИ (осадительного титрования) А) Неорг. ЛВ – галогениды щелочных металлов (натрия и калия хлориды, йодиды,
- 27. Скачать презентацию








 Основы технологии оклейки стен обоями
Основы технологии оклейки стен обоями По статистике* женщины с маленькой грудью 18 раз в день думают, что большая грудь позволит им найти любимого. - презентация
По статистике* женщины с маленькой грудью 18 раз в день думают, что большая грудь позволит им найти любимого. - презентация Литературная викторина Автор презентации Клюквина В А
Литературная викторина Автор презентации Клюквина В А Свойства некоторых аналоговых фильтров
Свойства некоторых аналоговых фильтров  Types of houses
Types of houses Визуальная система программирования Delphi. Язык программирования Object Pascal
Визуальная система программирования Delphi. Язык программирования Object Pascal СМИ в избирательных процессах
СМИ в избирательных процессах Как выбрать подрядчика по контекстной рекламе: преимущества и недостатки самостоятельного ведения
Как выбрать подрядчика по контекстной рекламе: преимущества и недостатки самостоятельного ведения  Грех и его трактовка в разных религиях
Грех и его трактовка в разных религиях Взаимное положение прямых
Взаимное положение прямых Презентация Жизнь и творчество И.С, Баха
Презентация Жизнь и творчество И.С, Баха А. Т. Аверченко 1881-1925
А. Т. Аверченко 1881-1925 Личное и групповое туристское снаряжение и уход за ним. Индивидуальный и групповой ремонтный набор
Личное и групповое туристское снаряжение и уход за ним. Индивидуальный и групповой ремонтный набор Экскурсия по Афинам
Экскурсия по Афинам INTEL - INTegrated circuits and ELectronics
INTEL - INTegrated circuits and ELectronics Расчет системы охлаждения
Расчет системы охлаждения  Периодизация развития художественной культуры. Стили эпохи
Периодизация развития художественной культуры. Стили эпохи Беседа по картине В.М. Васнецова «Богатыри» Автор: Сосновцева Валентина Николаевна – учитель начальных классов МОУ «СОШ с. Елшанк
Беседа по картине В.М. Васнецова «Богатыри» Автор: Сосновцева Валентина Николаевна – учитель начальных классов МОУ «СОШ с. Елшанк «Роль характера взаимоотношений между родителями и детьми в развитии личности ребенка»
«Роль характера взаимоотношений между родителями и детьми в развитии личности ребенка» Разработка сетевых приложений
Разработка сетевых приложений Исследование развития скоростных способностей у школьников 13-14 лет на уроках баскетбола
Исследование развития скоростных способностей у школьников 13-14 лет на уроках баскетбола Построение топографического плана по результатам нивелирования по квадратам
Построение топографического плана по результатам нивелирования по квадратам УЧЕТ РАСХОДОВ ПО СТРОИТЕЛЬНЫМ МАШИНАМ И МЕХАНИЗМАМ
УЧЕТ РАСХОДОВ ПО СТРОИТЕЛЬНЫМ МАШИНАМ И МЕХАНИЗМАМ Личность педагога в современной школе Личность воспитателя значит все в деле воспитания К.Д Уш
Личность педагога в современной школе Личность воспитателя значит все в деле воспитания К.Д Уш Презентация "1 ВВЕДЕНИЕ В МАКРОЭКОНОМИКУ" - скачать презентации по Экономике
Презентация "1 ВВЕДЕНИЕ В МАКРОЭКОНОМИКУ" - скачать презентации по Экономике Семейное увлечение хоккей
Семейное увлечение хоккей Traditions and holidays of Great Britain
Traditions and holidays of Great Britain Полезные ископаемые Презентацию подготовила Сковородина Елена Павловна, учитель начальны
Полезные ископаемые Презентацию подготовила Сковородина Елена Павловна, учитель начальны