Содержание
- 2. Химическая связь и межмолекулярное взаимодействие Квантовая механика описывает свойства многоэлектронных систем и их взаимодействия c помощью
- 3. Важную роль в теории химической связи играет анализ электронной плотности, анализ особенностей которой и позволяет разделить
- 4. Орбитальная картина химической связи Конструктивная и деструктивная интерференция орбиталей Образование химической связи происходит в результате электростатического
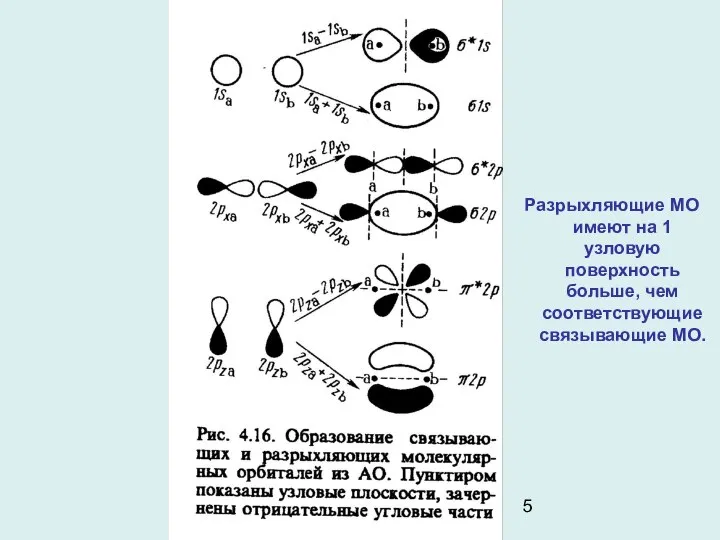
- 5. Разрыхляющие МО имеют на 1 узловую поверхность больше, чем соответствующие связывающие МО.
- 6. Несвязывающие МО формируются преимущественно из орбиталей атомного характера: эти орбитали описывают, например, остовные электроны и неподеленные
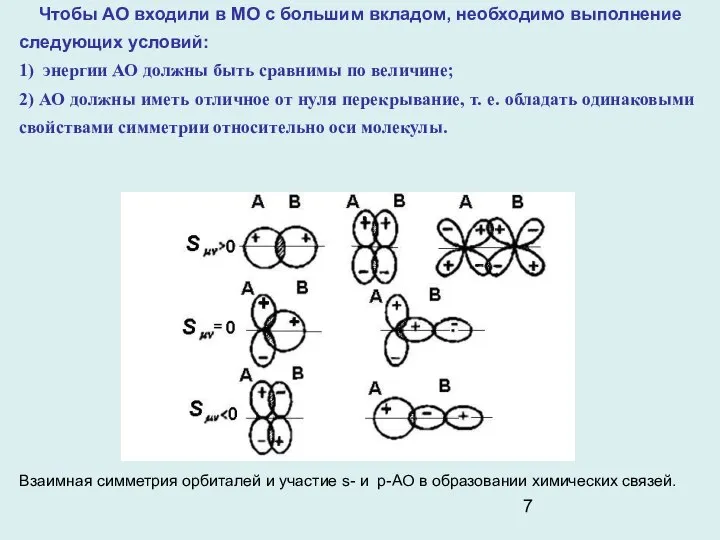
- 7. Чтобы АО входили в МО с большим вкладом, необходимо выполнение следующих условий: 1) энергии АО должны
- 8. Рассмотрим основные качественные закономерности электронного строения двухатомных молекул первого периода. Классификация и обозначения МО гомоядерных молекул.
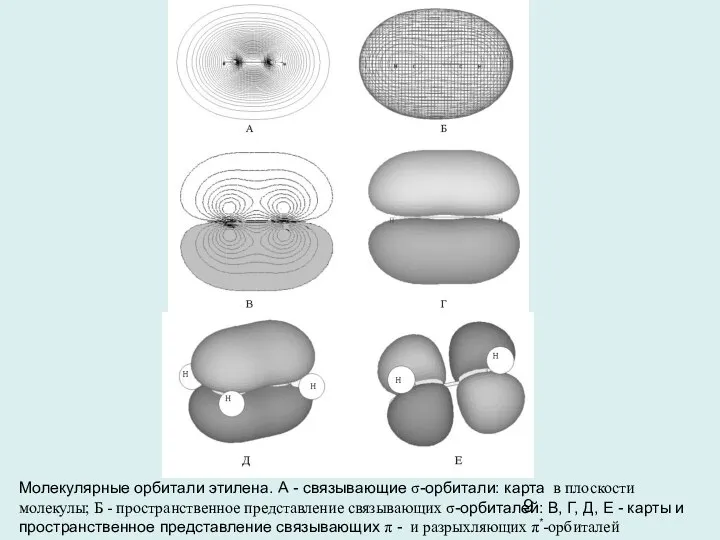
- 9. Молекулярные орбитали этилена. А - связывающие σ-орбитали: карта в плоскости молекулы; Б - пространственное представление связывающих
- 10. Характеристики молекулярных орбиталей гомоядерных молекул, построенные из 1s-, 2s- и 2p-атомных орбиталей
- 11. МО, симметричные относительно отражения в плоскости молекулы, называют σ-орбиталями, антисимметричные относительно такого отражения МО называют π-орбиталями.
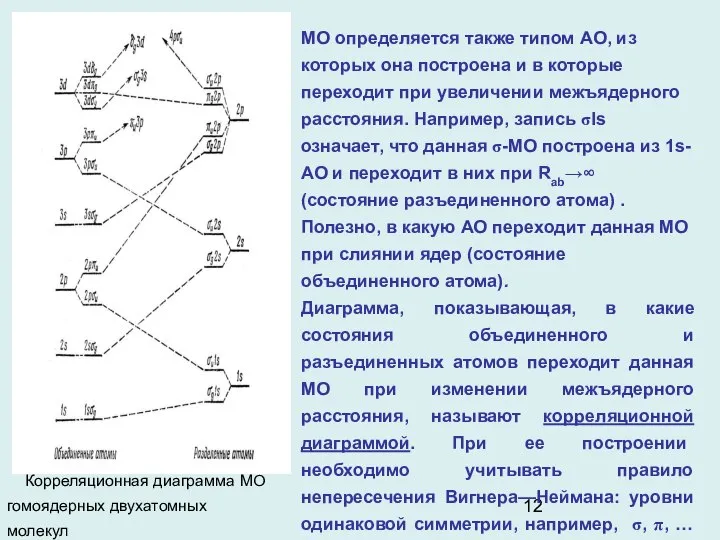
- 12. МО определяется также типом АО, из которых она построена и в которые переходит при увеличении межъядерного
- 13. Расчеты и молекулярная спектроскопия дают следующий порядок энергий МО для двухатомных молекул, построенных из атомов первого
- 14. Молекула Не2 (σls)2(σ*ls)2 имеет 2 связывающих и 2 разрыхляющих электрона, которые в сумме формально не дают
- 15. Молекула C2 (σls)2(σ*ls)2(σ2s)2(σ*2s)2(π2р)4(πz2р) характеризуется двойной связью. Энергии π2р- и σ2р-МО близки по величине, однако именно такая
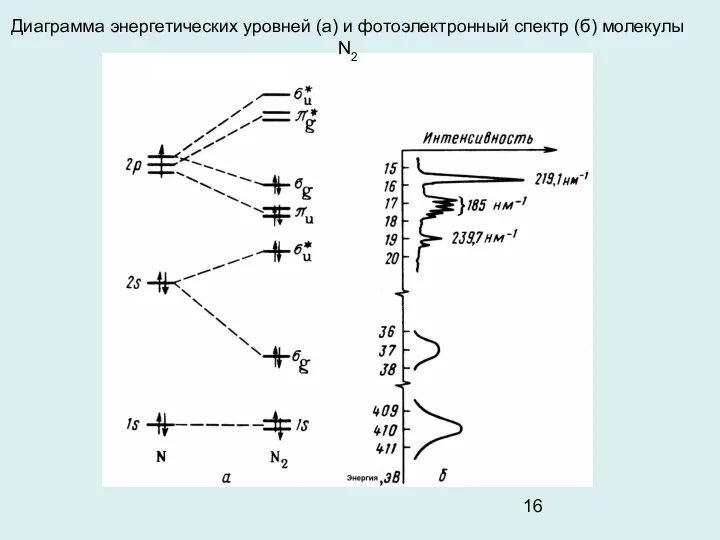
- 16. Диаграмма энергетических уровней (а) и фотоэлектронный спектр (б) молекулы N2
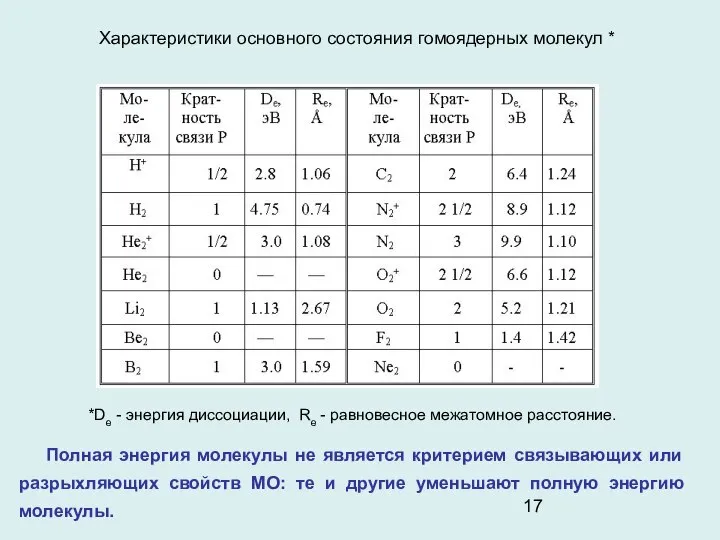
- 17. Характеристики основного состояния гомоядерных молекул * *De - энергия диссоциации, Re - равновесное межатомное расстояние. Полная
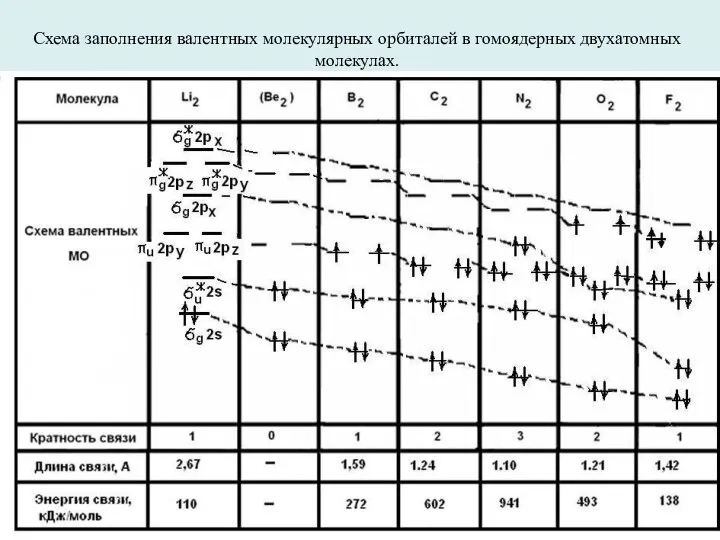
- 18. Схема заполнения валентных молекулярных орбиталей в гомоядерных двухатомных молекулах.
- 19. Электронные конфигурации гетероядерных молекул типа АВ Молекула LiH – простейшее гетероатомное соединение с энергией связи, лежащей
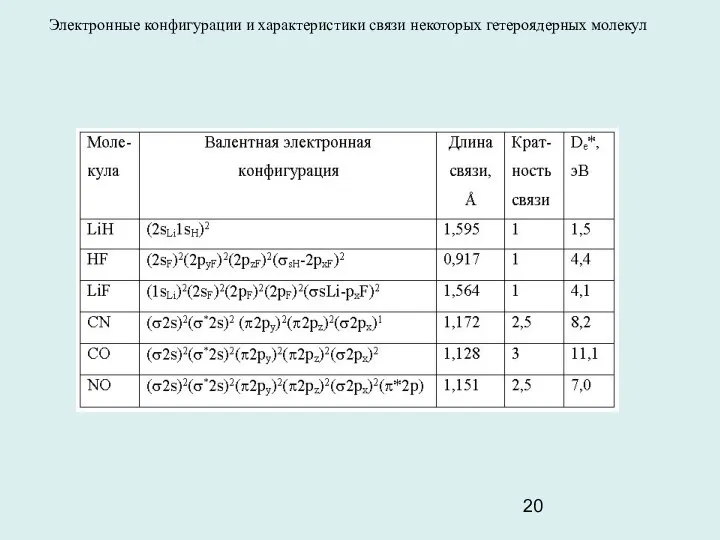
- 20. Электронные конфигурации и характеристики связи некоторых гетероядерных молекул
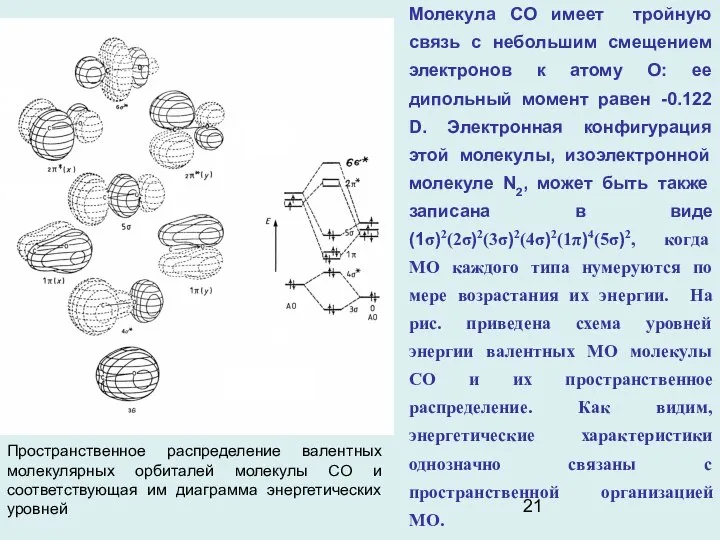
- 21. Молекула СО имеет тройную связь с небольшим смещением электронов к атому О: ее дипольный момент равен
- 22. Анализ заселенностей орбиталей по Малликену Понятие о порядках связей и зарядах Как количественно оценить вклады различных
- 23. Интегрируя левую и правую части, имеем: I≠J (интеграл перекрывания Sαβ(I,J)=1, если α=β, I=J). Полное число электронов
- 24. Полная межатомная электронная заселенность связи qIJ = 2Рαβ(I,J)Sαβ(I,J), α∈Ι, β∈J. характеризует прочность связи между парами атомов
- 26. Скачать презентацию














 SMM-агентство «ЕстьИдея»
SMM-агентство «ЕстьИдея» Успенский Трифонов монастырь
Успенский Трифонов монастырь Renaissax Hotel Dresden
Renaissax Hotel Dresden Презентация "Мы рисуем сказочную птицу" - скачать презентации по МХК
Презентация "Мы рисуем сказочную птицу" - скачать презентации по МХК Теория разделения властей в современной России
Теория разделения властей в современной России Выполнение гендерной роли. Каюмова
Выполнение гендерной роли. Каюмова Системы моделирования_02
Системы моделирования_02 London 2012
London 2012 АДМИНИСТРАЦИЯ ГОРОДА БЕРЕЗНИКИ Отчет о результатах деятельности администрации города Березники за 2012 год Глава города Березн
АДМИНИСТРАЦИЯ ГОРОДА БЕРЕЗНИКИ Отчет о результатах деятельности администрации города Березники за 2012 год Глава города Березн Требования к предприятиям общественного питания
Требования к предприятиям общественного питания Величайшее изобретение человечества
Величайшее изобретение человечества ВандюковГалееваДолгашевПрезентация
ВандюковГалееваДолгашевПрезентация Планирование ремонтно-строительного производства при реконструкции и капитальном ремонте
Планирование ремонтно-строительного производства при реконструкции и капитальном ремонте Описание картины И.К. Айвазовского «Девятый вал»
Описание картины И.К. Айвазовского «Девятый вал» Педагогическая психология
Педагогическая психология  Принципы духовно-нравственного воспитания. Школа православного вожатого
Принципы духовно-нравственного воспитания. Школа православного вожатого Таточенко лекция
Таточенко лекция Патофизиология опухолевого роста
Патофизиология опухолевого роста Патология белой крови
Патология белой крови Машина бөлшектері мен тораптарын есептеудің және жобалаудың жалпы сұрақтары
Машина бөлшектері мен тораптарын есептеудің және жобалаудың жалпы сұрақтары Стандарти обслуговування
Стандарти обслуговування Физминутки для ребят
Физминутки для ребят Что такое права человека?
Что такое права человека? Устное народное творчество
Устное народное творчество Тема 4 Основы и социальная сущность бизнеса
Тема 4 Основы и социальная сущность бизнеса  Правовое обеспечение профессиональной деятельности
Правовое обеспечение профессиональной деятельности Устройство пароконвектомата
Устройство пароконвектомата Математические диктанты 4класс Учитель: Юмашева О.М.
Математические диктанты 4класс Учитель: Юмашева О.М.