Феноменологическая термодинамика Энтропия и ее статистический смысл. Критическая изотерма. Эффект Джоуля-Томсона. (Лекция 12)
Содержание
- 2. Содержание предыдущей лекции Феноменологическая термодинамика Термодинамическое равновесие и температура. Внутренняя энергия. Закон равномерного распределения энергии по
- 3. Контрольный вопрос Теплоемкость одноатомного газа при повышении температуры: а) растет, б) не изменяется, в) понижается, г)
- 4. Содержание сегодняшней лекции Феноменологическая термодинамика Энтропия и ее статистический смысл. Энтропия как количественная мера хаотичности. Второе
- 5. Энтропия и ее статистический смысл Теплопередача от более нагретого тела к менее нагретому – выравнивание температур.
- 6. Энтропия и ее статистический смысл Закрытый сосуд: стремление к более равномерному распределению молекул – переход от
- 7. Энтропия и ее статистический смысл Направленность всех процессов во Вселенной к беспорядку. Стремление изолированной системы перейти
- 8. Энтропия и ее статистический смысл Макросостояние системы – одна из возможных реализаций совокупности микросостояний системы, описываемое
- 9. Энтропия и ее статистический смысл Предположение: равновероятность реализации различных микросостояний в изолированной системе. Эксперимент: вероятность реализации
- 10. Энтропия и ее статистический смысл Возможность реализации конкретного макросостояния различными способами, каждому из которых соответствует некоторое
- 11. Второе начало термодинамики - (закон возрастания энтропии): энтропия изолированной системы может либо только возрастать, либо по
- 12. Второе начало термодинамики Обратимый процесс: энтропия постоянна (dS = 0) → S = const. Необратимый процесс:
- 13. Теорема Нернста (третье начало термодинамики) Упорядоченное или неслучайное состояние – состояние, осуществляемое небольшим числом способов. Энтропия
- 14. Энтропия как количественная мера хаотичности Использование понятия «энтропия» для определения направленности процессов в природе.
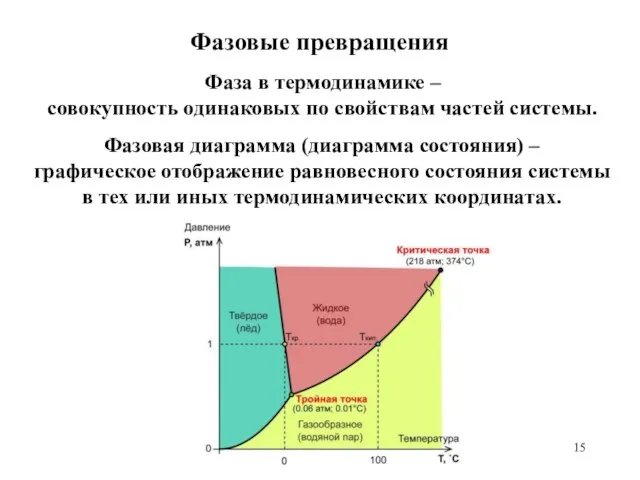
- 15. Фазовые превращения Фаза в термодинамике – совокупность одинаковых по свойствам частей системы. Фазовая диаграмма (диаграмма состояния)
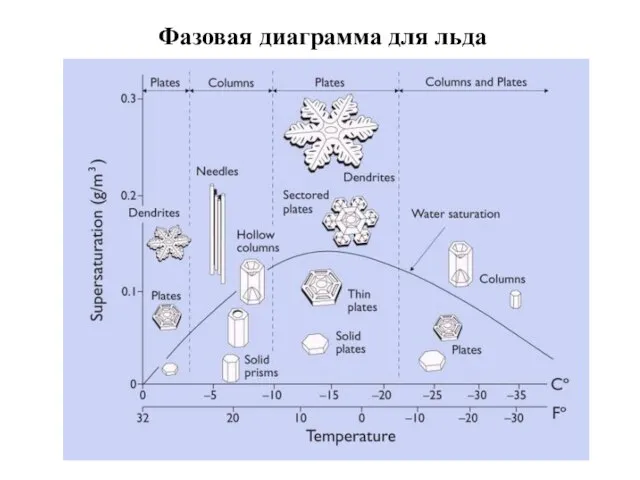
- 16. Фазовая диаграмма для льда
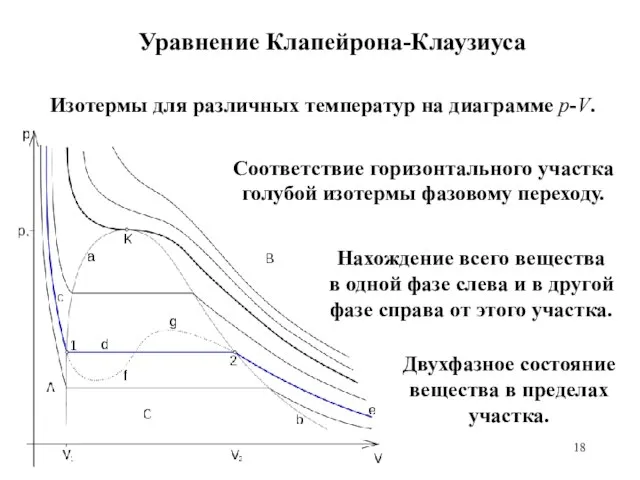
- 17. Уравнение Клапейрона-Клаузиуса Уравнение Клапейрона-Клаузиуса – термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной
- 18. Уравнение Клапейрона-Клаузиуса Изотермы для различных температур на диаграмме p-V. Соответствие горизонтального участка голубой изотермы фазовому переходу.
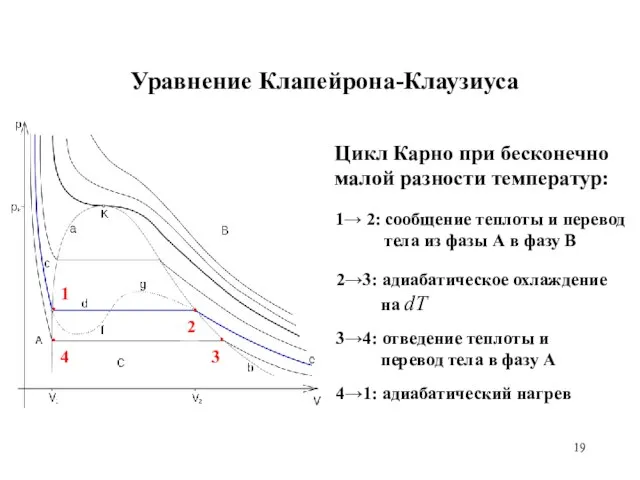
- 19. Уравнение Клапейрона-Клаузиуса 2→3: адиабатическое охлаждение на dT Цикл Карно при бесконечно малой разности температур: 1→ 2:
- 20. Уравнение Клапейрона-Клаузиуса
- 21. Уравнение Клапейрона-Клаузиуса уравнение Клапейрона-Клаузиуса, описывающее зависимость равновесного давления от температуры для однокомпонентной системы, состоящей из двух
- 22. Реальные газы Повышение давления и понижение температуры – увеличение плотности реального газа. Необходимость введения поправок и
- 23. Реальные газы p – давление, оказываемое на газ извне (равное давлению газа на стенки сосуда), a
- 24. Реальные газы Связь поправки Vм c объемом, занимаемым самими молекулами.
- 25. Критическая изотерма Ван-дер-Ваальсовский газ – воображаемый газ, точно подчиняющийся уравнению Ван-дер-Ваальса. Уравнения изотерм для Ван-дер-Ваальсовского газа
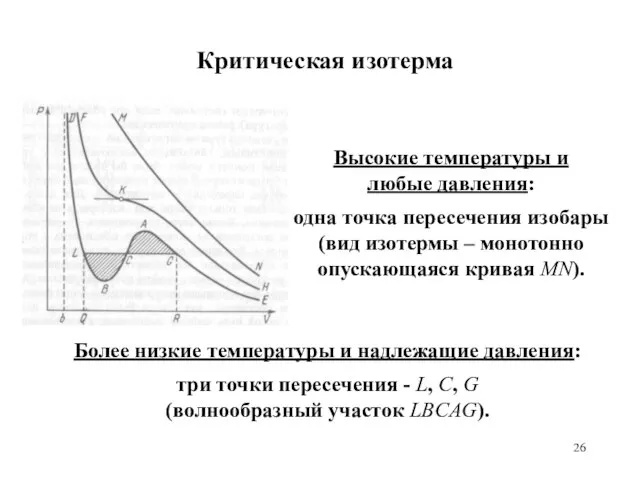
- 26. Критическая изотерма Высокие температуры и любые давления: одна точка пересечения изобары (вид изотермы – монотонно опускающаяся
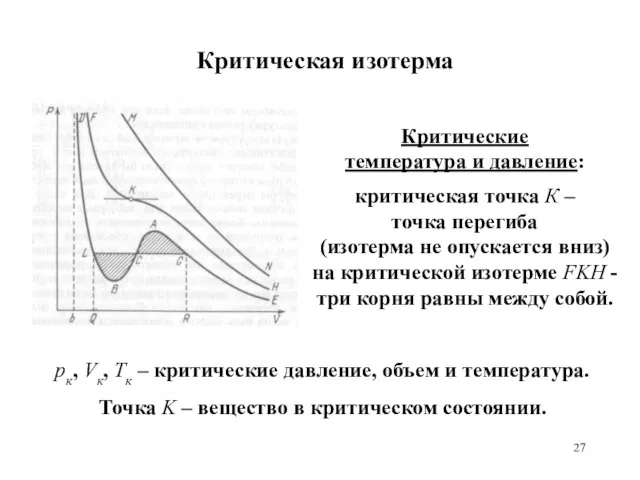
- 27. Критическая изотерма Критические температура и давление: критическая точка К – точка перегиба (изотерма не опускается вниз)
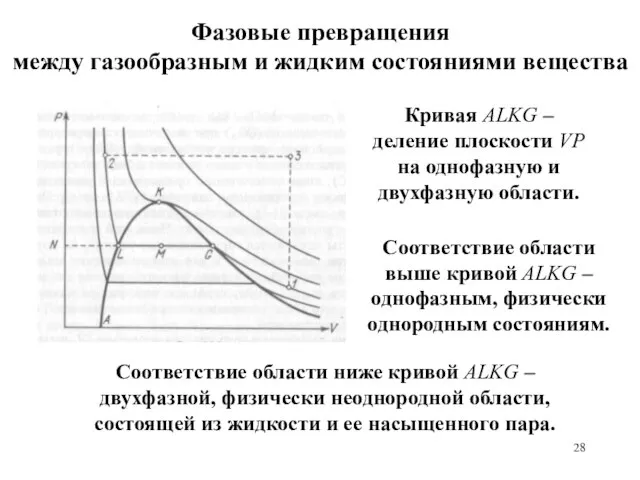
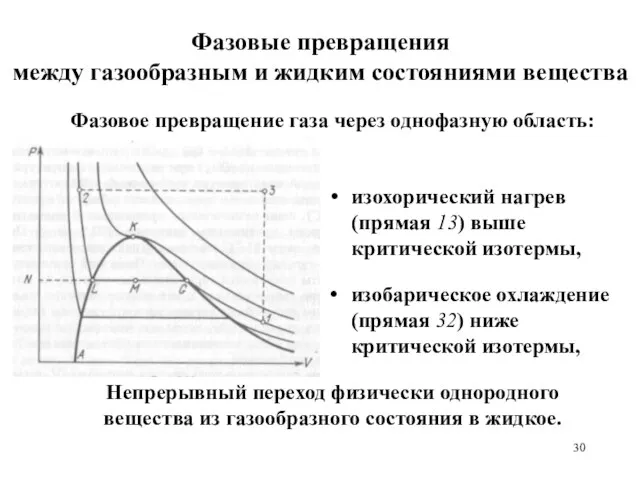
- 28. Фазовые превращения между газообразным и жидким состояниями вещества Кривая АLKG – деление плоскости VP на однофазную
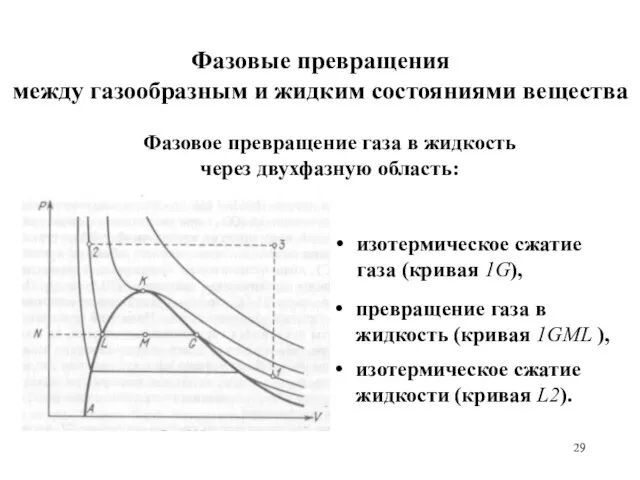
- 29. Фазовые превращения между газообразным и жидким состояниями вещества изотермическое сжатие газа (кривая 1G), превращение газа в
- 30. Фазовые превращения между газообразным и жидким состояниями вещества изохорический нагрев (прямая 13) выше критической изотермы, изобарическое
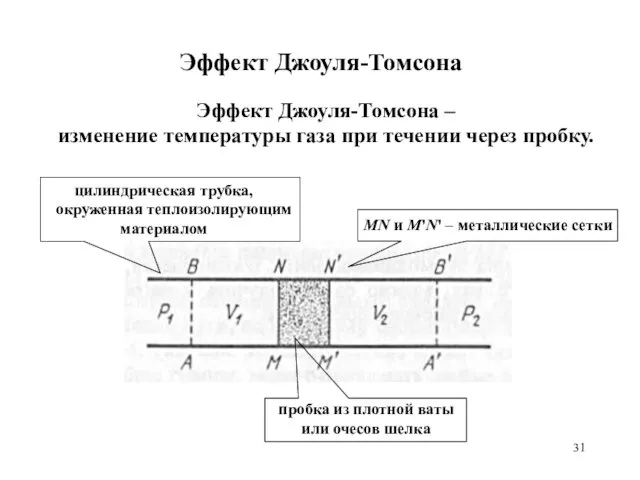
- 31. Эффект Джоуля-Томсона MN и M'N' – металлические сетки пробка из плотной ваты или очесов шелка Эффект
- 32. Эффект Джоуля-Томсона Ламинарное и медленное течение газа через пробку под действием разности давлений p1 и p2.
- 33. Эффект Джоуля-Томсона V1 – объем пространства ABNM, занимаемый газом до прохождения через пробку, V2 – объем
- 34. Эффект Джоуля-Томсона p1·S·AM = p1V1 – работа, совершаемая над газом, при перемещении границы АВ в положение
- 35. Эффект Джоуля-Томсона Неизменность физического состояния пробки и ее внутренней энергии. 1-ое начало термодинамики для системы: U2
- 36. Эффект Джоуля-Томсона Энтальпия – функция состояния, приращение которой при изобарическом процессе дает теплоту, полученную системой. U2
- 37. Эффект Джоуля-Томсона Вывод: внутренняя энергия идеального газа не зависит от занимаемого им объема. Эксперимент Джоуля-Томпсона: тем
- 39. Скачать презентацию


























 Майкл Фарадей
Майкл Фарадей Тепломассообмен. Основы теории массообмена. (Лекция 16)
Тепломассообмен. Основы теории массообмена. (Лекция 16) Обнаружение магнитного поля по его действию на электрический ток. Правило левой руки
Обнаружение магнитного поля по его действию на электрический ток. Правило левой руки Плавание судов
Плавание судов Методические рекомендации при проведении эксперимента для подготовки к ОГЭ по физике
Методические рекомендации при проведении эксперимента для подготовки к ОГЭ по физике Передача давления жидкостями и газами. Закон Паскаля
Передача давления жидкостями и газами. Закон Паскаля Импульс и энергия. (Energy & Momentum)
Импульс и энергия. (Energy & Momentum) Шкала, первый импульс и N-формация
Шкала, первый импульс и N-формация Работа с текстом. Электрический ток в цепи
Работа с текстом. Электрический ток в цепи Плавание тел. Учитель физики МБОУ «Краснохолмская сош №2 им.С.Забавина»: Даузе М.Г.
Плавание тел. Учитель физики МБОУ «Краснохолмская сош №2 им.С.Забавина»: Даузе М.Г. Механика твердого тела. (Лекция 4)
Механика твердого тела. (Лекция 4) Квантовые эффекты в нелинейных системах
Квантовые эффекты в нелинейных системах ЦВЕТ ПРОЗРАЧНЫХ И НЕПРОЗРАЧНЫХ ТЕЛ Журкин Алексей Хайбулаев Султан
ЦВЕТ ПРОЗРАЧНЫХ И НЕПРОЗРАЧНЫХ ТЕЛ Журкин Алексей Хайбулаев Султан Презентация Тепловые электростанции
Презентация Тепловые электростанции  Деревянные балки. лекция № 0
Деревянные балки. лекция № 0 Возможно ли превысить скорость света?
Возможно ли превысить скорость света? Физика - наука о природе
Физика - наука о природе Презентация Механические колебания 11 класс
Презентация Механические колебания 11 класс  Моделирование физики в играх
Моделирование физики в играх Зубчатые передачи
Зубчатые передачи Ф и з и к а 9 класс Материалы к уроку по теме «Механические волны» Учитель физики Тюменцева С. А. МОУ «Варгашин
Ф и з и к а 9 класс Материалы к уроку по теме «Механические волны» Учитель физики Тюменцева С. А. МОУ «Варгашин Фізика в житті тварин
Фізика в житті тварин Сұйықтықтардың ламинарлы қозғалысы
Сұйықтықтардың ламинарлы қозғалысы Явление тяготения. Сила тяжести 7 класс
Явление тяготения. Сила тяжести 7 класс Сучасні джерела живлення для електронних пристроїв. Створення різноманітних джерел живлення
Сучасні джерела живлення для електронних пристроїв. Створення різноманітних джерел живлення Уравновешивание восьмицилиндровых двигателей
Уравновешивание восьмицилиндровых двигателей Динамика сооружений. Основные понятия. Динамические нагрузки. Методы расчета
Динамика сооружений. Основные понятия. Динамические нагрузки. Методы расчета Презентация по физике Задача на применение кинетической энергии
Презентация по физике Задача на применение кинетической энергии