Содержание
- 2. Уравнение состояния идеального газа Основное уравнение МКТ: Р = nkT Оно-же - уравнение Менделеева-Клапейрона: РV =
- 3. Число степеней свободы и способов накопления энергии многоатомной молекулы
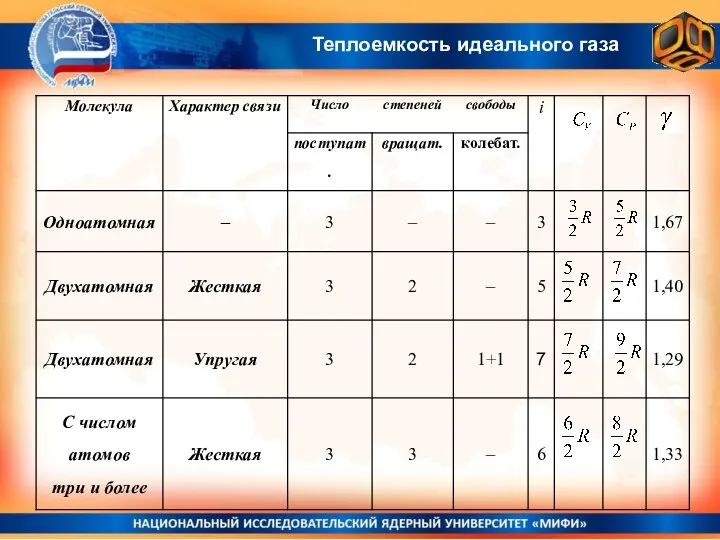
- 4. Равнораспределение энергии по степеням свободы Основное допущение статистической термодинамики: огромное числа хаотических соударений и обменов энергией
- 5. Равнораспределение энергии по степеням свободы На каждую «степень свободы» i приходится энергия kT/2 Средняя энергия одной
- 6. Чтобы нагреть тело массы m от температуры Т1 до температуры Т1+dT надо передать ему количество теплоты
- 7. dQ = dU + dAгаза = ivRdT/2 + PdV cμ = dQ/vdT = iR/2 + PdV/vdT;
- 8. Теплоемкость идеального газа
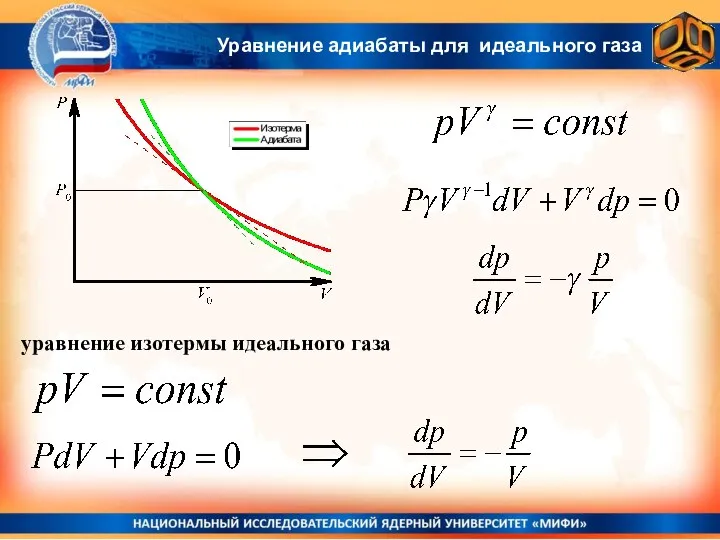
- 9. Уравнение адиабаты для идеального газа Уравнение адиабаты для идеального газа
- 10. Адиабатическим называется процесс, который происходит без теплообмена с окружающей средой Уравнение адиабаты для идеального газа dQ
- 11. Адиабатическим называется процесс, который происходит без теплообмена с окружающей средой Уравнение адиабаты для идеального газа уравнение
- 12. уравнение изотермы идеального газа Уравнение адиабаты для идеального газа
- 13. Уравнение политропы для идеального газа Уравнение политропы для идеального газа
- 14. Политропный процесс Также остается постоянной комбинация параметров PVn = Сonst, где число n называется показателем политропы.
- 15. Политропный процесс cμ (n) = dQ/dT = R(i/2 +1/(1-n)) = сV - R/(n-1) Проверим: n =
- 16. CV = iR/2 PVn= Const Политропный процесс
- 17. Политропный процесс
- 18. при изотермическом процессе: при изобарном процессе: при изохорном процессе: при адиабатическом процессе: Разные процессы – работа
- 19. Энтропия в термоднамике Энтропия в термодинамике
- 20. ВСПОМНИМ! Газы в макроскопических количествах состоят из огромного числа молекул. Для практического описания состояний газов, близких
- 21. Энтропия в термодинамике TdS = dQ = dU + dA = (ivR/2)dT + PdV Энтропия появилась
- 22. В расчете на один моль вещества приращение энтропии составляет: dS = (iR/2)(dT/T) + (P/T)dV = (iR/2)(dT/T)
- 23. Уравнение состояния идеального газа PV = vRT позволяет переписать выражение для энтропии через разные параметры S=
- 24. Энтропия и внутренняя энергия Поскольку U = ivRT/2 , энтропию можно выразить, например, через объем V
- 25. Полный дифференциал энтропии как функции внутренней энергии и объема: По определению энтропии и из первого начала
- 26. T1 T2 Энтропия и термодинамика ПРИМЕР: теплообмен между двумя частями теплоизолированного сосуда Тепло (внутренняя энергия) передается
- 27. ЕЩЕ ПРИМЕР: Смешивание разных газов в теплоизолированном сосуде Ничего не изменилось – v, V, T, P
- 28. И ЕЩЕ ПРИМЕР: Расширение идеального газа в пустоту в теплоизолированном сосуде. V растёт S растёт Неравенство
- 29. 2. Нельзя осуществить процесс, единственным конечным результатом которого будет превращение некоторого количества теплоты полностью в работу
- 30. Предоставленная сама себе, система ВСЕГДА переходит из более упорядоченного в менее упорядоченное (и оттого более вероятное)
- 31. Первый закон термодинамики (закон сохранения энергии) – запрещает возможность извлечения энергии из ничего. Вечный двигатель первого
- 32. Демон Максвелла сортирует «горячие» и «холодные» молекулы, что позволяет нагреть правую часть сосуда и охладить левую
- 33. Тепловые машины Курс общей физики НИЯУ МИФИ
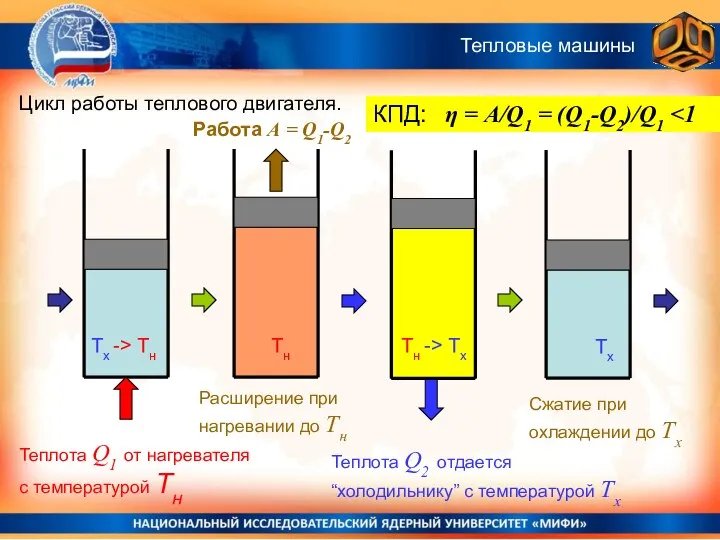
- 34. Тепловая машина (двигатель) = устройство, совершающее механическую работу за счёт теплоты, получаемой от внешних источников. Тепловой
- 35. Цикл работы теплового двигателя. Работа А = Q1-Q2 Теплота Q1 от нагревателя с температурой Тн Тх
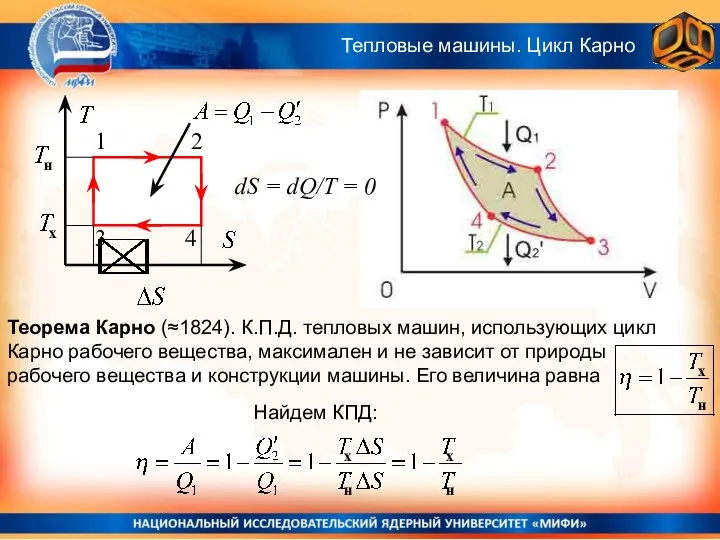
- 36. Цикл Карно идеального газа Тепловые машины. Цикл Карно Цикл Карно − это обратимый цикл, состоящий из
- 37. Теорема Карно (≈1824). К.П.Д. тепловых машин, использующих цикл Карно рабочего вещества, максимален и не зависит от
- 38. Теорема Карно (≈1824). К.П.Д. тепловых машин, использующих цикл Карно рабочего вещества, максимален. Как доказать это? Простейший
- 39. Здесь 1 − полученная за цикл теплота; 2 − отданная за цикл теплота. Тепловые машины. Цикл
- 41. Скачать презентацию


































 Проектирование троллейбусной сети в зоне высоковольтной линии электропередач
Проектирование троллейбусной сети в зоне высоковольтной линии электропередач Термоэлектрический генератор на основе эффекта Зеебека
Термоэлектрический генератор на основе эффекта Зеебека Аттестационная работа. Программа курса для 5 класса «Естествознание с элементами физики и астрономии»
Аттестационная работа. Программа курса для 5 класса «Естествознание с элементами физики и астрономии» Задача на расчет архимедовой силы
Задача на расчет архимедовой силы Сложные и нестандартные задачи ЕГЭ по физике
Сложные и нестандартные задачи ЕГЭ по физике Аттестационная работа. Оценка метапредметных результатов учащихся 8 класса при организации проектной деятельности
Аттестационная работа. Оценка метапредметных результатов учащихся 8 класса при организации проектной деятельности Внешний фотоэффект. Эффект Комптона
Внешний фотоэффект. Эффект Комптона Электромагнитные волны
Электромагнитные волны Механические волны. Звук. (Лекция 2)
Механические волны. Звук. (Лекция 2) Принцип работы ультразвуковых дефектоскопов
Принцип работы ультразвуковых дефектоскопов Движение под действием нескольких сил. Алгоритм решения задач
Движение под действием нескольких сил. Алгоритм решения задач Спектроскоп. Спектр түрлері
Спектроскоп. Спектр түрлері Нанотехнологии и науки о материалах
Нанотехнологии и науки о материалах Синтез комбинационных устройств
Синтез комбинационных устройств Электричество и магнетизм. (Лекция 2-1)
Электричество и магнетизм. (Лекция 2-1) Двойной электрический слой на границе раздела твердое тело. Раствор электролита
Двойной электрический слой на границе раздела твердое тело. Раствор электролита Лампа накаливания
Лампа накаливания Задания 3-8 ЕГЭ физика
Задания 3-8 ЕГЭ физика Теория переноса нейтронов
Теория переноса нейтронов Планы ускорений плоских механизмов
Планы ускорений плоских механизмов Кавитация. Кавитация в ЦБН: последствия
Кавитация. Кавитация в ЦБН: последствия Теплогазоснабжение с основами теплотехники
Теплогазоснабжение с основами теплотехники Фазовая автоподстройка (ФАП) в приемниках ОФМн радиосигналов. Схемы Пистолькорса и Сифорова
Фазовая автоподстройка (ФАП) в приемниках ОФМн радиосигналов. Схемы Пистолькорса и Сифорова Психикалық статустың жазылуымен науқастың психикалық жағдайын бағалау әдістері
Психикалық статустың жазылуымен науқастың психикалық жағдайын бағалау әдістері Магнитное поле в веществе. Магнитные свойства вещества
Магнитное поле в веществе. Магнитные свойства вещества Презентация по физике "Ядерна зброя" - скачать бесплатно
Презентация по физике "Ядерна зброя" - скачать бесплатно Магнитоимпульсное формообразование
Магнитоимпульсное формообразование Презентация по физике "Затухающие колебания" - скачать
Презентация по физике "Затухающие колебания" - скачать