Содержание
- 2. Пусть начальное состояние газа отвечает состоянию при нормальных условиях Т0 = 0°С = 273.15 °К, р0
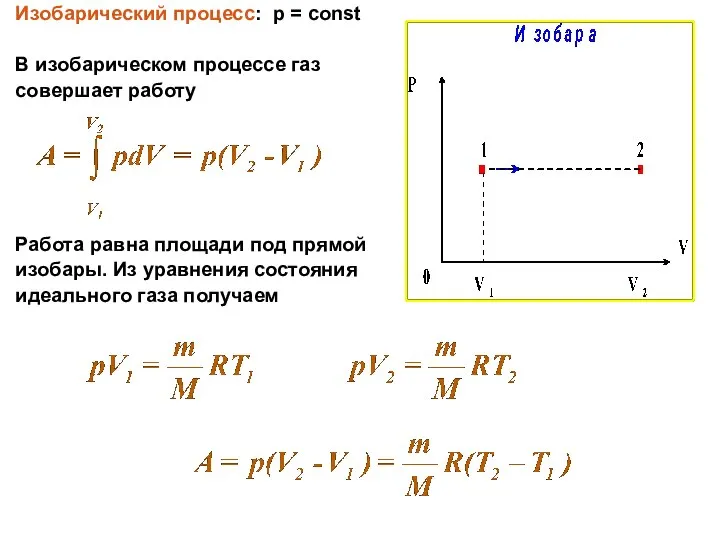
- 3. Изобарический процесс: p = const В изобарическом процессе газ совершает работу Работа равна площади под прямой
- 4. Перепишем последнее соотношение в виде Это равенство раскрывает физический смысл газовой постоянной R - она равна
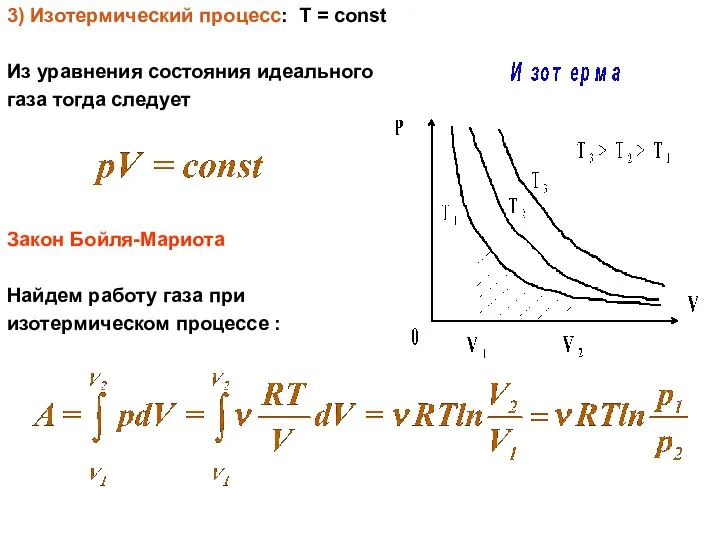
- 5. 3) Изотермический процесс: Т = const Из уравнения состояния идеального газа тогда следует Закон Бойля-Мариота Найдем
- 6. Используя формулу U = νсVT , получаем dU = νсV dT = 0 Следовательно, внутренняя энергия
- 7. 4) Адиабатический процесс : d'Q = 0 При адиабатическом процессе теплообмен между газом и окружающей средой
- 8. Исключая dT , получаем рdV = - сV (pdV + vdp)/R Откуда Интегрируя, находим
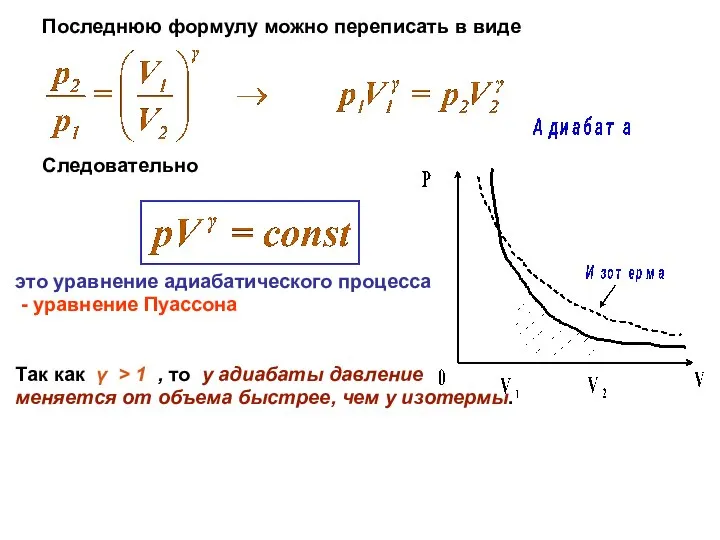
- 9. Последнюю формулу можно переписать в виде Следовательно это уравнение адиабатического процесса - уравнение Пуассона Так как
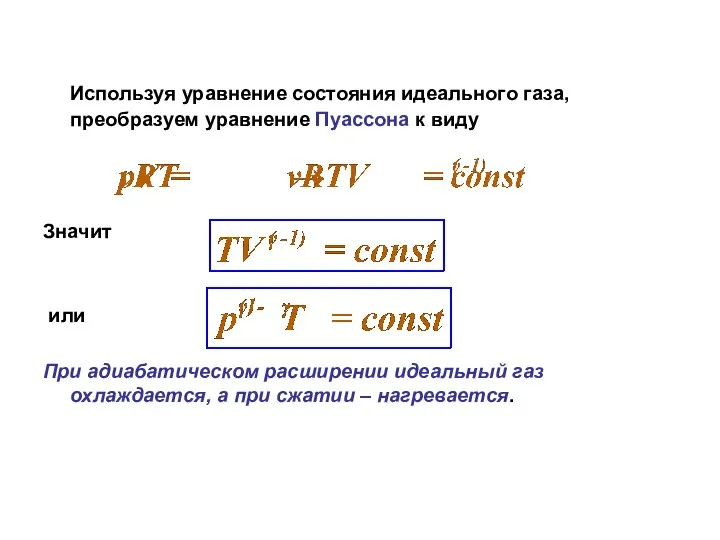
- 10. Используя уравнение состояния идеального газа, преобразуем уравнение Пуассона к виду Значит или При адиабатическом расширении идеальный
- 11. Найдем работу газа при адиабатическом процессе. Из первого начала термодинамики после интегрирования, находим Выразим работу газа
- 12. Тогда Используя и получаем
- 13. 11.6 Политропические процессы Политропический процесс – это процесс в ходе которого теплоемкость газа остается постоянной: cm
- 14. С другой стороны, из уравнения состояния идеального газа Поэтому можно записать Поскольку cP = cV +
- 15. Обозначим , получим Интегрируем Следовательно Это - уравнение политропы, n - показатель политропы. Все предыдущие процессы
- 16. Изменение энтропии в неадиабатических процессах идеального газа В неадиабатических процессах между идеальным газом и внешними телами
- 17. Поэтому изменение энтропии на конечном участке процесса между состояниями 1 и 2 равно интегралу
- 18. Отсюда следует, что 1 ) при изотермическом процессе ( Т2 = Т1 ) 2 ) при
- 19. Изменение энтропии при плавлении и испарении Если при плавлении или испарении давление не меняется, то как
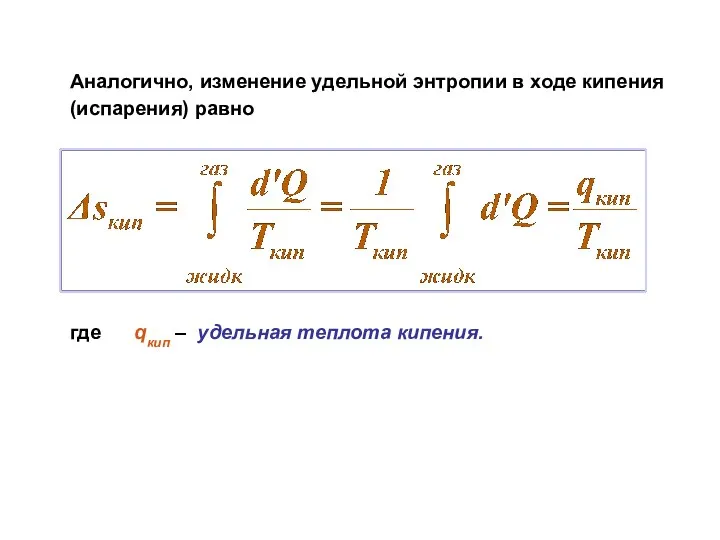
- 20. Аналогично, изменение удельной энтропии в ходе кипения (испарения) равно где qкип – удельная теплота кипения.
- 22. Скачать презентацию














 Оптика. Оптическая сила линзы. Формула тонкой линзы. Линейное увеличение
Оптика. Оптическая сила линзы. Формула тонкой линзы. Линейное увеличение Источники звука. Звуковые колебания
Источники звука. Звуковые колебания ВИДЫ ДВИЖЕНИЯ
ВИДЫ ДВИЖЕНИЯ Определение скорости звука в воде, 1826 г. Опыты Колладона и Штурма
Определение скорости звука в воде, 1826 г. Опыты Колладона и Штурма Электрическое освещение. История и развитие
Электрическое освещение. История и развитие Решение задач по теме «Законы постоянного тока»
Решение задач по теме «Законы постоянного тока» Проводники и диэлектрики в электростатическом поле. 10 класс
Проводники и диэлектрики в электростатическом поле. 10 класс Задача на расчет давления жидкости на дно и стенки сосуда
Задача на расчет давления жидкости на дно и стенки сосуда Электр өрісі
Электр өрісі Плотность воды
Плотность воды Получение изображения при помощи линзы. Лабораторная работа № 11
Получение изображения при помощи линзы. Лабораторная работа № 11 Тензоры. Природа и свойства тензоров
Тензоры. Природа и свойства тензоров Мастер-класс: Поиск новых решений с помощью морфологической матрицы
Мастер-класс: Поиск новых решений с помощью морфологической матрицы Пособие по безработице в зарубежных странах
Пособие по безработице в зарубежных странах Основы теории электромагнитного поля
Основы теории электромагнитного поля Мёссбауэровская спектроскопия
Мёссбауэровская спектроскопия Расчет комплексных сопротивлений электрических цепей
Расчет комплексных сопротивлений электрических цепей Внутреннее строение звезд
Внутреннее строение звезд Нанотехнологии. Лекция 7. Классификация способов получения наноматериалов
Нанотехнологии. Лекция 7. Классификация способов получения наноматериалов Спектральный анализ
Спектральный анализ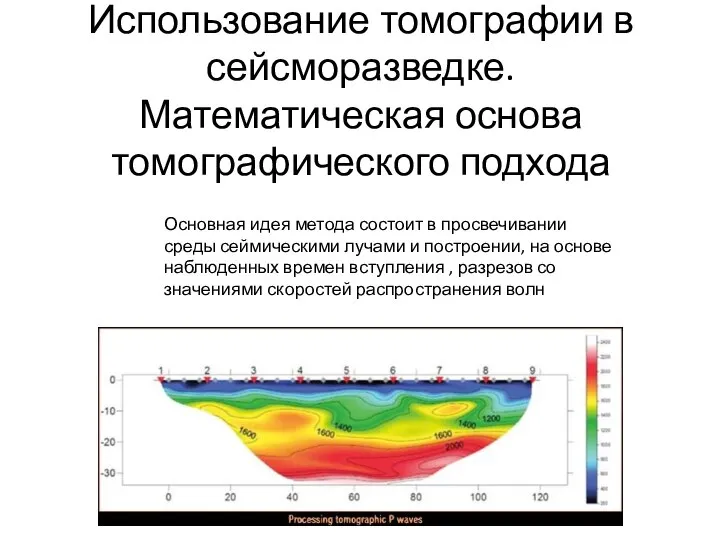 Использование томографии в сейсморазведке. Математическая основа томографического подхода
Использование томографии в сейсморазведке. Математическая основа томографического подхода Определение плотности берёзового сока. Автор: Ковалёв Денис, учащийся 8 класса МОУ «ПССОШ»
Определение плотности берёзового сока. Автор: Ковалёв Денис, учащийся 8 класса МОУ «ПССОШ» Электричесие явления (10 класс)
Электричесие явления (10 класс) Презентация Радиация и жизнь
Презентация Радиация и жизнь  Теорема об изменении кинетической энергии системы
Теорема об изменении кинетической энергии системы Электромагнитная индукция
Электромагнитная индукция  Объяснение явлений
Объяснение явлений Три состояния вещества
Три состояния вещества