Содержание
- 2. Структура части С КИМов по химии в 2006 году С1. Окислительно-восстановительные реакции С2. Составление возможных уравнений
- 3. Окислительно-восстановительные реакции Основное правило, которое используется при определении продуктов ОВР: один элемент понижает свою степень окисления,
- 4. Окислительно-восстановительные реакции С1. Используя метод электронного баланса, составьте уравнение реакции: P + HClO3 + ...= HCl
- 5. Окислительно-восстановительные реакции С1. Используя метод электронного баланса, составьте уравнение: Al + K2Cr2O7 + … = …
- 6. Окислительно-восстановительные реакции Примеры окислительно-восстановительных реак-ций в заданиях С1: a) SO2 + K2Cr2O7 + … = K2SO4
- 7. Составление возможных уравнений реакций С2. Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора. Напишите
- 8. Составление возможных уравнений реакций С2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида алюминия, сероводорода и гидроксида
- 9. Составление возможных уравнений реакций С2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6], хлорида железа (III), сернистого газа
- 10. Составление возможных уравнений реакций C2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6], хлорида хрома (III), карбоната калия
- 11. Взаимосвязь органических веществ C3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: H2SO4(конц.),t Br2 H2O,
- 12. Взаимосвязь органических веществ C3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: KOH(спирт.), t t,
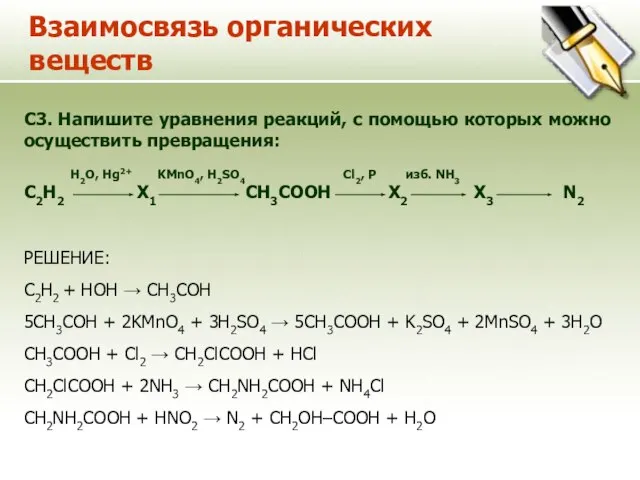
- 13. Взаимосвязь органических веществ C3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: H2O, Hg2+ KMnO4,
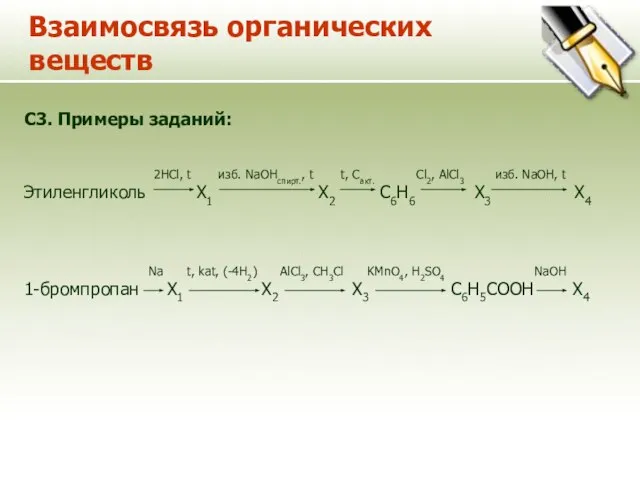
- 14. Взаимосвязь органических веществ C3. Примеры заданий: 2HCl, t изб. NaOHспирт., t t, Cакт. Cl2, AlCl3 изб.
- 15. Расчёты по уравнениям реакций С4. Для окисления некоторого количества серы потребовался такой объем кислорода (н.у.), который
- 16. Расчёты по уравнениям реакций C4. Примеры заданий: а) Для окисления некоторого количества аммиака потребовался такой объём
- 17. Расчёты по теме «Растворы» С4. Смешали 100 мл 15% раствора гидроксида калия (плотностью 1,10 г/мл) и
- 18. Расчёты по теме «Растворы» С4. Примеры заданий: К раствору, полученному при добавлении 8 г гидрида лития
- 19. Задачи на вывод формулы вещества С5. При сгорании газообразного органического вещества, не содержащего кислород, выделилось 2,24
- 21. Скачать презентацию






![Составление возможных уравнений реакций С2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213935/slide-7.jpg)
![Составление возможных уравнений реакций С2. Даны водные растворы: гексагидроксохромата натрия Na3[Cr(OH)6],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213935/slide-8.jpg)
![Составление возможных уравнений реакций C2. Даны водные растворы: гексагидроксоалюмината калия K3[Al(OH)6],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213935/slide-9.jpg)







 Положение металлов в ПС, особенности строения их атомов, физические свойства
Положение металлов в ПС, особенности строения их атомов, физические свойства Что такое полупроводники
Что такое полупроводники Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар
Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар Презентация по Химии "Липиды" - скачать смотреть
Презентация по Химии "Липиды" - скачать смотреть  Изучение физико-химических показателей качества сушек
Изучение физико-химических показателей качества сушек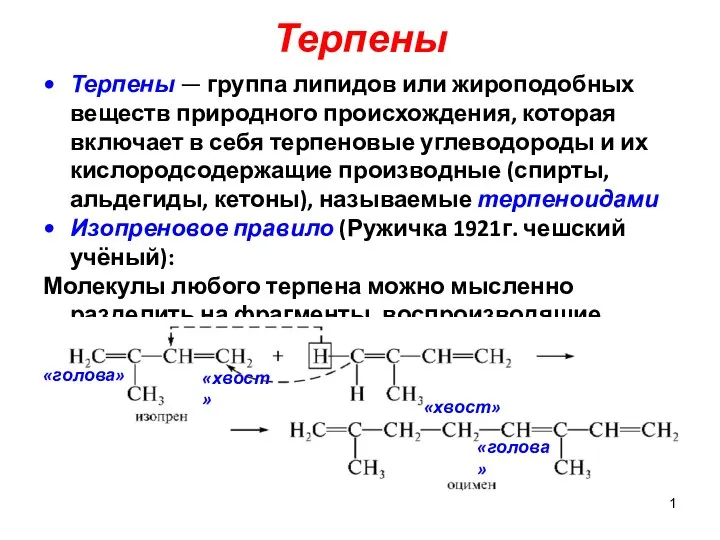 Терпены
Терпены Хімія числа Е в продуктах харчування
Хімія числа Е в продуктах харчування  Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Соли угольной кислоты
Соли угольной кислоты Ионные равновесия в растворах электролитов
Ионные равновесия в растворах электролитов Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление
Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов
Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов Фуллерены в супрамолекулярной химии (Лекция 7)
Фуллерены в супрамолекулярной химии (Лекция 7) Золото Aurum
Золото Aurum Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Амины
Амины Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Химия атмосферы
Химия атмосферы Абсорбция, адсорбция, конденсация
Абсорбция, адсорбция, конденсация Гидролиз неорганических веществ - солей
Гидролиз неорганических веществ - солей Аттестационная работа. Проектно-исследовательская деятельность студентов на уроках химии и во внеурочное время
Аттестационная работа. Проектно-исследовательская деятельность студентов на уроках химии и во внеурочное время Electrolysis
Electrolysis ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1.История открытия Периодической системы химических элемен
ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1.История открытия Периодической системы химических элемен Маркировки
Маркировки Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление
Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление Общая характеристика углерода
Общая характеристика углерода