Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов
Содержание
- 2. Классификация С одним гетероатомом С двумя гетероатомами Конденсированные системы гетероциклов
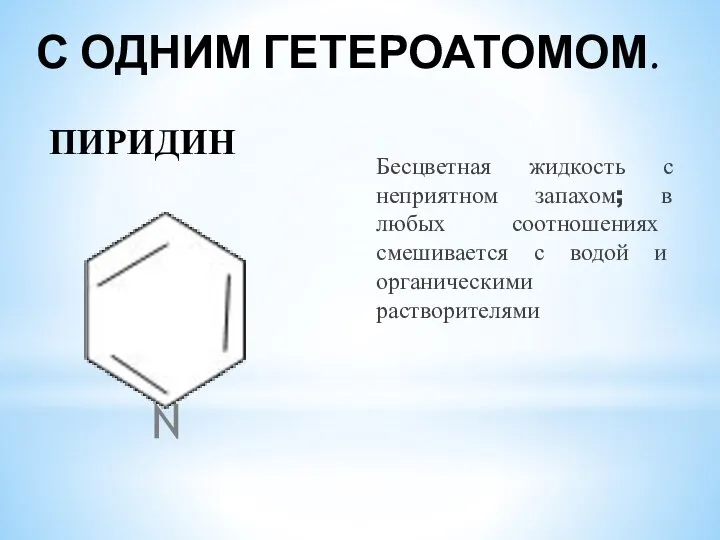
- 3. С ОДНИМ ГЕТЕРОАТОМОМ. Бесцветная жидкость с неприятном запахом; в любых соотношениях смешивается с водой и органическими
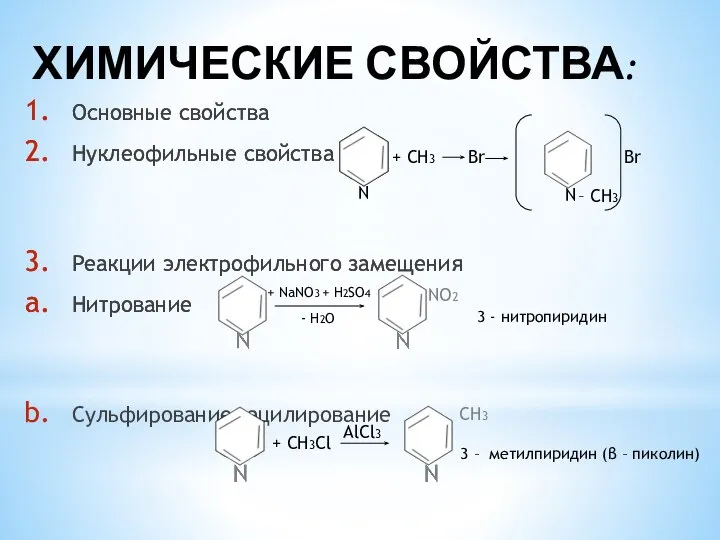
- 4. ХИМИЧЕСКИЕ СВОЙСТВА: Основные свойства Нуклеофильные свойства Реакции электрофильного замещения Нитрование N + СН3 Br N –
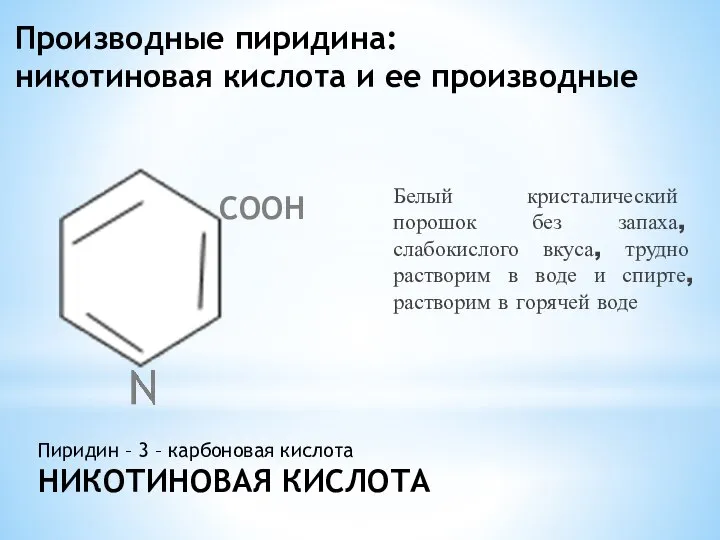
- 5. Производные пиридина: никотиновая кислота и ее производные Белый кристалический порошок без запаха, слабокислого вкуса, трудно растворим
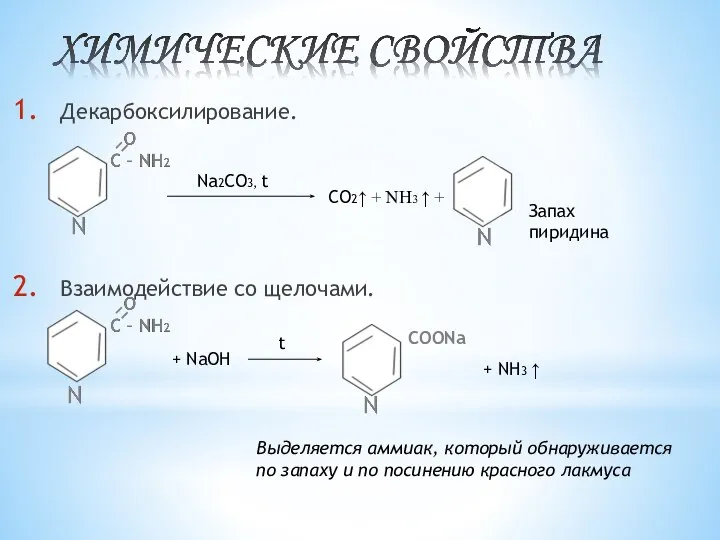
- 6. ХИМИЧЕСКИЕ СВОЙСТВА Декарбоксилирование (качественная реакция) Качественая реакция с CuSO4, выпадает осадок синего цвета. При добавлении CuSO4
- 7. Применение никотиновой кислоты Применяется как витамин «В» при пеллагре, который характеризуется широким комплексом расстройств – 3Д:
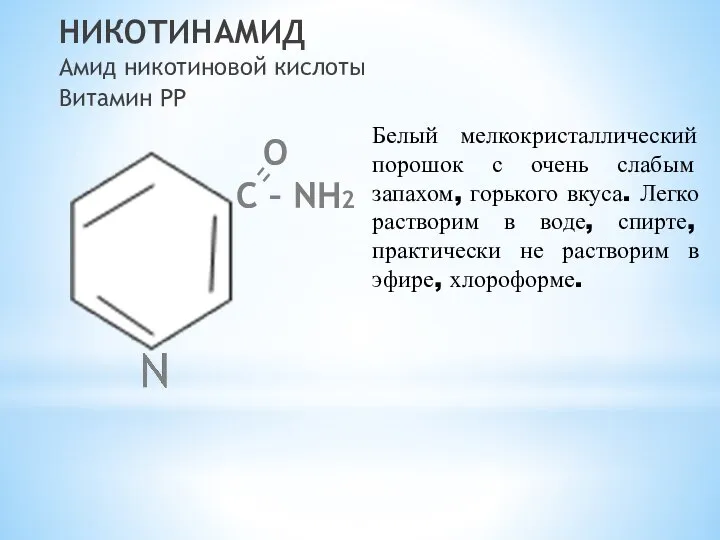
- 8. НИКОТИНАМИД Амид никотиновой кислоты Витамин РР O С – NH2 Белый мелкокристаллический порошок с очень слабым
- 9. Декарбоксилирование. Взаимодействие со щелочами. Na2CO3, t CO2↑ + NH3 ↑ + Запах пиридина + NaOH t
- 10. Применение никотинамида Применяется для лечения пеллагры и других заболеваний.
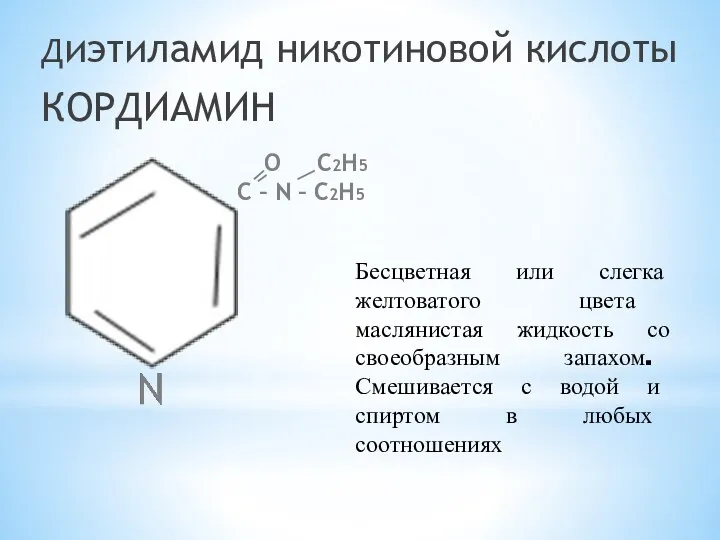
- 11. Диэтиламид никотиновой кислоты КОРДИАМИН O С2H5 С – N – С2H5 Бесцветная или слегка желтоватого цвета
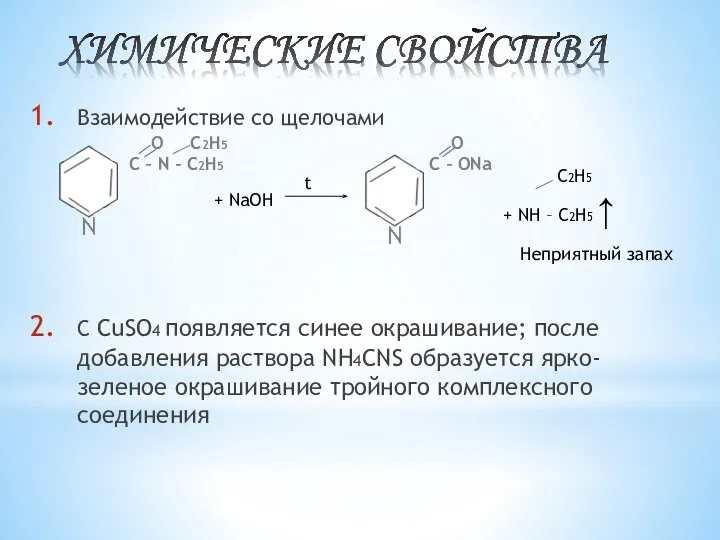
- 12. Взаимодействие со щелочами С CuSO4 появляется синее окрашивание; после добавления раствора NH4CNS образуется ярко-зеленое окрашивание тройного
- 13. Применение кордиамина Кордиамин стимулирует ЦНС, возбуждает дыхательный центр, тонизирует сердечно – сосудистую систему.
- 14. С ДВУМЯ ГЕТЕРОАТОМАМИ ПИРИМИДИН Наиболее важные производные, имеющие биологическое значение и применение в медицине: Нуклеиновые основания
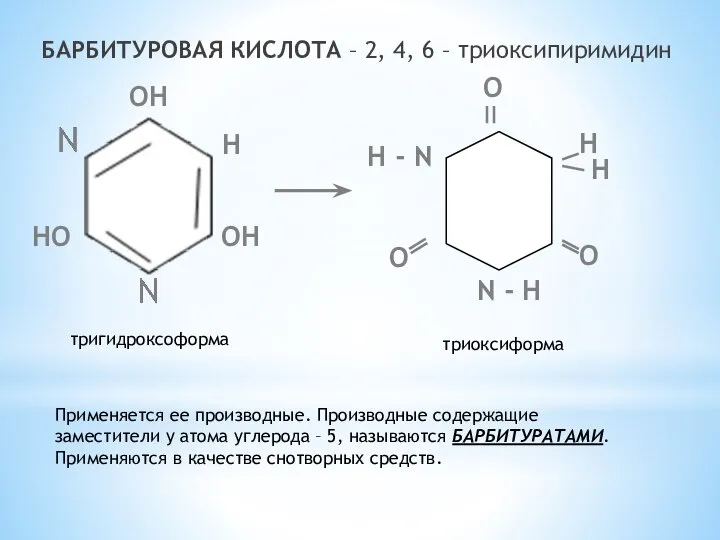
- 15. БАРБИТУРОВАЯ КИСЛОТА – 2, 4, 6 – триоксипиримидин ОН Н ОН НО N - Н Н
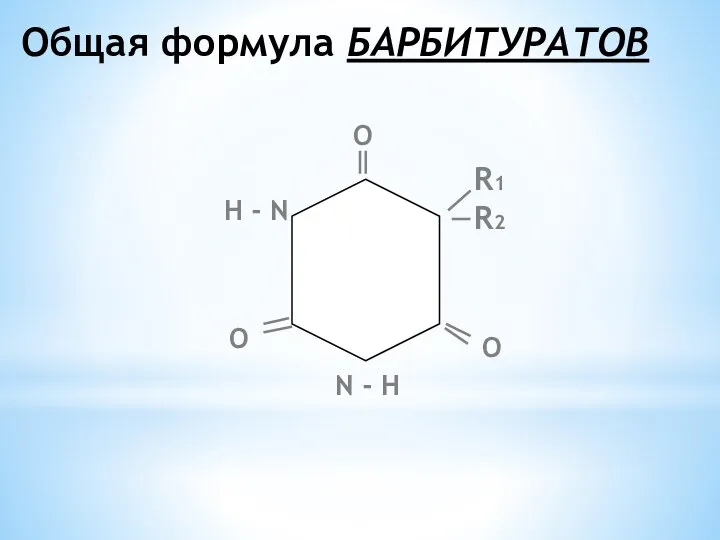
- 16. Общая формула БАРБИТУРАТОВ R1 R2 N - Н Н - N О О О
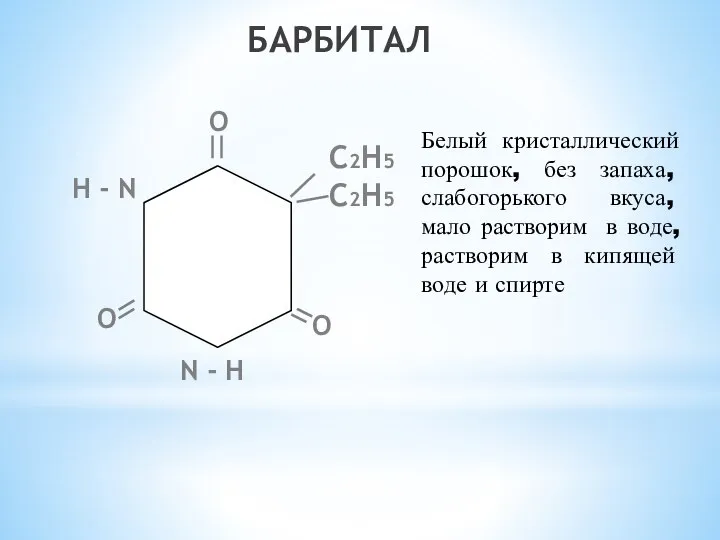
- 17. БАРБИТАЛ С2Н5 С2Н5 N - Н Н - N О О О Белый кристаллический порошок, без
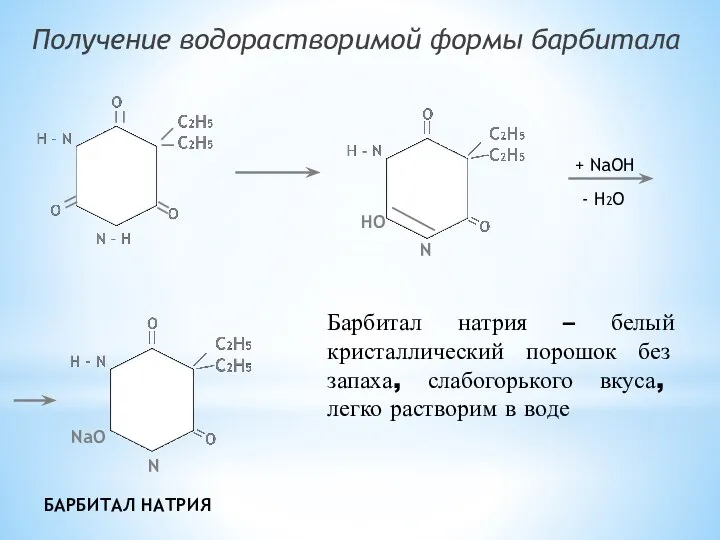
- 18. Получение водорастворимой формы барбитала N HO + NaOH - H2O N NaO БАРБИТАЛ НАТРИЯ Барбитал натрия
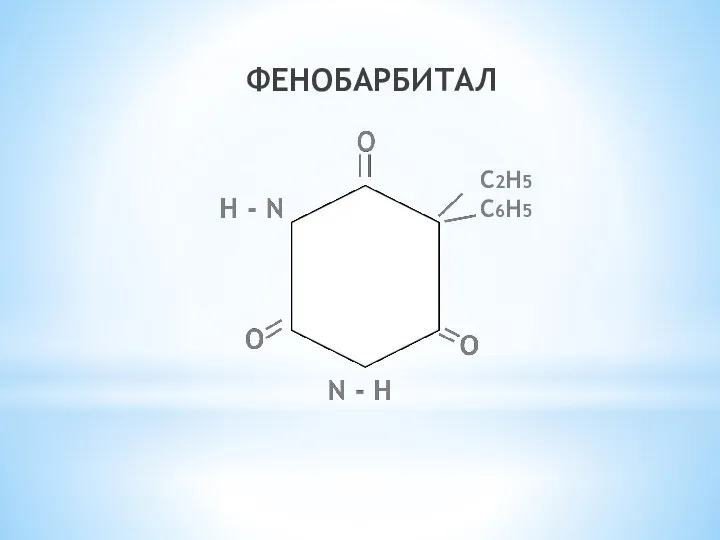
- 19. ФЕНОБАРБИТАЛ С2Н5 С6Н5
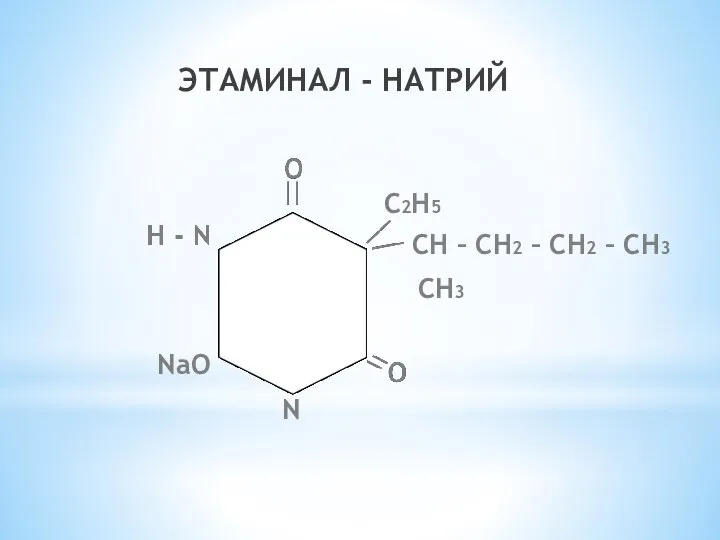
- 20. ЭТАМИНАЛ - НАТРИЙ N NaO C2H5 CH – CH2 – CH2 – CH3 CH3
- 21. Общие реакции на барбитураты: при добавлении CaCl2 и Co(NO3)2 в щелочной среде, появляется сине – фиолетовое
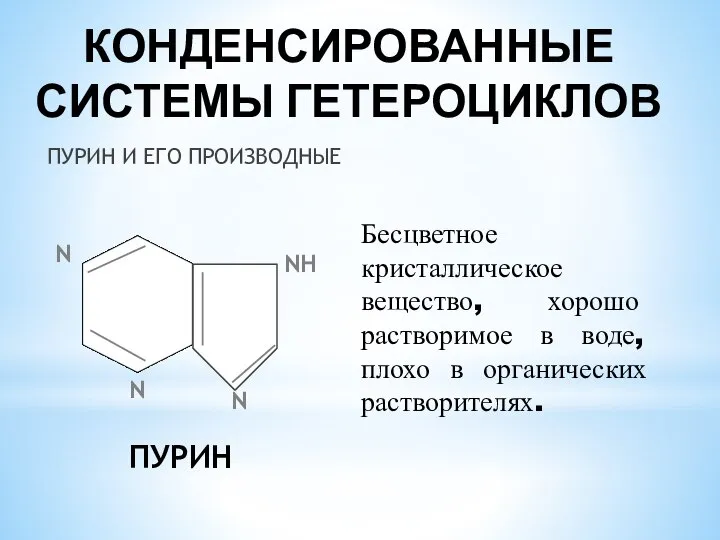
- 22. КОНДЕНСИРОВАННЫЕ СИСТЕМЫ ГЕТЕРОЦИКЛОВ ПУРИН И ЕГО ПРОИЗВОДНЫЕ N N NН N ПУРИН Бесцветное кристаллическое вещество, хорошо
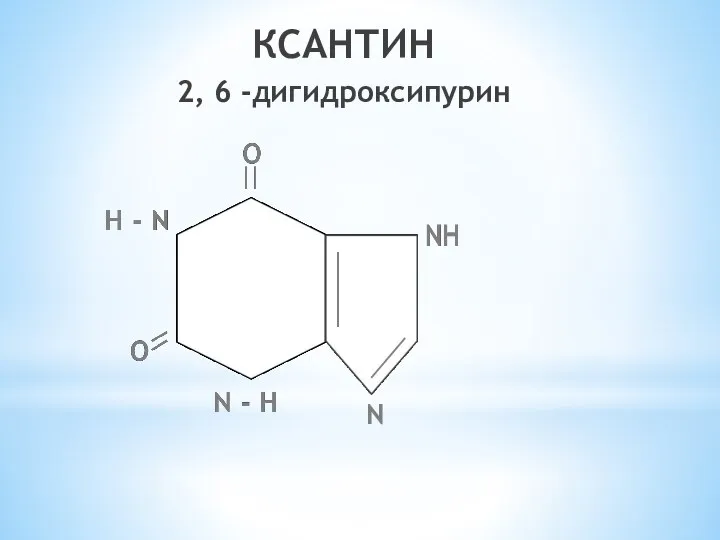
- 23. КСАНТИН 2, 6 -дигидроксипурин N
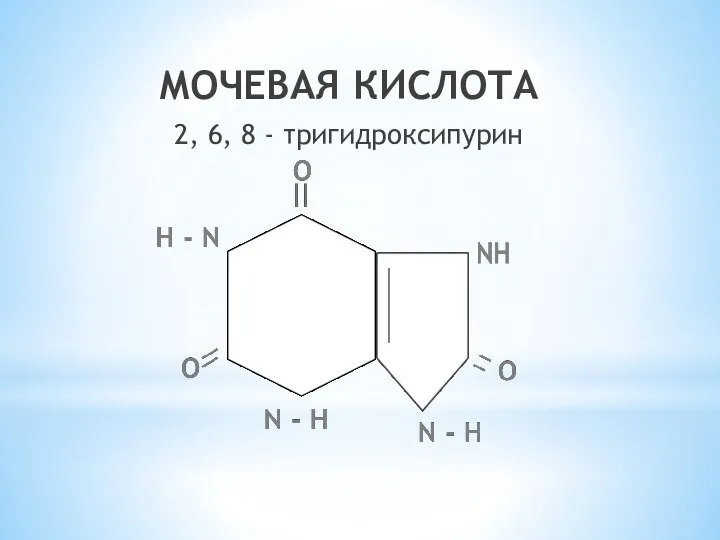
- 24. МОЧЕВАЯ КИСЛОТА 2, 6, 8 - тригидроксипурин
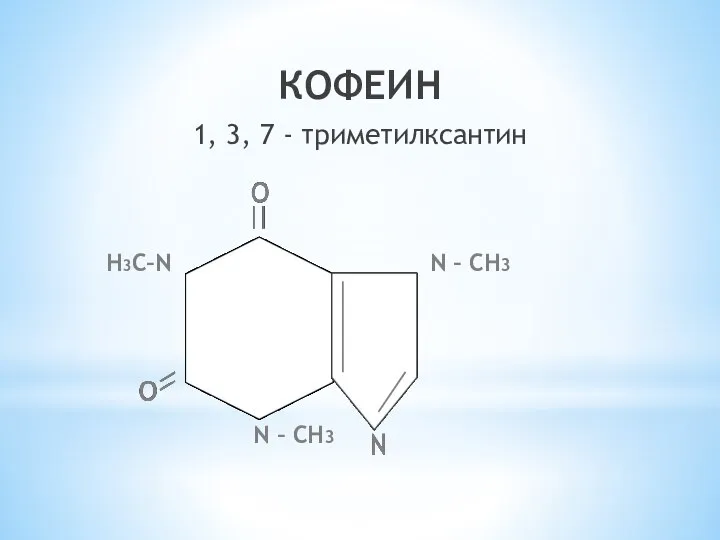
- 25. КОФЕИН 1, 3, 7 - триметилксантин N – СН3 N – СН3 Н3С–N
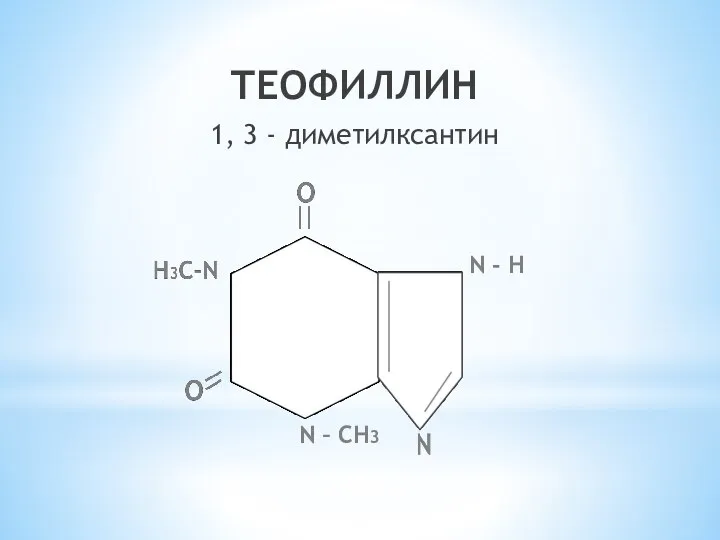
- 26. ТЕОФИЛЛИН 1, 3 - диметилксантин N - H N – СН3
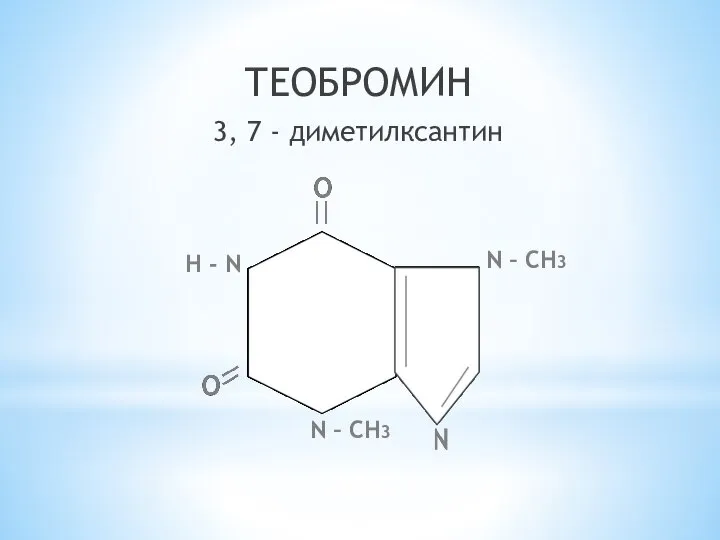
- 27. ТЕОБРОМИН 3, 7 - диметилксантин N – СН3 Н - N N – СН3
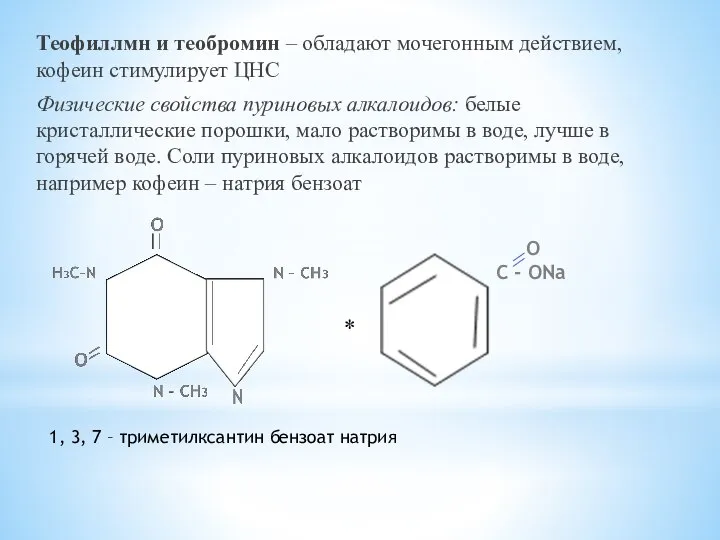
- 28. Теофиллмн и теобромин – обладают мочегонным действием, кофеин стимулирует ЦНС Физические свойства пуриновых алкалоидов: белые кристаллические
- 29. 1. Общая качественная реакция – мурексидная проба. Препарат нагревают с HCl и пергидролем, выпаривают досуха (окисление),
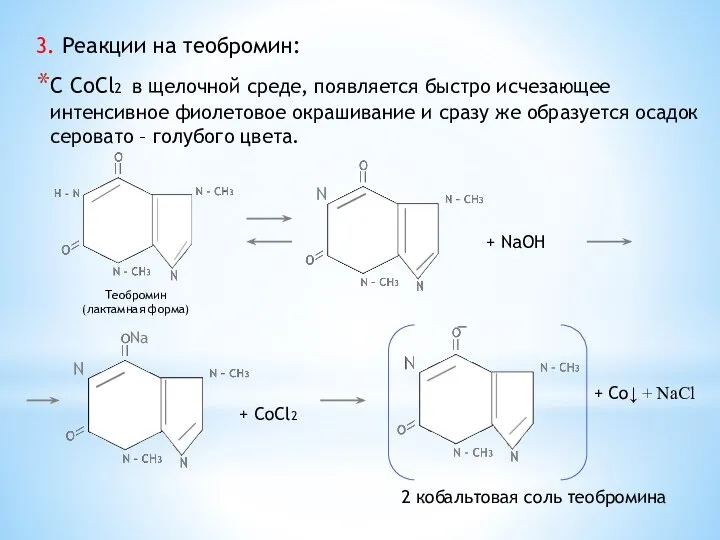
- 30. 3. Реакции на теобромин: С CoCl2 в щелочной среде, появляется быстро исчезающее интенсивное фиолетовое окрашивание и
- 31. С раствором аммиака и AgNO3, после встряхивания образуется густая желатинообразная масса, которая разжижается при нагревании до
- 33. Скачать презентацию









 Электролиттік диссоциация теориясы
Электролиттік диссоциация теориясы Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Органолептические свойства молока
Органолептические свойства молока Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов
Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов Мыло. Компоненты мыла
Мыло. Компоненты мыла Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Титан. История открытия титана
Титан. История открытия титана Chemical bonding and Molecular Structure
Chemical bonding and Molecular Structure Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Презентация по Химии "Алканы 10 класс" - скачать смотреть
Презентация по Химии "Алканы 10 класс" - скачать смотреть  Етиловий спирт
Етиловий спирт Обмен липидов
Обмен липидов Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Процессы комплексообразования
Процессы комплексообразования Підготувала учениця 10-Б класу Березянська Альона
Підготувала учениця 10-Б класу Березянська Альона  Технология кварцевого стекла
Технология кварцевого стекла Растворы и растворимость. (8 класс)
Растворы и растворимость. (8 класс) Основные классы неорганических веществ
Основные классы неорганических веществ Комбинированные задачи. Задание 34
Комбинированные задачи. Задание 34 Названия алканов
Названия алканов Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Биогенные s-элементы
Биогенные s-элементы Исследовательский проект Тема «Ураты, оксалаты...»
Исследовательский проект Тема «Ураты, оксалаты...» Химические свойства неорганических веществ (повторение)
Химические свойства неорганических веществ (повторение) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Аналитикалық және физколлоидтық химия
Аналитикалық және физколлоидтық химия Кафедры биохимии УГМУ в прошлом и настоящем
Кафедры биохимии УГМУ в прошлом и настоящем Электролитическая диссоциация
Электролитическая диссоциация