Содержание
- 2. Відповідно до замісникової номенклатури (IUPAC) алкіни називають, змінюючи у відповідних алканах суфікс -ан на –ин (ін).
- 3. Промислові методи добування 1. Піроліз алканів (метану або нафтових фракцій) При піролізі нафтових фракцій, таких як
- 4. 2. З кальцій карбіду (карбідний метод) При спіканні вапна з коксом при 2000ºС, утворюється кальцій карбід
- 5. Лабораторні методи добування Відщеплення галогеноводню від дигалогеналканів або галогеналкенів. При підвищених температурах у присутності концентрованого розчину
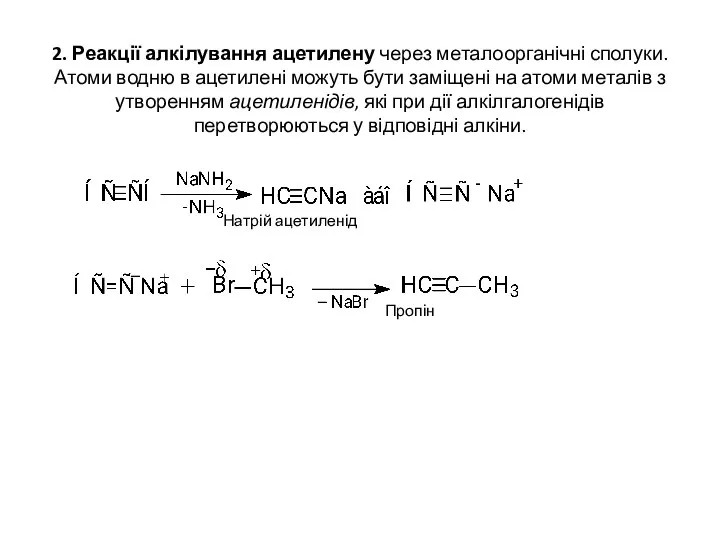
- 6. 2. Реакції алкілування ацетилену через металоорганічні сполуки. Атоми водню в ацетилені можуть бути заміщені на атоми
- 7. ФІЗИЧНІ ВЛАСТИВОСТІ Алкіни С2-С4- це гази, починаючи з С5- і до С16- рідини, а з С17-тверді
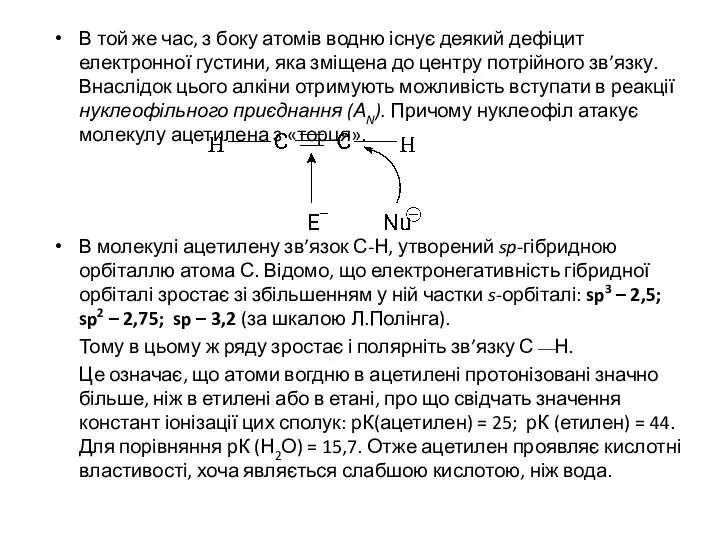
- 8. ХІМІЧНІ ВЛАСТИВОСТІ π-електронна густина отрійного зв’язку С≡С в ацетилені важче поляризується, ніж подвійного в етилені, оскільки
- 9. В той же час, з боку атомів водню існує деякий дефіцит електронної густини, яка зміщена до
- 10. Таким чином для алкінів характерні реакції приєднання (АЕ та АN), полімеризації, окиснення, та заміщення за "кислим”
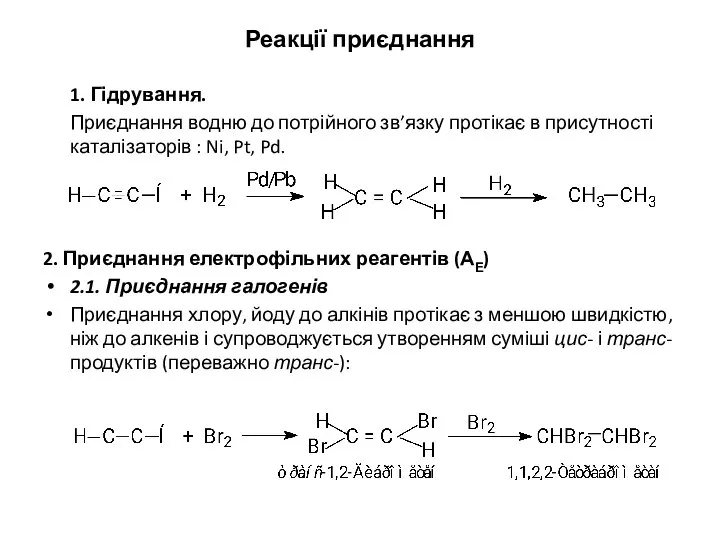
- 11. Реакції приєднання 1. Гідрування. Приєднання водню до потрійного зв’язку протікає в присутності каталізаторів : Ni, Pt,
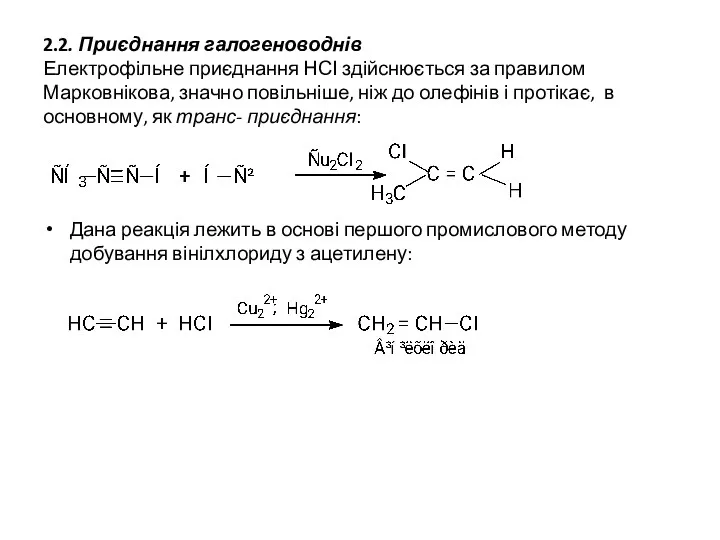
- 12. 2.2. Приєднання галогеноводнів Електрофільне приєднання НСІ здійснюється за правилом Марковнікова, значно повільніше, ніж до олефінів і
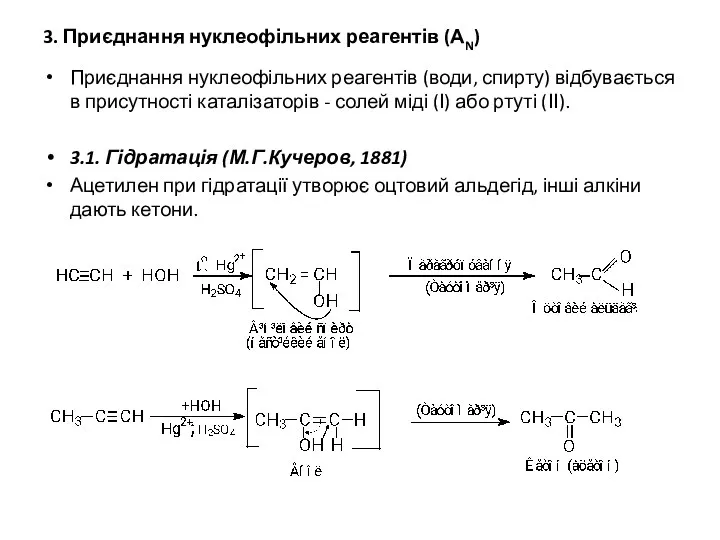
- 13. 3. Приєднання нуклеофільних реагентів (АN) Приєднання нуклеофільних реагентів (води, спирту) відбувається в присутності каталізаторів - солей
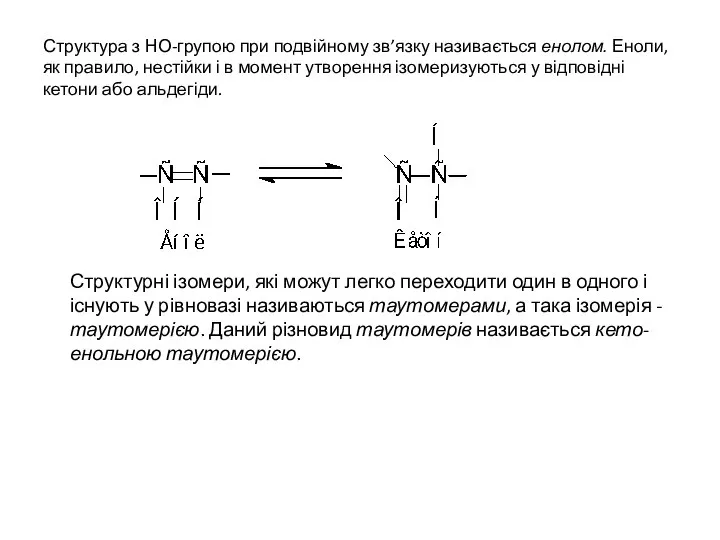
- 14. Структура з НО-групою при подвійному зв’язку називається енолом. Еноли, як правило, нестійки і в момент утворення
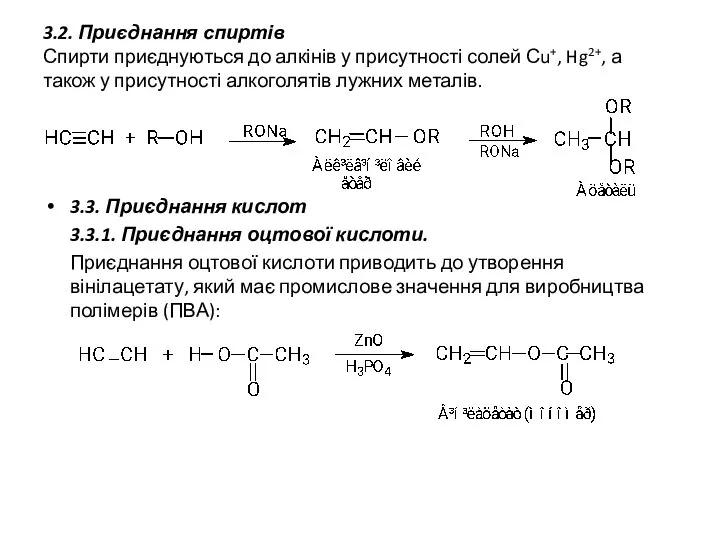
- 15. 3.2. Приєднання спиртів Спирти приєднуються до алкінів у присутності солей Сu+, Hg2+, а також у присутності
- 16. 3.3.2. Приєднання ціанідної кислоти У результаті реакції утворюється мономер - акрилонітрил (нітрил акрилової кислоти), який широко
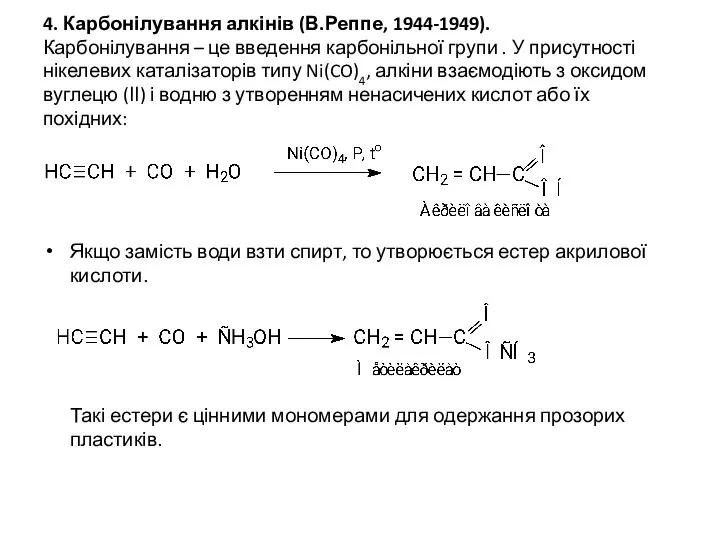
- 17. 4. Карбонілування алкінів (В.Реппе, 1944-1949). Карбонілування – це введення карбонільної групи . У присутності нікелевих каталізаторів
- 18. 5. Приєднання альдегідів і кетонів Приєднання формальдегіду (Реппе) відбувається у присутності ацетиленіду міді: Приєднання ацетону протікає
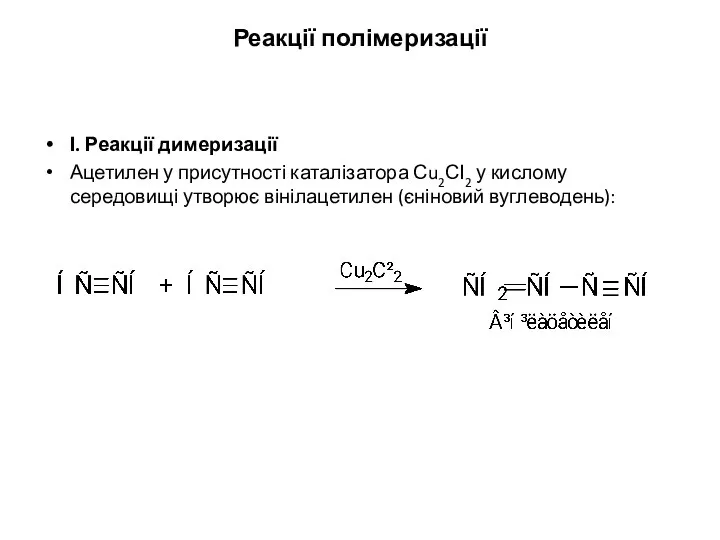
- 19. Реакції полімеризації І. Реакції димеризації Ацетилен у присутності каталізатора Сu2СІ2 у кислому середовищі утворює вінілацетилен (єніновий
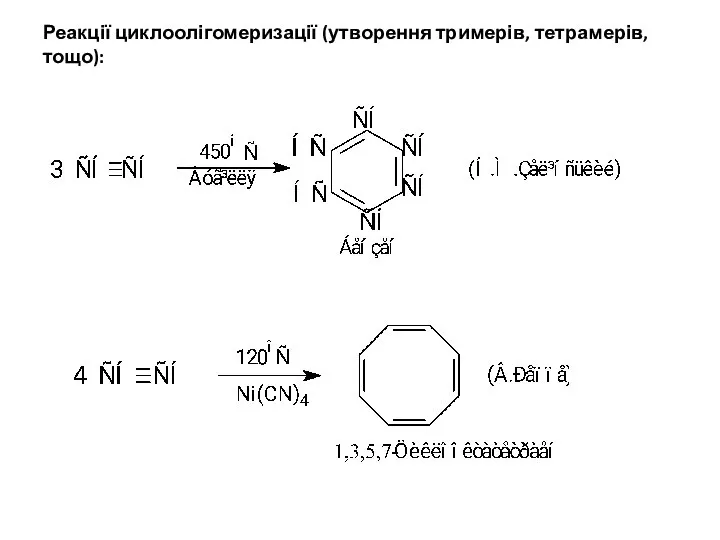
- 20. Реакції циклоолігомеризації (утворення тримерів, тетрамерів, тощо):
- 21. 3. Полімеризація У присутності ініціаторів або металоорганічних каталізаторів утворюються спряжені полієни (від грецького поліс - багато).
- 23. Скачать презентацию










 Горение. Подводный факел
Горение. Подводный факел Органическая химия Предельные углеводороды
Органическая химия Предельные углеводороды Азотная кислота. Состав. Строение. Физические свойства
Азотная кислота. Состав. Строение. Физические свойства Химическая термодинамика и биоэнергетика. Первый закон термодинамики
Химическая термодинамика и биоэнергетика. Первый закон термодинамики Химия көшбасшысы
Химия көшбасшысы Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция № 2
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция № 2 Презентация по Химии "Полимеры" 10 класс
Презентация по Химии "Полимеры" 10 класс Матеріалознавство. Будова твердих тіл та вплив на їх властивості
Матеріалознавство. Будова твердих тіл та вплив на їх властивості Ochistka_stochnykh_vod
Ochistka_stochnykh_vod Постер: применение трековых мембран для электрохимического осаждения наноструктур на основе Ni/CoIX
Постер: применение трековых мембран для электрохимического осаждения наноструктур на основе Ni/CoIX NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Презентация по Химии "Всё о кремнии" - скачать смотреть
Презентация по Химии "Всё о кремнии" - скачать смотреть  Термический анализ
Термический анализ Туф вулканический
Туф вулканический Екстракція і йонний обмін
Екстракція і йонний обмін Карбонільні сполуки. Альдегіди і кетони
Карбонільні сполуки. Альдегіди і кетони Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Будем знакомы -
Будем знакомы - Законы и формулировки
Законы и формулировки Вода. Особливості молекулярної води. Роль води в життєдіяльності організмів Палієнко Яна 10 – Б клас Вчитель: Громова Тетяна В
Вода. Особливості молекулярної води. Роль води в життєдіяльності організмів Палієнко Яна 10 – Б клас Вчитель: Громова Тетяна В Материалы с особыми тепловыми свойствами
Материалы с особыми тепловыми свойствами СОЛИ Классификация сложных неорганических веществ
СОЛИ Классификация сложных неорганических веществ Силумины. Виды силуминов
Силумины. Виды силуминов Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2
Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2 Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Цикл три і дикарбонових кислот (Цикл Кребса)
Цикл три і дикарбонових кислот (Цикл Кребса) Physiology lab
Physiology lab