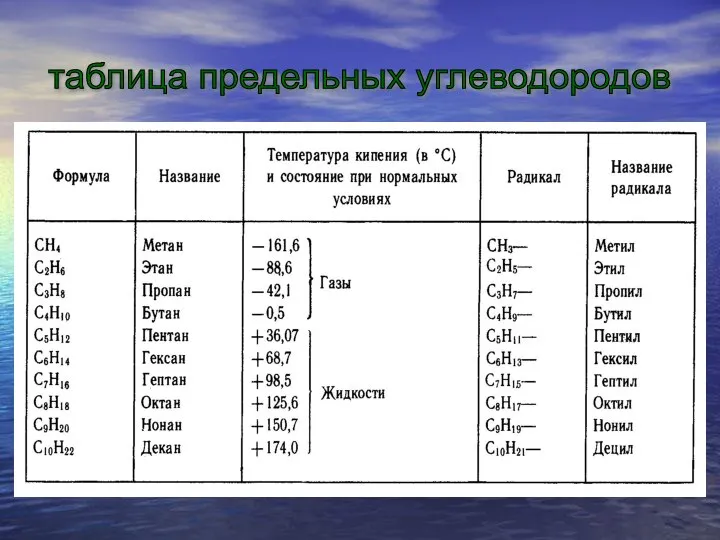
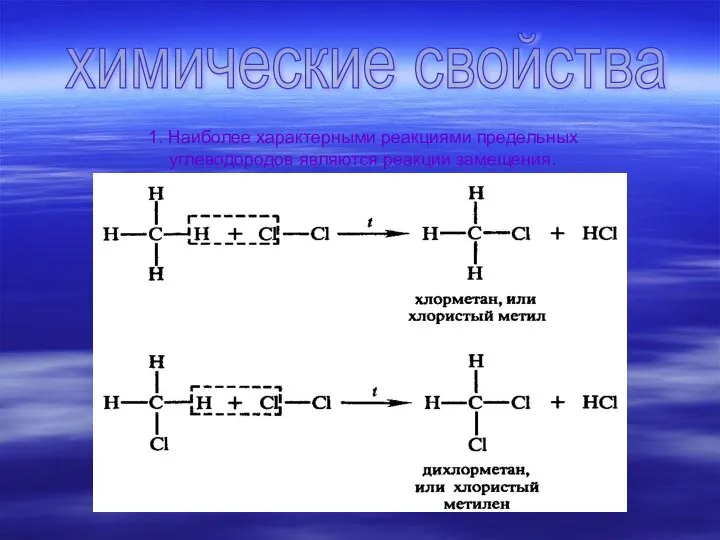
Существует много углеводородов, сходных с метаном, т. е. гомологов метана (греч.
«гомолог» — сходный). В их молекулах имеются два, три, четыре и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов СН2 (группу СН2 называют гомологической разностью).
гомологический ряд метана
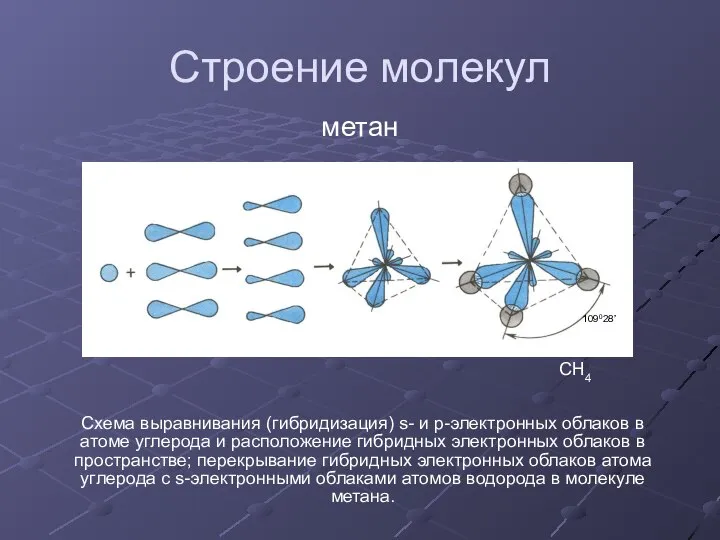
Электронное и пространственное строение других представителей предельных углеводородов сходно со строением молекулы метана.
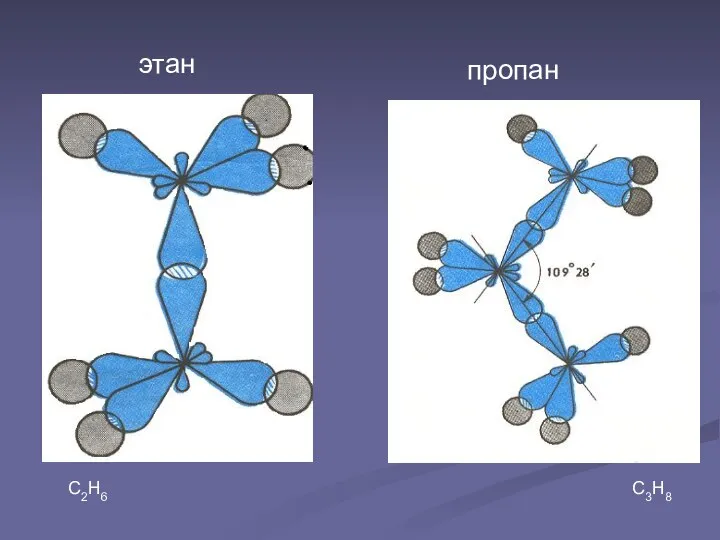
В молекуле этана С2Н6 химическая связь образуется между двумя атомами углерода перекрыванием двух гибридных электронных облаков.
Так как гибридные электронные облака атомов углерода направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109028'. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь поэтому принимает зигзагообразную форму.



 Аминокислоты. Белки
Аминокислоты. Белки Углеводы
Углеводы Электроповерхностные явления. Строение двойного электрического слоя
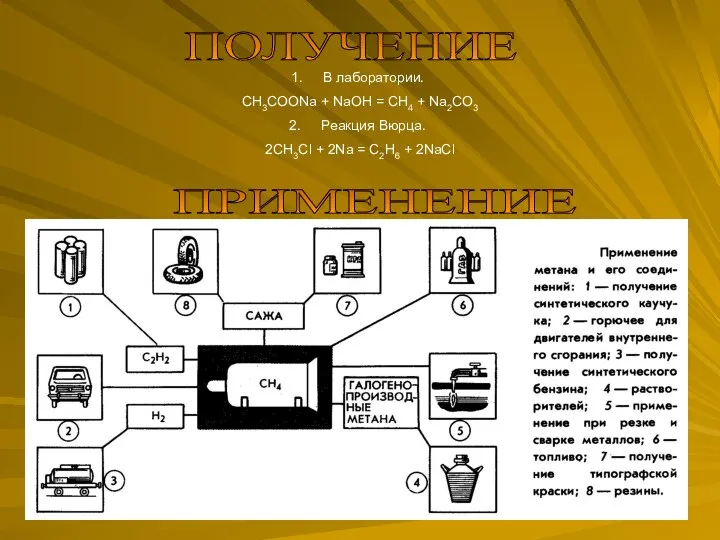
Электроповерхностные явления. Строение двойного электрического слоя Применение спиртов
Применение спиртов Уравнения химических реакций
Уравнения химических реакций Современное состояние и пути совершенствования стандартизации лекарственных средств
Современное состояние и пути совершенствования стандартизации лекарственных средств Экспедиция «Изучай мир». Содержание углекислого газа в воздухе
Экспедиция «Изучай мир». Содержание углекислого газа в воздухе Адские задания. ЕГЭ по химии
Адские задания. ЕГЭ по химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Карбонаты и гидрокарбонаты. Тест – экспресс
Карбонаты и гидрокарбонаты. Тест – экспресс Amino acid and protein metabolism II
Amino acid and protein metabolism II Химия тория и протактиния
Химия тория и протактиния Нуклеиновые кислоты
Нуклеиновые кислоты Презентация на тему «Алмазы» Выполнил: Ученик 9б Смирнов Иван.
Презентация на тему «Алмазы» Выполнил: Ученик 9б Смирнов Иван. Использование кинетики в фармации
Использование кинетики в фармации Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4)
Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4) Презентация по химии Биополимеры и их компоненты
Презентация по химии Биополимеры и их компоненты  Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Нуклеопротеины
Нуклеопротеины Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко
Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Клетчатка. Алу жолдары
Клетчатка. Алу жолдары Электролитическая диссоциация
Электролитическая диссоциация Водород
Водород Карбоновые кислоты
Карбоновые кислоты Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства) Создание оптимального теплового режима в реакторах
Создание оптимального теплового режима в реакторах Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа