Содержание
- 2. «Серебро из глины» Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со
- 3. Из истории открытия В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым
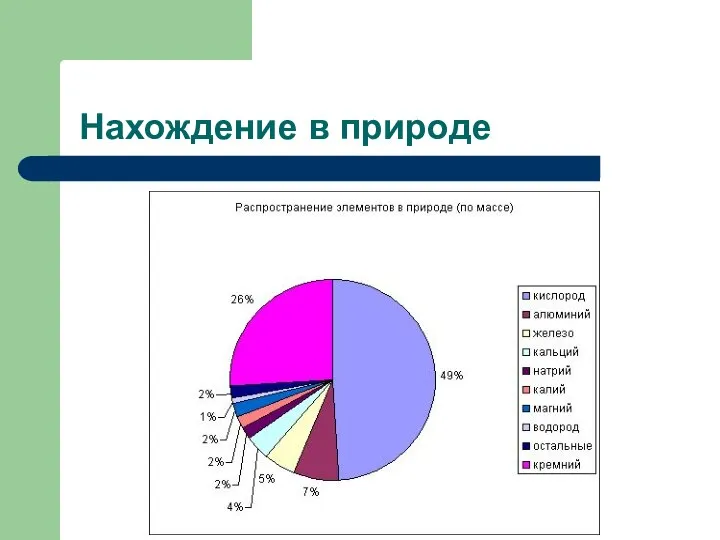
- 4. Нахождение в природе
- 5. Физические свойства Алюминий – металл серебристо- белого цвета, лёгкий ( q- 2,7 г./ см.3), плавится при
- 6. Химические свойства Алюминий восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые
- 7. Применение алюминия Al
- 8. Металл будущего Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов -
- 9. Фосфор P Phosphorus
- 10. Аллотропные Модификации Белый фосфор – P4 запах чесночный, Н в воде, Р в органических растворителях, летуч,
- 11. Аллотропные Модификации Красный фосфор – цвет красно-бурый, не ядовит, Не растворим в воде и органических растворителях,
- 12. Аллотропные Модификации черный фосфор – без запаха, похож на графит, жирный на ощупь, Не растворим в
- 13. 5С + 3SiO2 + Са3(РО4)2 = 5СО + 3CaSi03 + 2Р (сплавление в электрической печи) Получение
- 14. Взаимодействие с кислородом. 4Р°+502 =t 2Р+52O5 белый Т = 40°С красный Т = 260°С черный Т
- 15. 2. Взаимодействие с галогенами. 2Р°+ЗСl2 = 2Р+3С13 легко разлагается водой РС13 + ЗН2О = Н3РО3 +
- 16. 3. Взаимодействие с азотной кислотой. ЗР°+ 5HNO3 + 2Н2О = ЗН3Р+5O4 + 5NO Фосфор как восстановитель
- 18. Скачать презентацию














 Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно
Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно Строение атома (8 класс)
Строение атома (8 класс) Топливо и его характеристики
Топливо и его характеристики Химический элемент сера
Химический элемент сера Важнейшие минералы
Важнейшие минералы Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники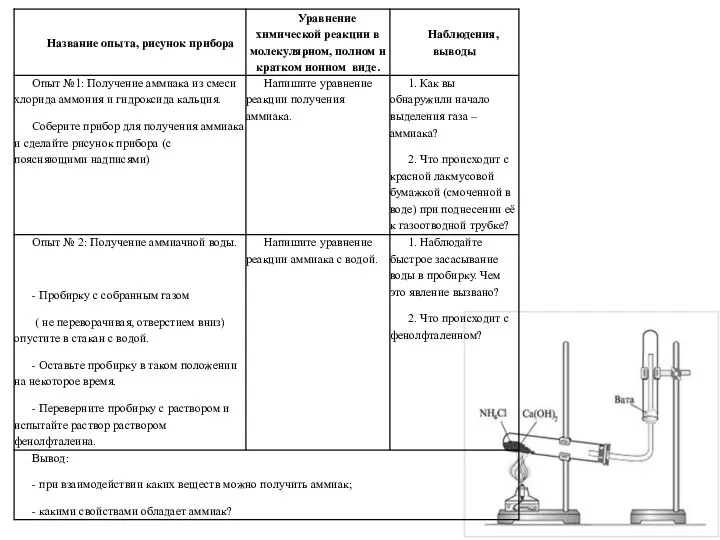 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Обобщение и систематизация знаний по теме: Общая характеристика химических элементов и химических реакций
Обобщение и систематизация знаний по теме: Общая характеристика химических элементов и химических реакций Виды присадок к моторному топливу. Керосин
Виды присадок к моторному топливу. Керосин Хром. Использование хрома
Хром. Использование хрома Азот
Азот Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Ячеечная модель реакторов
Ячеечная модель реакторов Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные Сера. Аллотропные модификации
Сера. Аллотропные модификации Oxygen
Oxygen Что Вы ожидаете от занятия? Отметьте своё настроение.
Что Вы ожидаете от занятия? Отметьте своё настроение.  Получение и реакции пиразина
Получение и реакции пиразина Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Химические явления. Уравнения химических реакций
Химические явления. Уравнения химических реакций Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Химико-технологические процессы современных производств. Лекция №3
Химико-технологические процессы современных производств. Лекция №3 Методы контроля и анализа веществ
Методы контроля и анализа веществ Химия элементов VA группы
Химия элементов VA группы Гормоны
Гормоны Тест по неметаллам
Тест по неметаллам