Амфотерные неорганические и органические соединения МОУ «Гатчинская СОШ №2» Учитель химии: Г.Г.Павлова Учитель инфор
Содержание
- 2. 1. Верное утверждение о значении понятия «амфотерность»: 1) преобладание кислотных свойств вещества над основными; 2) проявление
- 3. 2. Некоторый элемент образует три типа оксидов (основный, амфотерный и кислотный). Степень окисления элемента в амфотерном
- 4. 3. В щелочном растворе аминоуксусная кислота существует в виде частиц: 1) H3N+ – CH2 – COOH;
- 5. 4. Какое из утверждений неверно? 1) Амфотерные оксиды взаимодействуют с растворами щелочей; 2) амфотерные гидроксиды реагируют
- 6. 5. Лишняя формула: 1) H2ZnO2; 2) ZnCI2; 3) ZnO; 4) Zn(OH)2. H2ZnO2 и Zn(OH)2 – соответственно
- 7. 6. К амфотерным гидроксидам не относят вещество, имеющее формулу: 1) Be(OH)2; 3) K2[Zn(OH)4]; 2) Pb(OH)2; 4)Cu(OH)2.
- 8. 7. При добавлении избытка раствора гидроксида калия к раствору хлорида алюминия происходят следующие превращения: 1) вначале
- 9. 8. При взаимодействии свежеприготовленного осадка амфотерного гидроксида с избытком щёлочи всегда образуется: 1) средняя соль; 3)
- 10. 9. Свойство аминокислот, обусловленное наличием в их молекуле аминогруппы: 1) Образованием сложных эфиров; 3) взаимодействие со
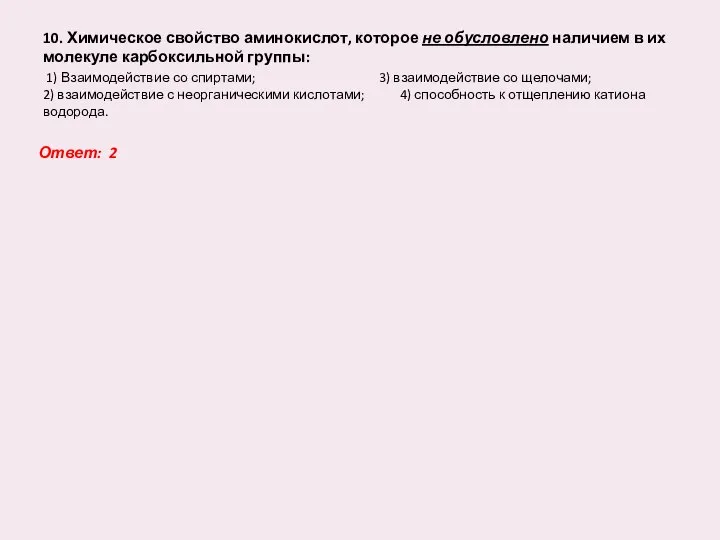
- 11. 10. Химическое свойство аминокислот, которое не обусловлено наличием в их молекуле карбоксильной группы: 1) Взаимодействие со
- 12. 11. Синтетические полиамидные волокна являются производными аминокислот со следующим расположением функциональных групп – аминогруппы – NH2
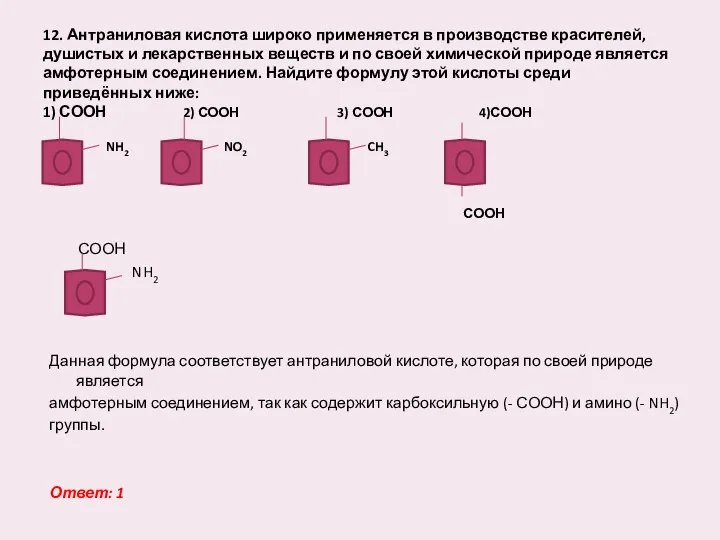
- 13. 12. Антраниловая кислота широко применяется в производстве красителей, душистых и лекарственных веществ и по своей химической
- 14. 13. Поликонденсация приводит к образованию полипептидов. Обратную реакцию называют: 1) деполиконденсация; 3) гидролиз; 2) деполимеризация; 4)
- 15. 14. Молекула воды может являться как донором, так и акцептором протона, превращаясь при этом соответственно в
- 16. 15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ = Zn(OH)2 + 2Н2О соответствует взаимодействию между: 1) гидроксидом
- 17. 16. При пропускании постоянного электрического тока через водный раствор (аланина) частицы растворённого вещества: 1) движутся к
- 18. 17. Элемент, для которого справедливо утверждение: «С увеличением степени окисления элемента в оксиде его характер изменяется
- 19. 18. Органическое вещество лизин имеет следующую формулу: H2N – СH2 - CH2 – CH2 – CH2
- 20. 19. В растворе с рН + NH2 – CH2 – COOH + H+ ↔ NH3 –
- 21. 20. При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется: 1)
- 22. 21. Минерал, не содержащий амфотерного оксида: 1) корунд; 3) сапфир; 2) рубин; 4) криолит. Криолит -
- 23. 22. Амфотерные свойства проявляет вещество, формула которого: 1) H2N – (CH2)6 – NH2; 3) O2N –
- 24. 23. Гидроксид меди (II) растворяется в растворе вещества, формула которого: 1) KOH; 3) NH3; 2) H2SO4;
- 26. Скачать презентацию












![15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ = Zn(OH)2 + 2Н2О](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257652/slide-15.jpg)








 Инсектициды на основе бакуловирусов
Инсектициды на основе бакуловирусов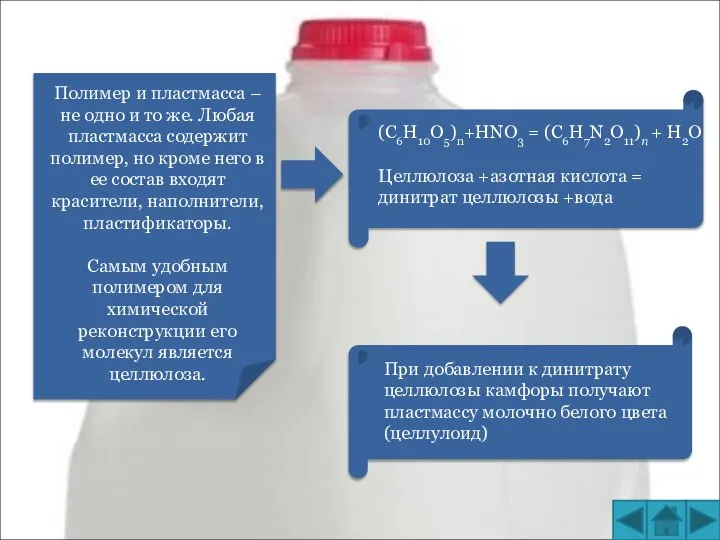 Полимер и пластмасса
Полимер и пластмасса Металлы в нашей жизни
Металлы в нашей жизни Сложные эфиры
Сложные эфиры Металлы и их соединения
Металлы и их соединения Властивості етанової (оцтової) кислоти
Властивості етанової (оцтової) кислоти Елементарний склад живих організмів
Елементарний склад живих організмів Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Протеины: плюсы и минусы
Протеины: плюсы и минусы Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Относительная атомная масса
Относительная атомная масса Биодизельное топливо
Биодизельное топливо Неметалічні елементи
Неметалічні елементи Бромды метил буының концентрациясын анықтау тәсілдемесі
Бромды метил буының концентрациясын анықтау тәсілдемесі Металлдардың кристалдық құрылымы
Металлдардың кристалдық құрылымы Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  Закон постоянства состава веществ
Закон постоянства состава веществ Аргентум (Срібло)
Аргентум (Срібло) Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Растворы электролитов. Буферные растворы. Лекция 4
Растворы электролитов. Буферные растворы. Лекция 4 Аммиак. Физические и химические свойства. Получение и применение
Аммиак. Физические и химические свойства. Получение и применение Обмен железа и его нарушения
Обмен железа и его нарушения Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно
Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно Кетоны
Кетоны Альдегиды. Строение молекулы
Альдегиды. Строение молекулы Элементы третьего периода, периодической системы Д. И. Менделеева
Элементы третьего периода, периодической системы Д. И. Менделеева Нанохімія та нанотехнології
Нанохімія та нанотехнології Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen