Содержание
- 2. Аміа́к, амоніа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре
- 3. Властивості
- 4. Небезпеки 1 3 0
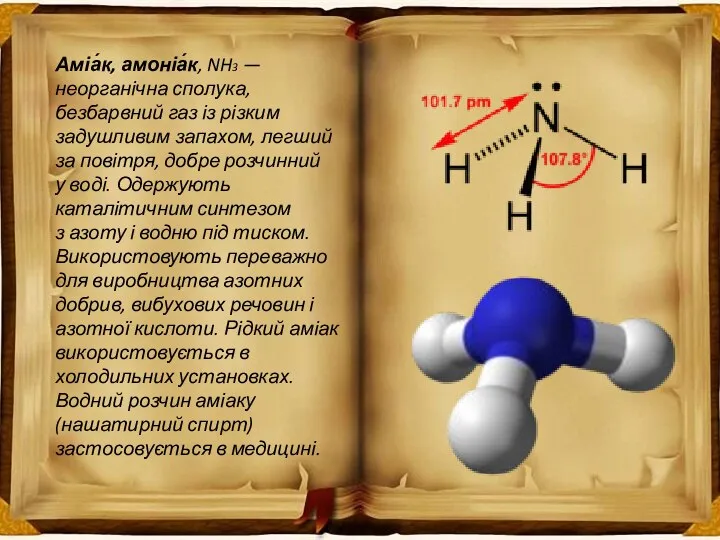
- 5. Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі:
- 6. Зв'язки N — Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому
- 7. При розчиненні аміаку в воді частина його молекул взаємодіє з водневими іонами води з утворенням складного
- 8. Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад:
- 9. В лабораторних умовах аміак добувають звичайно нагріванням суміші хлориду амонію NH4Cl з гашеним вапном Ca(OH)2. Процес
- 10. Амоніак — один з найважливіших продуктів сучасної хімічної промисловості. Головною галуззю його застосування є виробництво нітратної
- 12. Скачать презентацию








 Инертные газы
Инертные газы Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра Топливо. Механические топки
Топливо. Механические топки Ионообменная хроматография
Ионообменная хроматография Рідкі кристали
Рідкі кристали  Презентация по Химии "Проблема вмісту нітратів у харчових продуктах" - скачать смотреть бесплатно
Презентация по Химии "Проблема вмісту нітратів у харчових продуктах" - скачать смотреть бесплатно Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010
Классификация полимеров 11 класс Соловова Е.А., учитель химии высшей квалификационной категории, МОУ СОШ №15 г.Балашов, 2010 Очищение грязной воды
Очищение грязной воды Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит
Используя оксид ртути (II) напишите уравнения реакций при которых возможны следующие превращения: Используя оксид ртути (II) напишит NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Первоначальные химические понятия
Первоначальные химические понятия Химическое равновесие
Химическое равновесие Презентация по Химии "Презентация Кристаллические и аморфные тела" - скачать смотреть
Презентация по Химии "Презентация Кристаллические и аморфные тела" - скачать смотреть  Загальна характеристика ферментів
Загальна характеристика ферментів Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Соли азотной кислоты
Соли азотной кислоты Эфиры. Жиры
Эфиры. Жиры Нефть и газ. Химический состав и свойства
Нефть и газ. Химический состав и свойства Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія
Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія  Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде
Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде Презентация Классификация полимеров 11 класс
Презентация Классификация полимеров 11 класс  Структурная химия и кристаллохимия. Введение
Структурная химия и кристаллохимия. Введение ФКХ-Л2 2016
ФКХ-Л2 2016 Побутові хімікати
Побутові хімікати Класс органических соединений фенолы
Класс органических соединений фенолы Периодическая таблица Д.И. Менделеева. Своя игра
Периодическая таблица Д.И. Менделеева. Своя игра Краткая история химии
Краткая история химии Соединения кремния Силикатная промышленность.
Соединения кремния Силикатная промышленность.