Содержание
- 2. Название вещества может быть обязано оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей.
- 3. По некоторым другим сведениям, этот газ мог получить современное название от древнеегипетского слова «амониан». Так называли
- 4. Название «аммиак», которым мы пользуемся, ввел в обиход в 1801 году русский ученый - химик, академик
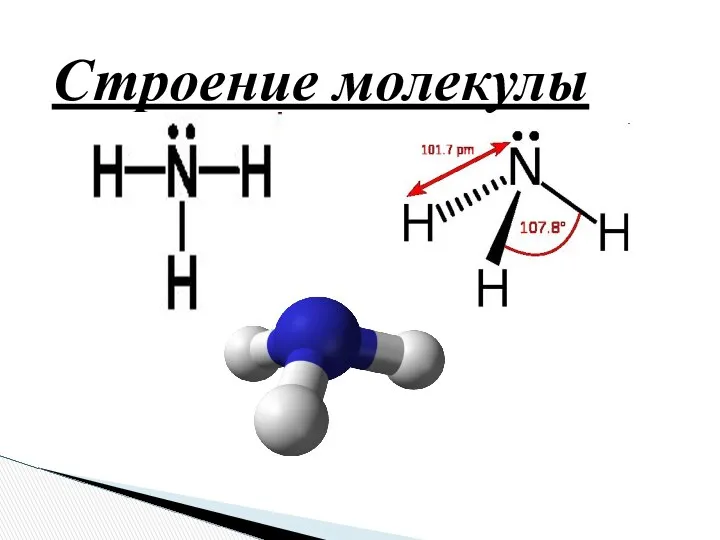
- 5. Строение молекулы
- 6. NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ
- 7. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха
- 8. 1.По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический
- 9. Получение аммиака Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: 2NH4Cl +
- 10. Промышленный способ получения аммиака взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
- 11. 1. С кислородом А) Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 Б)
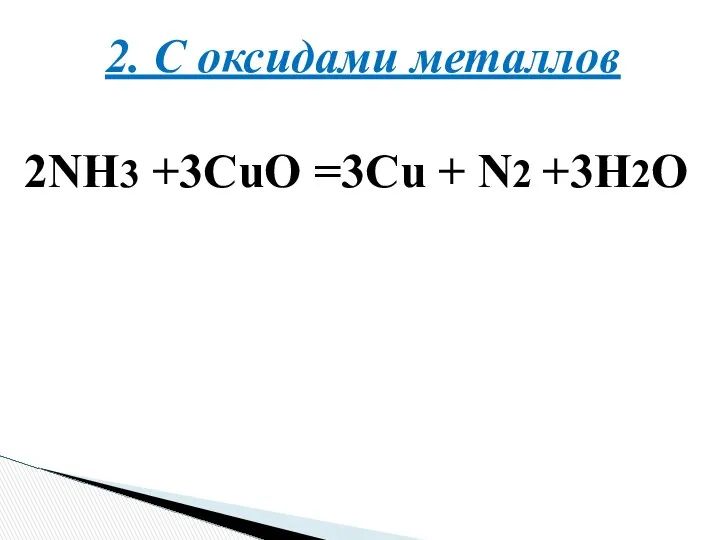
- 12. 2. С оксидами металлов 2NH3 +3CuO =3Cu + N2 +3H2O
- 13. 3. Взаимодействие с кислотами NH3 + HCl → NH4Cl 2NH3 +H2SO4 → (NH4)2SO4
- 14. 4. Взаимодействие с водой NH3 + H2O = NH4OH При добавлении фенолфталеина‑ раствор становится малиновым, так
- 15. Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок
- 16. Применение аммиака Производство пластмасс и волокон 2. В составе моющих средств
- 17. 3. Производство азотных удобрений 4. В сельском хозяйстве
- 18. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 19. 7. В медицине
- 20. По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
- 22. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. При утечке аммиака важно
- 23. Азотная кислота Аммиачнаяселитра Ca(NO3)2 Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиачная вода NH3⋅H2O
- 24. Это интересно Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелеными,
- 25. Аммиак Газообразный Хорошорастворим Восстановитель при горении Образующий соль нашатырь Поражающий слизистые оболочки Поражает растения
- 26. Контроль по теме «Аммиак». Что узнали? 1 уровень 1)Аммиак ____________ растворяется в воде. 2)Раствор аммиака в
- 28. Скачать презентацию






















 Мұнайлардың жіктелуі
Мұнайлардың жіктелуі Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Синтез полимерных комплексонов на основе аминокислот
Синтез полимерных комплексонов на основе аминокислот Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010
Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010 Деление ядер урана
Деление ядер урана  Физические и химические явления
Физические и химические явления Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов
Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов Отношение масс элементов в веществе. Массовые доли элементов в веществе
Отношение масс элементов в веществе. Массовые доли элементов в веществе Витамины и коферменты
Витамины и коферменты Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Алкены
Алкены Моносахариды
Моносахариды Предмет химии. Вещества
Предмет химии. Вещества Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования
Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования Метод изолирования Васильевой
Метод изолирования Васильевой Галогены
Галогены Хімія в побуті
Хімія в побуті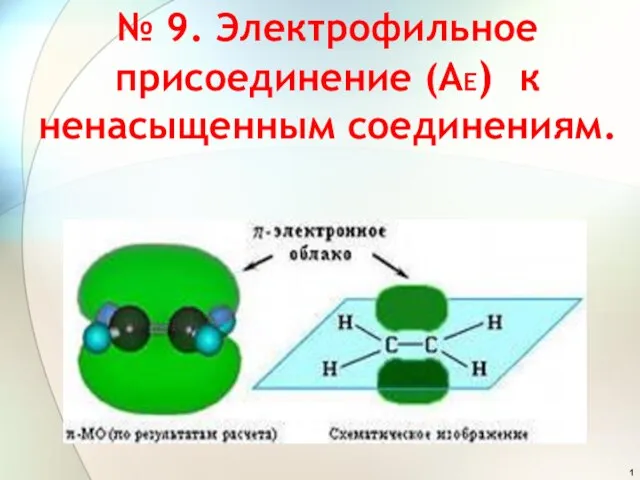 Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.
Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.  Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Використання вуглеводнів
Використання вуглеводнів Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Алканы: изомерия и номенклатура
Алканы: изомерия и номенклатура Презентация по Химии "Закон збереження маси" - скачать смотреть
Презентация по Химии "Закон збереження маси" - скачать смотреть