Содержание
- 2. План 1. Количественный анализ. Задачи и методы количественного анализа. 2. Общая характеристика титриметрических методов анализа. Понятие
- 3. Предмет аналитической химии Аналитическая химия – наука о методах определения качественного и количественного состава веществ или
- 4. 1. Количественный анализ. Задачи и методы количественного анализа Раздел аналитической химии, изучающий методы определения количественного содержания
- 5. 2. Общая характеристика титриметрических методов анализа. Понятие о титровании. Титриметрический метод - метод количественного анализа, основанный
- 6. Титрованные растворы – растворы с известной концентрацией - титром. Эти растворы называют рабочими растворами – титрантами.
- 7. Методы титриметрического анализа: В основе классификации лежат реакции, применяемые при титровании. 1. Метод нейтрализации – в
- 8. 3. Метод осаждения - в основе метода лежит реакция осаждения ионов в виде труднорастворимых соединений. Ag+
- 9. Условия титриметрического анализа 1. Точное измерение объемов реагирующих веществ. 2. Приготовление растворов точно известной концентрацией, с
- 10. Требования к реакциям титрования 1. Реакция должна проходить количественно, по определённому уравнению, без побочных реакций. 2.
- 11. Способы титрования А) прямое - при титровании используется один рабочий раствор, реакция идет между рабочим раствором
- 12. В) титрование заместителя – используются два рабочих раствора. Первый рабочий раствор вступает в реакцию с определяемым
- 13. 3. Индикаторы Вещества, окраска которых меняется в зависимости от рН среды. Индикаторы – это слабые органические
- 14. 14
- 15. 4. Стандартные и стандартизированные растворы Каким бы методом не проводилось титрование, в нем используются: - титрованный
- 16. 5. Кислотно-основное титрование Основные положения метода Объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям: V1
- 17. 6. Вычисления в титриметрическом анализе Формулы для расчета: рН раствора слабой кислоты рН раствора слабого основания
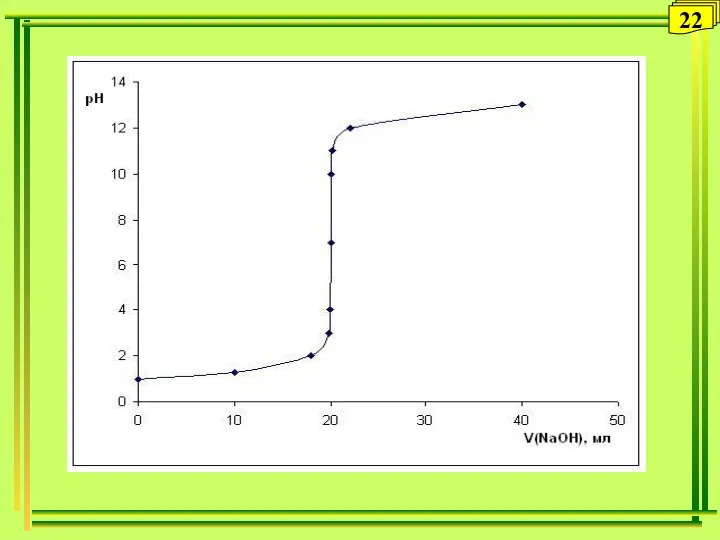
- 18. Вычисления в титриметрическом анализе (продолжение) Расчет кривой титрования сильной кислоты сильным основанием 1-я точка. Возьмем 100
- 19. продолжение: 4-я точка. Добавим еще 0,9 мл (всего 99,9 мл ) 0,1 М раствора NaOH ,
- 20. продолжение: 6-я точка. Добавим еще 0,01 мл 0,1 М раствора NaOH (всего 100,01 мл), объем раствора
- 21. Продолжение: 8-я точка. Добавим еще 0,9 мл (всего 101 мл ) 0,1 М раствора NaOH. избыток
- 22. 22
- 23. 6. Вычисления в титриметрическом анализе (продолжение) Расчет кривой титрования сильной кислоты слабым основанием рН буферной смеси
- 24. 24
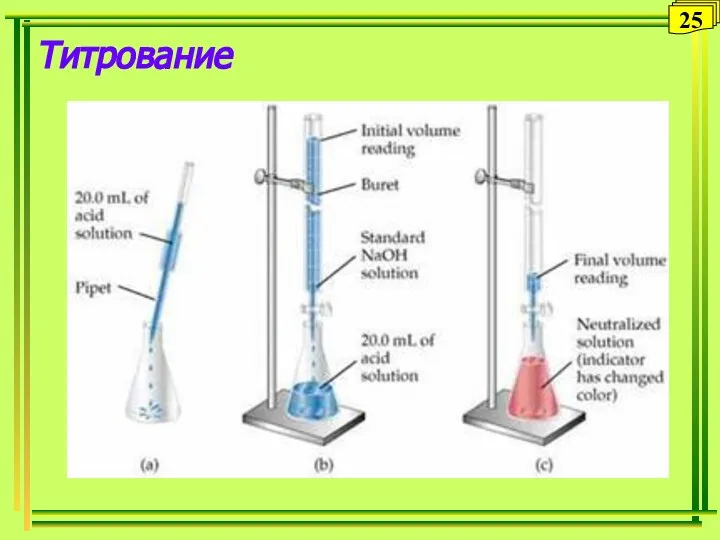
- 25. Титрование 25
- 27. Скачать презентацию





















 Каталитический крекинг
Каталитический крекинг Валетные состояния атома углерода
Валетные состояния атома углерода Типы метаморфизма
Типы метаморфизма Рідкісні кристали і полімери. Їх властивості та застосування
Рідкісні кристали і полімери. Їх властивості та застосування Понятие о композиционных материалах. Лекция 2
Понятие о композиционных материалах. Лекция 2 Электрофильные реакции
Электрофильные реакции Губна помада та ії призначення
Губна помада та ії призначення Презентация по Химии "Комплексные соединения: строение, изомерия, использование в онкологии" - скачать смотреть
Презентация по Химии "Комплексные соединения: строение, изомерия, использование в онкологии" - скачать смотреть  Углерод, аллотропные модификации
Углерод, аллотропные модификации Ацетилен и его гомологи
Ацетилен и его гомологи Уксусная кислота
Уксусная кислота Характеристика ядов, изолируемых минерализацией в клинической фармации
Характеристика ядов, изолируемых минерализацией в клинической фармации Многоатомные спирты
Многоатомные спирты Растворы. Классификация
Растворы. Классификация Химическая промышленность
Химическая промышленность Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния
Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния Кадмий
Кадмий Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот Насыщенные углеводороды
Насыщенные углеводороды Хімія в житті суспульства
Хімія в житті суспульства Мұнай. Мұнайдың химиялық құрамы
Мұнай. Мұнайдың химиялық құрамы Минерал гранат
Минерал гранат Растворы. Определения и понятия
Растворы. Определения и понятия Геохимические классификации элементов
Геохимические классификации элементов Углеводный обмен
Углеводный обмен Прості й складні речовини. Хімічні формули
Прості й складні речовини. Хімічні формули  Физико-химиеские методы анализа (ФХМА)
Физико-химиеские методы анализа (ФХМА)