Содержание
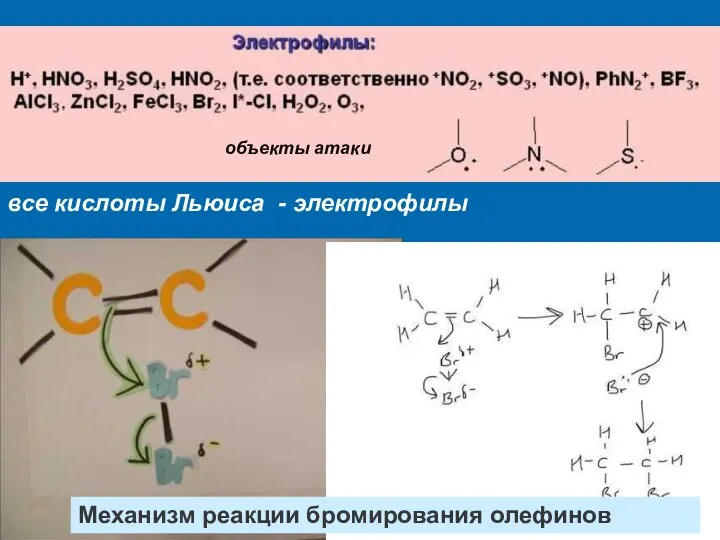
- 2. все кислоты Льюиса - электрофилы объекты атаки Механизм реакции бромирования олефинов
- 3. электрофильные реакции substitution electrophilic reaction замещения, присоединения, отщепления SE1, SE2 SEAr addition electrophilic reaction AdE2 AdE1
- 4. электрофильные реакции substitution electrophilic reaction замещения SE1, SE2 SEAr для алифатического ряда соединений это малая группа
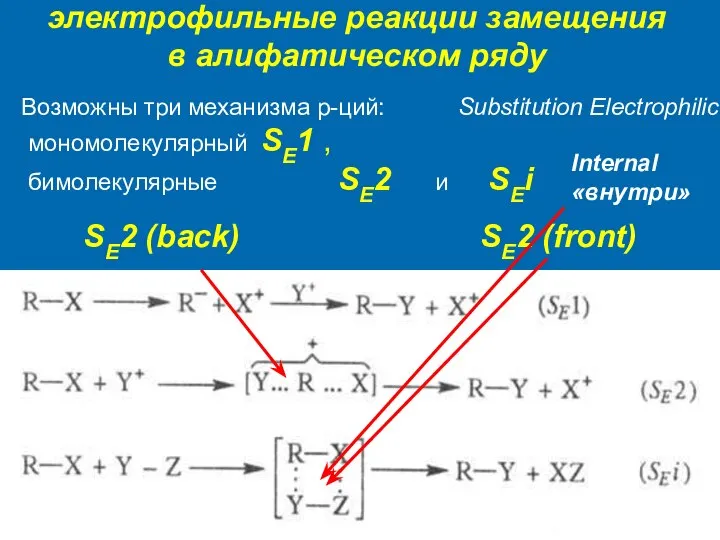
- 5. электрофильные реакции замещения в алифатическом ряду Substitution Electrophilic и SEi Internal «внутри» Возможны три механизма р-ций:
- 6. электрофильные реакции замещения в алифатическом ряду SE2 (front) SEi Internal «внутри»
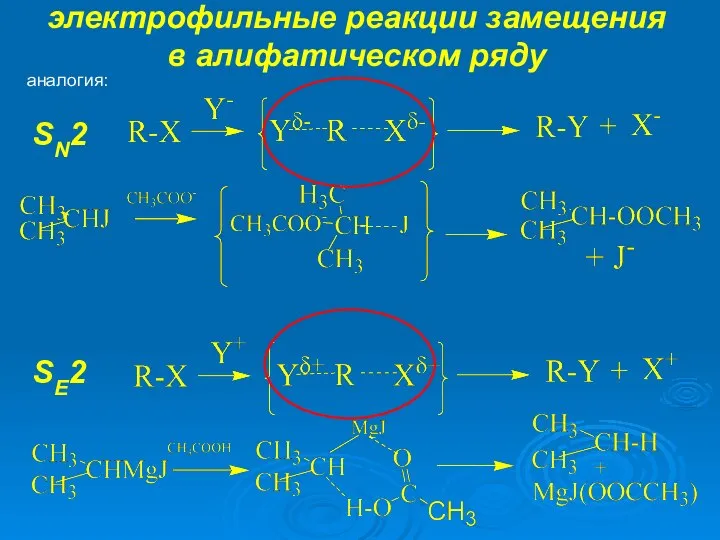
- 7. аналогия: SE1 SE2 SN1 SN2 электрофильные реакции замещения в алифатическом ряду
- 8. В чем различие?: SE1 SN1 электрофильные реакции замещения в алифатическом ряду примеры
- 9. аналогия: SE2 SN2 электрофильные реакции замещения в алифатическом ряду
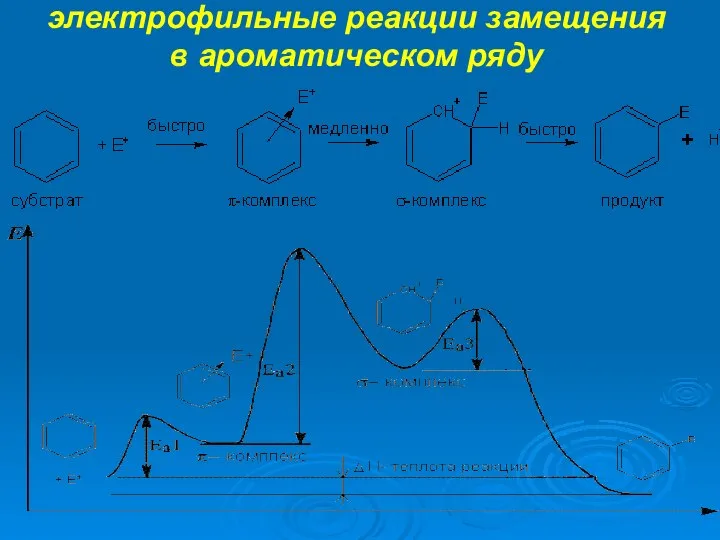
- 10. электрофильные реакции замещения в ароматическом ряду
- 11. электрофилы электрофильные реакции замещения в ароматическом ряду нитрование сульфирование
- 12. электрофильные реакции замещения в ароматическом ряду
- 13. МО орбитали бензола ϕ(Е(+)) ? МО орбиталь электрофила Геометрия π комплекса
- 15. Электрофильные реакции Электрофильное замещение в ароматических системах
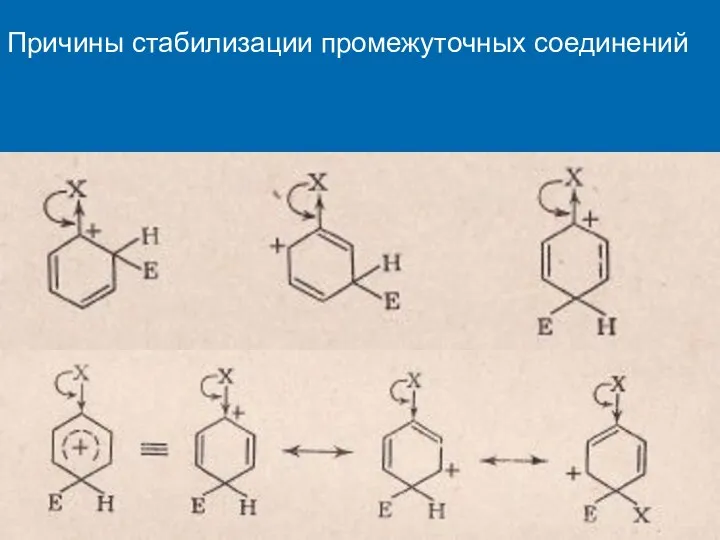
- 16. Причины стабилизации промежуточных соединений
- 17. Причины стабилизации промежуточных соединений
- 18. Правила ориентации в бензольном кольце
- 20. электрофильные реакции присоединения addition electrophilic reaction AdE2 AdE1
- 21. Реакционная способность ненасыщенных систем акцептор донор электрофильные реакции присоединения AdE1, 2
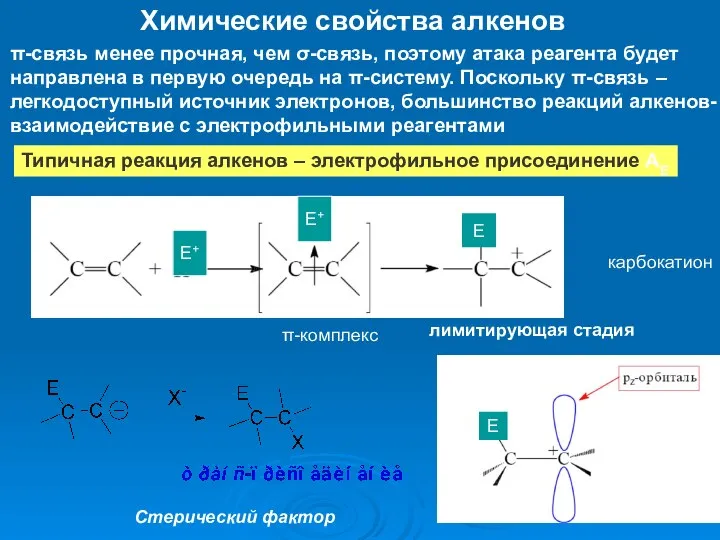
- 22. Химические свойства алкенов π-связь менее прочная, чем σ-связь, поэтому атака реагента будет направлена в первую очередь
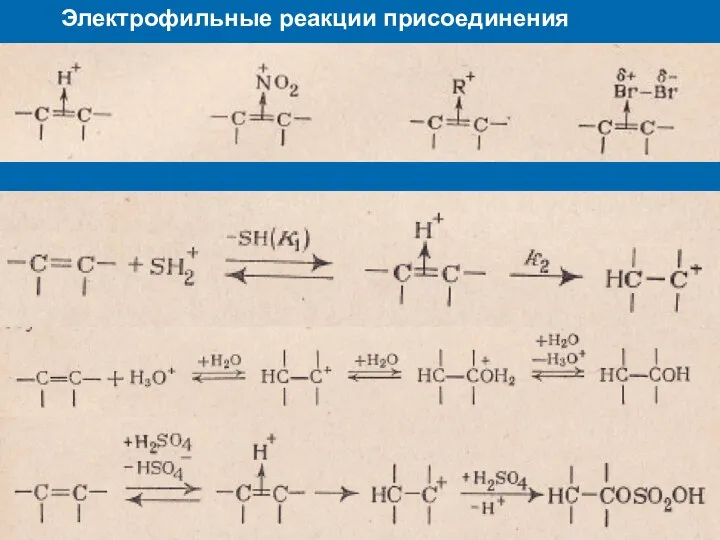
- 23. Электрофильные реакции присоединения Присоединение по двойной связи
- 24. Электрофильные реакции присоединения
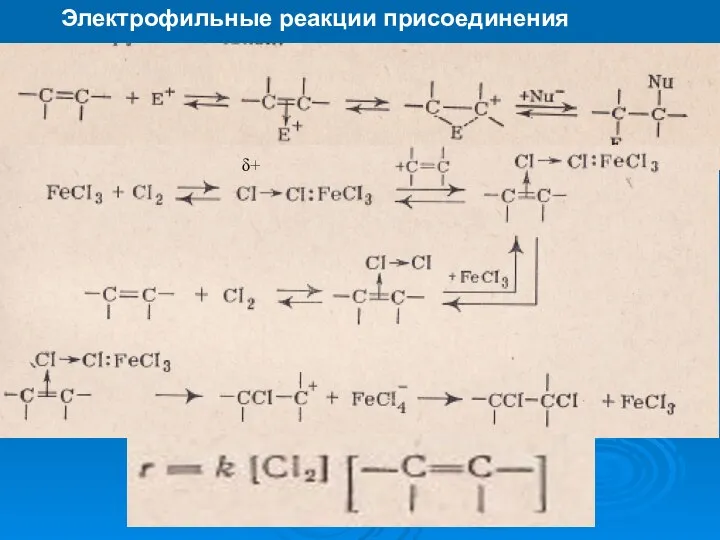
- 25. Электрофильные реакции присоединения δ+
- 26. Электрофильные реакции присоединения промежуточный продукт Активированный комплекс
- 27. Электрофильные реакции присоединения
- 28. Взаимодействие с карбенами Карбены, являясь по сути электрофильными агентами, способны присоединяться по С=С-связи алкенов с образованием
- 29. Направление электрофильного присоединения Присоединение электрофила по кратной связи непредельного соединения происходит с образованием наиболее устойчивого карбокатиона
- 30. Электрофильные реакции присоедиения Реакционная способность ненасыщенных систем ?
- 31. Основные закономерности гидратации алкенов: 1. Кислотный катализ. Присоединение инициируется протоном; 2. Обратимость процесса гидратации; 3. Лимитирующая
- 32. Присоединение воды (гидратация) Присоединение Н2О по С=С-связи – обратный процесс дегидратации спиртов Катализ осуществляют H2SO4 Реакция
- 33. Электрофильные реакции Реакционная способность ненасыщенных систем кислотная изомеризация
- 34. Электрофильные реакции ацетиленов
- 35. Электрофильные реакции Присоединение к ацетилену
- 36. Nu : E (+) Общность и различие нуклеофильной и электрофильной атаки на олефин
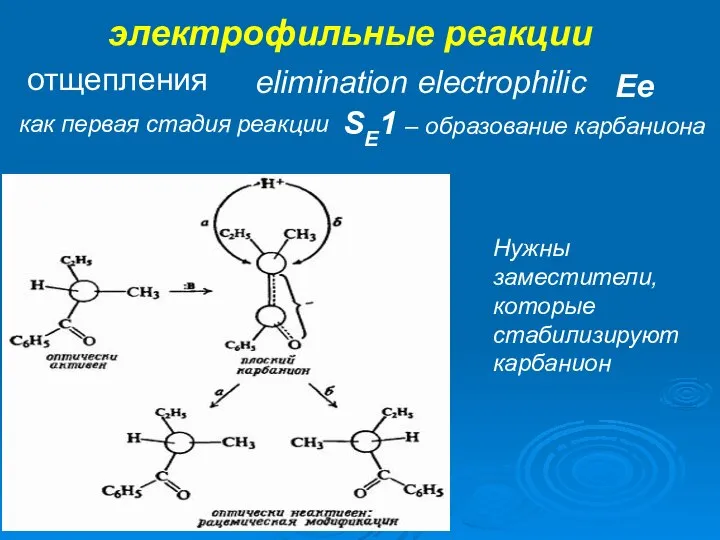
- 37. электрофильные реакции отщепления elimination electrophilic Ee как первая стадия реакции SE1 – образование карбаниона Нужны заместители,
- 38. электрофильные реакции отщепления elimination electrophilic Ee как первая стадия реакции SE1 – образование карбаниона Нужны заместители,
- 40. Скачать презентацию




























 Гидролиз. Сущность процесса гидролиза
Гидролиз. Сущность процесса гидролиза Нитраты и нитриты. Азотные удобрения
Нитраты и нитриты. Азотные удобрения Кругообіг Нітрогену
Кругообіг Нітрогену  Химические реактивы
Химические реактивы Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Алканы. Алкены. Алкины. Задачи урока:
Алканы. Алкены. Алкины. Задачи урока:  Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Пищевые красители
Пищевые красители Презентация по Химии "Классификация реакций в неорганической химии." - скачать смотреть бесплатно_
Презентация по Химии "Классификация реакций в неорганической химии." - скачать смотреть бесплатно_ «Уксусная кислота»
«Уксусная кислота»  Физико-химическая и механическая миграция
Физико-химическая и механическая миграция Титан. Структура, применение, свойства (11 класс)
Титан. Структура, применение, свойства (11 класс)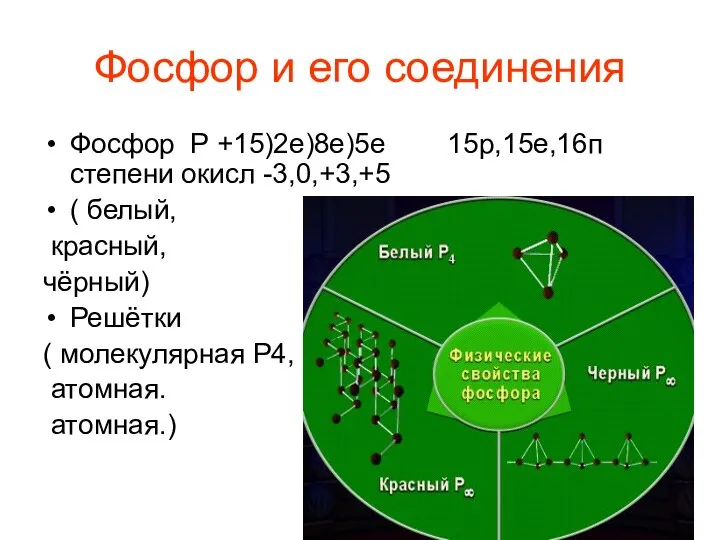 Фосфор и его соединения
Фосфор и его соединения Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Янтарь – солнечный камень. Рассказ об удивительном минерале
Янтарь – солнечный камень. Рассказ об удивительном минерале Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Галогены: Хлор, бром, иод
Галогены: Хлор, бром, иод Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Введение в обмен веществ. Метаболические пути
Введение в обмен веществ. Метаболические пути Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Тема урока "Круговорот углерода в природе и последствия его нарушения« Учитель биологии Рабаданова Светлана Ивановна МОУ Лиц
Тема урока "Круговорот углерода в природе и последствия его нарушения« Учитель биологии Рабаданова Светлана Ивановна МОУ Лиц Қызықты химия
Қызықты химия Основы химической кинетики
Основы химической кинетики Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза