Содержание
- 2. Цель урока Дать понятие о химическом и электронном строении бензола. Ознакомиться с химическими свойствами бензола, обусловленными
- 3. Содержание Ароматические углеводороды Строение бензола Физические свойства Изомерия Химические свойства аренов Реакции замещения Реакции присоединения Реакции
- 4. Ароматические соединения (от греч. árômа — благовоние), класс органических циклических соединений, все атомы которых участвуют в
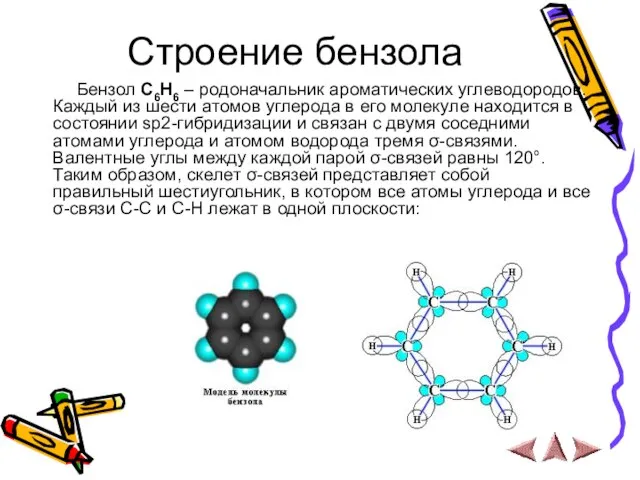
- 5. Строение бензола Бензол С6Н6 – родоначальник ароматических углеводородов. Каждый из шести атомов углерода в его молекуле
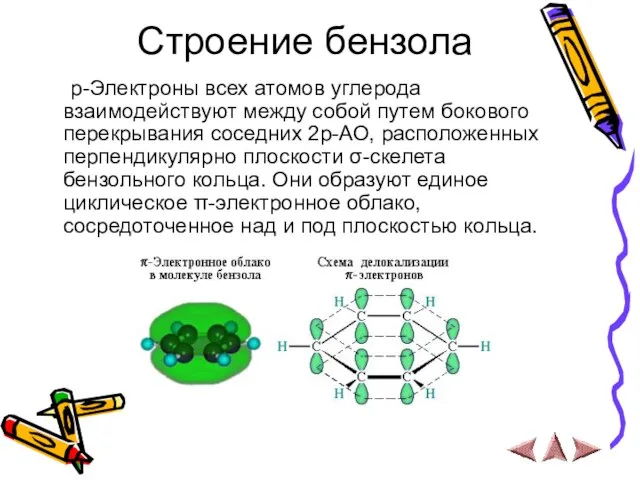
- 6. Строение бензола р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно
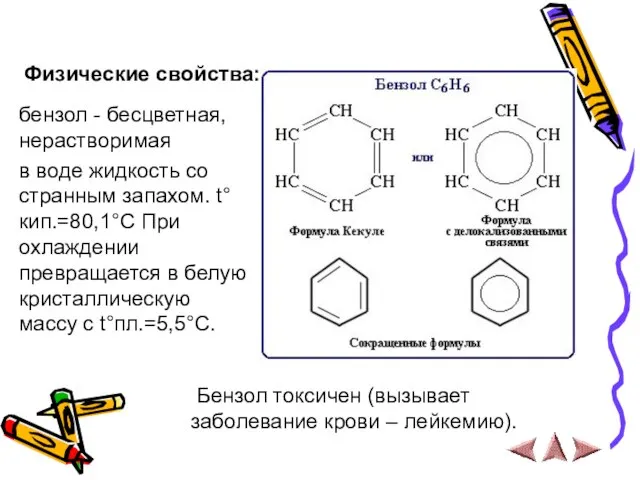
- 7. Физические свойства: бензол - бесцветная, нерастворимая в воде жидкость со странным запахом. t°кип.=80,1°C При охлаждении превращается
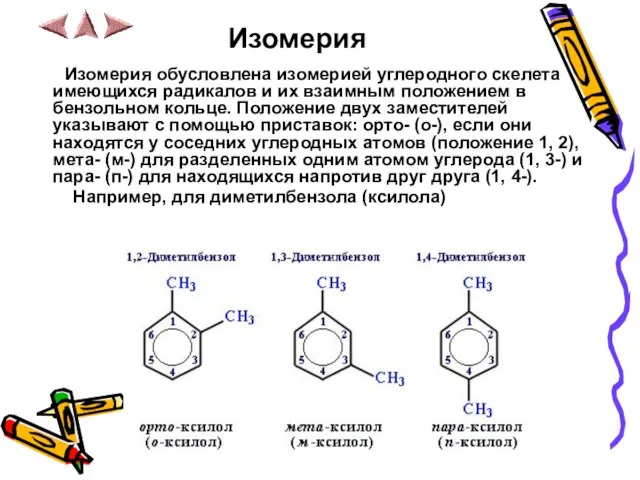
- 8. Изомерия Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение
- 9. Химические свойства аренов Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям
- 10. Реакции замещения. 1) Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода
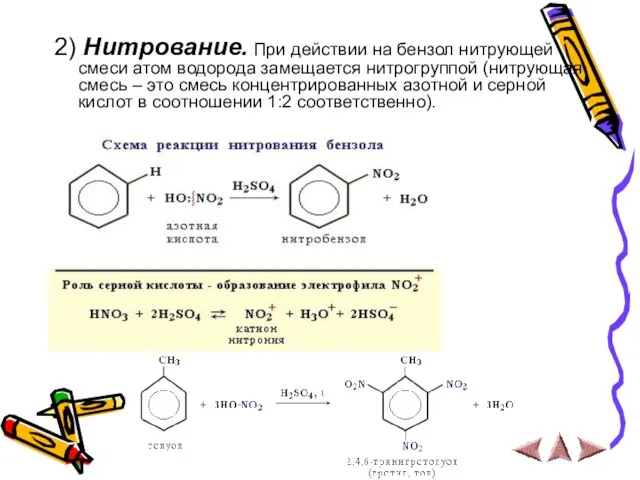
- 11. 2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это
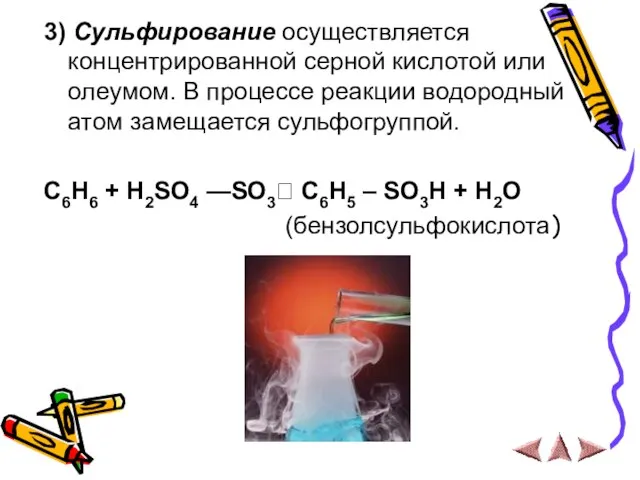
- 12. 3) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный атом замещается сульфогруппой. C6H6
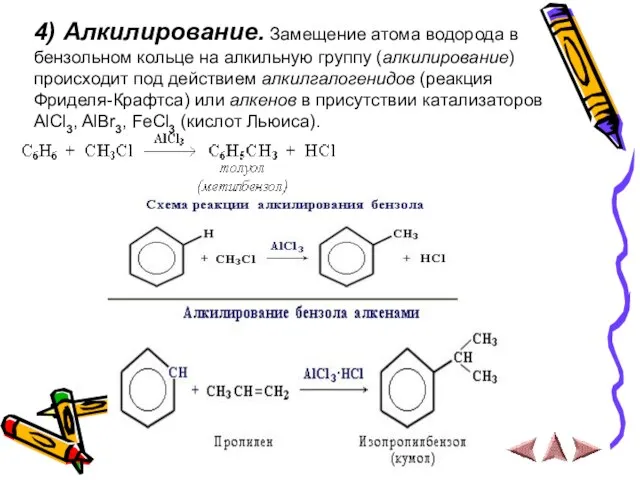
- 13. 4) Алкилирование. Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов
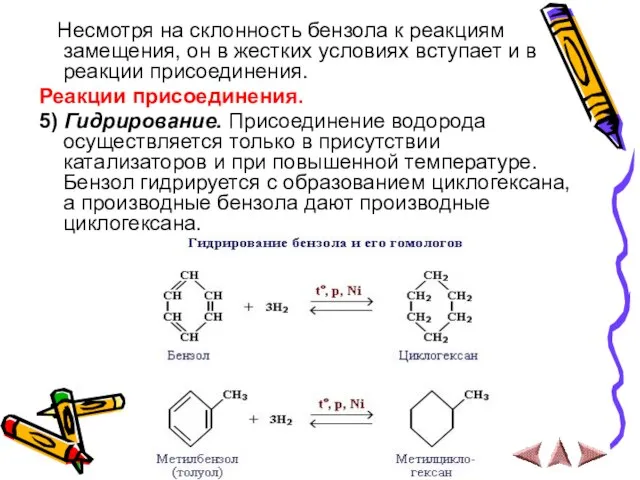
- 14. Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
- 15. 6) Галогенирование. Радикальное хлорирование В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к
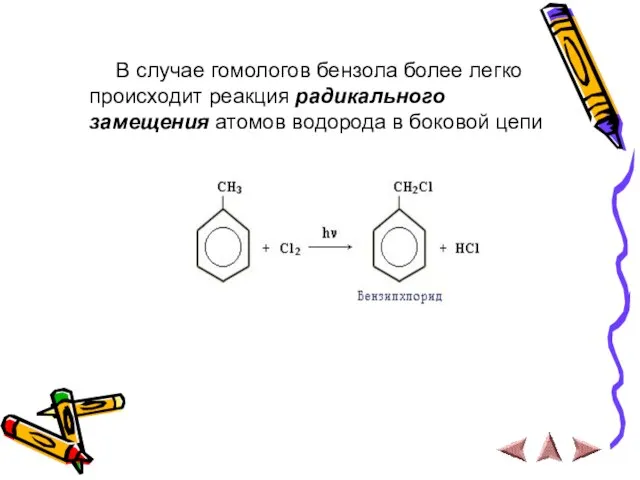
- 16. В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи
- 17. Запомните Если в молекуле бензола один из атомов водорода замещен на углеводородный радикал, то в дальнейшем
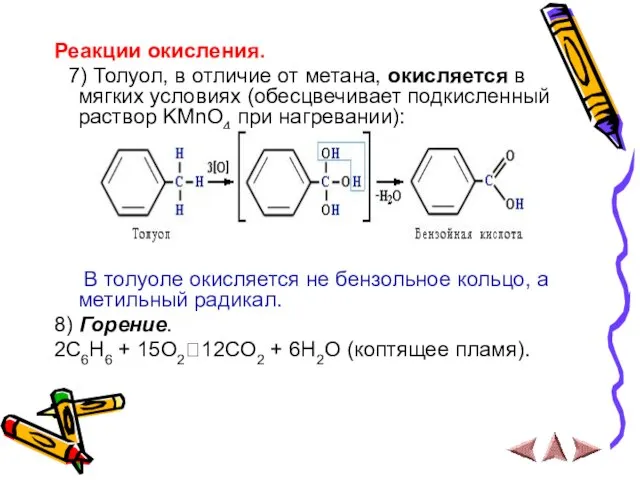
- 18. Реакции окисления. 7) Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4
- 19. 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется
- 20. 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский). 3C2H2 ––600°C→ C6H6
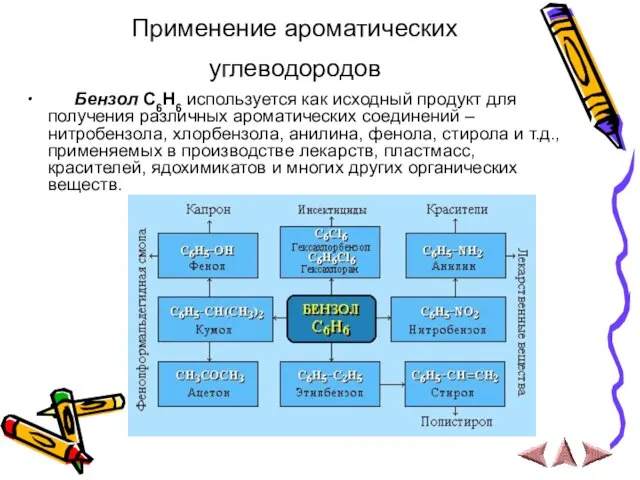
- 21. Применение ароматических углеводородов Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола,
- 22. Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С6Н4(СН3)2 в виде
- 23. Литература 1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./ Под ред. Петрова
- 24. 5. Оганесян Э.Т. Руководство по химии поступающим в вузы. Справочное пособие. – М.: Высшая школа,1991. 6.
- 26. Скачать презентацию












 Комплексные соединения. Природа химической связи: метод молекулярных орбиталей
Комплексные соединения. Природа химической связи: метод молекулярных орбиталей Реакции ионного обмена
Реакции ионного обмена Сабақтың тақырыбы: Сутек. Сутектің табиғатта таралуы және алынуы.
Сабақтың тақырыбы: Сутек. Сутектің табиғатта таралуы және алынуы.  Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Химия. Введение
Химия. Введение Железо Fe. Строение атома
Железо Fe. Строение атома Халькогены. Кислород в природе
Халькогены. Кислород в природе Презентация по Химии "РАЗРАБОТКИ УЛЬТРАДИСПЕРСНЫХ (НАНО-) МАТЕРИАЛОВ И НАНОТЕХНОЛОГИЙ В АТОМНОЙ ОТРАСЛИ" - скачать смотреть б
Презентация по Химии "РАЗРАБОТКИ УЛЬТРАДИСПЕРСНЫХ (НАНО-) МАТЕРИАЛОВ И НАНОТЕХНОЛОГИЙ В АТОМНОЙ ОТРАСЛИ" - скачать смотреть б Презентация по Химии "Биогенные элементы" - скачать смотреть бесплатно
Презентация по Химии "Биогенные элементы" - скачать смотреть бесплатно Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Э.М. Спиридонов. Эволюция минералов олова в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов олова в зоне гипергенеза Углерод и 4 группа
Углерод и 4 группа Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Регуляция и интеграция обмена веществ
Регуляция и интеграция обмена веществ Урок у 8 класі на тему: «Класифікація неорганічних сполук» Учитель хімії Верхівцевського НВК Кукса Наталія Миколаї
Урок у 8 класі на тему: «Класифікація неорганічних сполук» Учитель хімії Верхівцевського НВК Кукса Наталія Миколаї Воздух. Состав воздуха. Реакция горения
Воздух. Состав воздуха. Реакция горения Взаимосвязь неорганических веществ
Взаимосвязь неорганических веществ Волокна підготував учень 11 класу :
Волокна підготував учень 11 класу :  Железо и его соединения
Железо и его соединения Коэффициент концентрации меди
Коэффициент концентрации меди Карбонат натрия
Карбонат натрия Гетерофункционалды органикалық қосылыстар
Гетерофункционалды органикалық қосылыстар Структура и текстура магматических пород
Структура и текстура магматических пород Electron Structure
Electron Structure Биосинтез белков в живой клетке Продолжить формирование знаний об основных процессах метаболизма; охарактеризовать два этапа би
Биосинтез белков в живой клетке Продолжить формирование знаний об основных процессах метаболизма; охарактеризовать два этапа би Альдегиды. Кетоны
Альдегиды. Кетоны Свойство воды, устранение жесткости воды и очистка воды
Свойство воды, устранение жесткости воды и очистка воды Сурьма, Sb
Сурьма, Sb