Содержание
- 2. Задачи: Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс
- 3. Происхождение названия Ferrum от латинского fers - быть твердым, что в свою очередь происходит от санскритского
- 4. Вопросы по теме «Железо и его соединения» Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие
- 5. Вопросы по теме «Железо и его соединения» Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите
- 6. Качественные реакции на Fe 2+ FeCl2+2NaOH?Fe(OH)2 + 2NaCl зеленый 2. FeCl2 + K3(Fe(CN)6) ? красная кровяная
- 7. Качественные реакции на Fe 3+ FeCl3+3NaOH?Fe(OH)3 + 3NaCl бурый 2. FeCl3 + K4(Fe(CN)6) ? желтая кровяная
- 8. Качественные реакции на Fe 3+ 3. FeCl3 + KCNS ? Fe(CNS)3 +3KCl роданид калия
- 9. “Порядок ли у вас с железом”. 1. Часто ли вы чувствуете усталость и подавленность? 2. Произошли
- 10. Основные источники железа: Зеленные овощи; Яичный желток; Печень; Горошек зеленый; Томаты сырые; Капуста; Чеснок; Яблоки, груши;
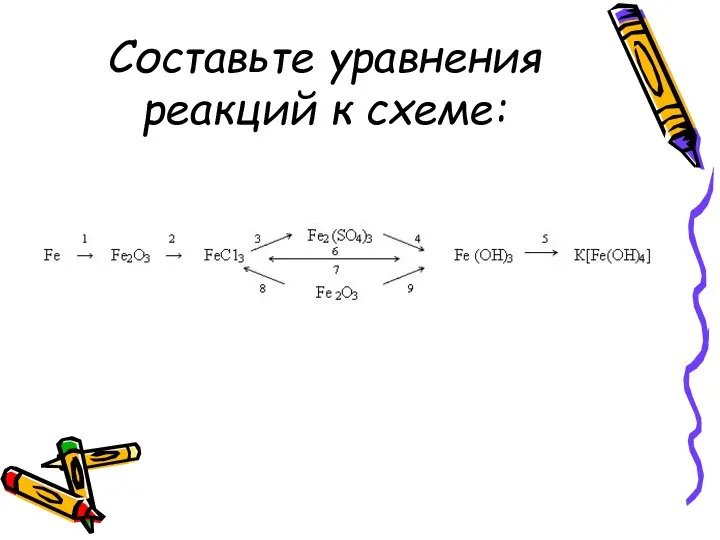
- 11. Составьте уравнения реакций к схеме:
- 12. Составьте электронный баланс: 1. FeCl3 + H2S ? FeCl2 + S +HCl 2. FeSO4 + K2Cr2O7
- 13. Проверьте себя!
- 14. Домашнее задание: §83-84, читать; Записи в словаре выучить; Задание №2 страница 292 (письменно)
- 16. Скачать презентацию












 Хроматография
Хроматография Презентация Коррозия
Презентация Коррозия Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко
Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Кислоты в свете ТЭД
Кислоты в свете ТЭД Вуглецеві матеріали
Вуглецеві матеріали Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф
Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф  Коллоидная химия
Коллоидная химия Превращение веществ
Превращение веществ Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Платина. Свойства
Платина. Свойства Дифузія у побуті
Дифузія у побуті Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Атомы. Молекулы. Ионы
Атомы. Молекулы. Ионы Химическая связь
Химическая связь КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Осадительное титрование. (Лекция 11)
Осадительное титрование. (Лекция 11) Задачи в школьном курсе химии
Задачи в школьном курсе химии 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Альдегидтер және кетондар
Альдегидтер және кетондар Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение
Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение Обмен нуклеотидов
Обмен нуклеотидов Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Аминокислоты. Белки
Аминокислоты. Белки