Содержание
- 2. Цели презентации: научить школьников составлять ионные уравнения реакций; рассмотреть условия протекания реакций ионного обмена до конца;
- 3. Методические рекомендации Слайд 6. Определение условий прохождения реакций «до конца» (курсор наводим на стаканы –клик). Выпадение
- 4. Реакции ионного обмена
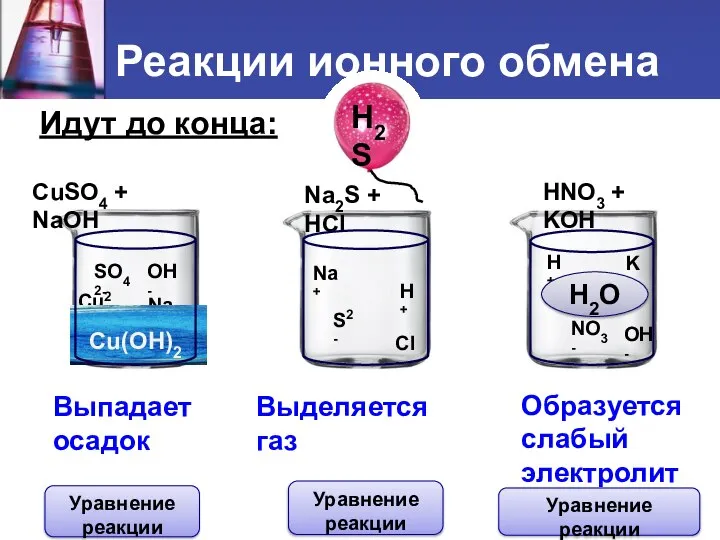
- 6. Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH-
- 7. Алгоритм составления уравнений Молекулярное уравнение CuSO4+2NaOH = Cu(OH)2 + Na2SO4 Полное ионное уравнение Сокращенное ионное уравнение
- 8. Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые основания
- 9. Выключить поиск Включить поиск Обозначения Баженов А.А. Баженов А.А. _ Р Р _ Р М Н
- 10. Составление уравнений Молекулярное уравнение Na2S+2HCl = H2S + 2NaCl Полное ионное уравнение Сокращенное ионное уравнение Na
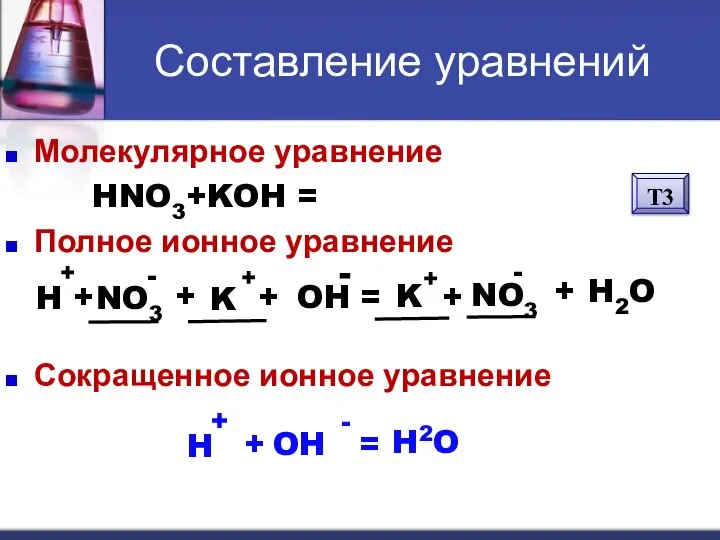
- 11. Составление уравнений Молекулярное уравнение HNO3+KOH = KNO3 + H2O Полное ионное уравнение Сокращенное ионное уравнение H
- 12. Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые и
- 13. Обратимые реакции Na2SO4 + KNO3 Na+ SO42- K+ NO3- 1.Нет осадка 2.Не выделяется газ 3.Не образуется
- 14. Составление уравнений Молекулярное уравнение Na2SO4+2KNO3 2NaNO3 + K2SO4 Полное ионное уравнение 2Na + + SO4 2-
- 15. Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием осадка: 1.SO42-и H+ ;
- 16. В каких случаях РИО идут до конца Молодец Молодец Молодец Ошибка Ошибка Молодец Na2CO3 + HNO3
- 17. Сокращенное ионное уравнение реакции соответствует взаимодействию: 2H+ + CO32- = CO2 + H2O 1.2HNO3 + CaCO3
- 18. Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3 + 6H+ = 2Al3+ + 6H2O 1.Al2O3 + 3CO2
- 19. Назовите числа правильных ответов 1.Выберите ряд, в котором каждое вещество не записывается в виде ионов при
- 20. Применение Ионитами называют вещества или материалы, способные к обмену ионов при соприкосновении с растворами электролитов Иониты
- 21. Применение ионитов Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие,
- 22. Применение ионитов В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина,
- 23. Применение ионитов Для извлечения металлов С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд.
- 24. Применение ионитов В медицине: 1.Для увеличения сроков хранения крови. 2.Для производства, выделения и очистки антибиотиков. 3.Использование
- 25. Интернет -ресурсы http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.) http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан) http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик) http://do.gendocs.ru/docs/index-265718.html (лестница успеха) http://ru.123rf.com/photo_8623287_3d-human-ladder-wall-success-business-up-red.html (человечек с
- 26. Интернет -ресурсы http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови) http://youreld.clan.su/?page2(пенициллин) http://ogorod01.narod.ru/obschie_podkormka_rasteniy.html (растение) http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин) http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)
- 28. Скачать презентацию























 Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.
Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.  Мыс. Мыс көзі
Мыс. Мыс көзі Какое свойство кожуры апельсина помогает держать его на поверхности воды
Какое свойство кожуры апельсина помогает держать его на поверхности воды Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Порфирины. Производные порфина. (Лекция 14)
Порфирины. Производные порфина. (Лекция 14) Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна
Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна  Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура
Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура Презентация по Химии "Химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Химическая связь" - скачать смотреть бесплатно Хімічні методи підвищення продуктивності свердловини
Хімічні методи підвищення продуктивності свердловини Введение. Теория строения органических соединений А.М.Бутлерова. Лекция 1-2
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция 1-2 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Простые вещества - металлы
Простые вещества - металлы Дисперсная система
Дисперсная система Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Химия и биохимия игристых вин
Химия и биохимия игристых вин Истрия развития химии
Истрия развития химии Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Введение в экологическую токсикологию
Введение в экологическую токсикологию Физическая и коллоидная химия
Физическая и коллоидная химия Геология полезных ископаемых
Геология полезных ископаемых Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Предельные углеводороды
Предельные углеводороды Гліцерин. Загальні відомості про гліцерин
Гліцерин. Загальні відомості про гліцерин Определение валентности элементов
Определение валентности элементов Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють
Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють Подготовила воспитанница 11 «А» класса Кулишова Валерия
Подготовила воспитанница 11 «А» класса Кулишова Валерия