Содержание
- 2. 1.Буферные системы (или буферы) – - это растворы, обладающие свойством сохранять постоянство концентрации водородных ионов (рН)
- 3. Расчет рН буферных систем (уравнения Гендерсона – Гассельбаха) - для систем I типа - для систем
- 4. Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и
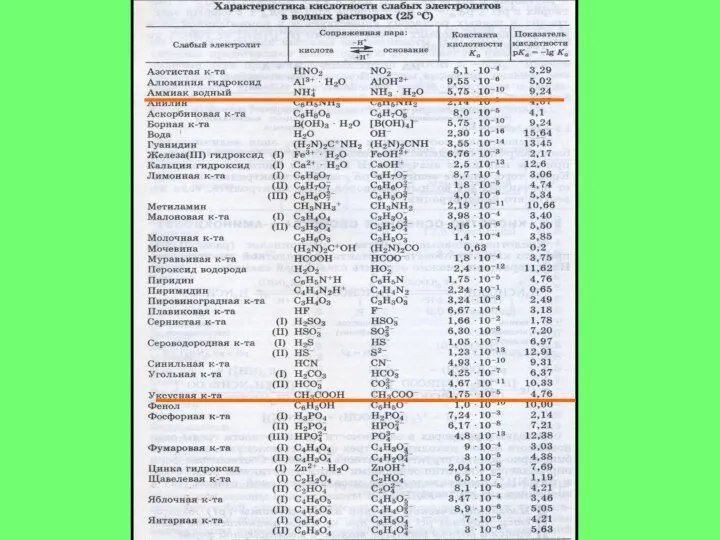
- 5. Протолитическая теория (1923г. И Бренстед, Т.Лори) КИСЛОТА – вещество, молекулярные частицы которого ( в т.ч. и
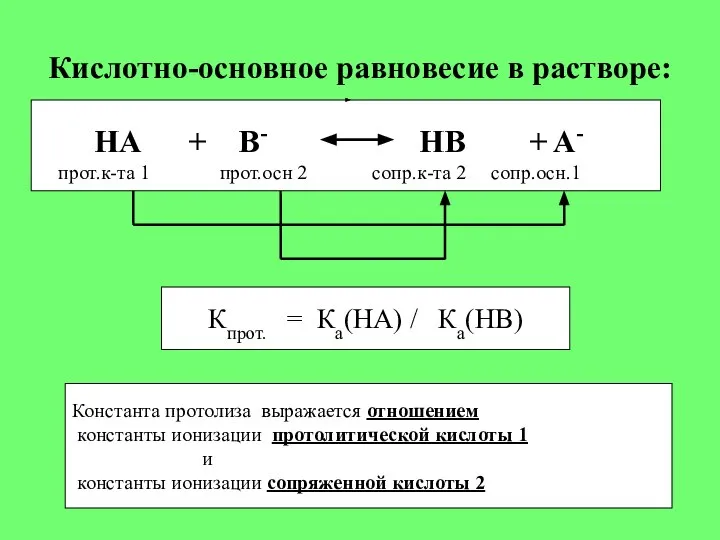
- 6. Кислотно-основное равновесие в растворе: HA + B- HB + A- прот.к-та 1 прот.осн 2 сопр.к-та 2
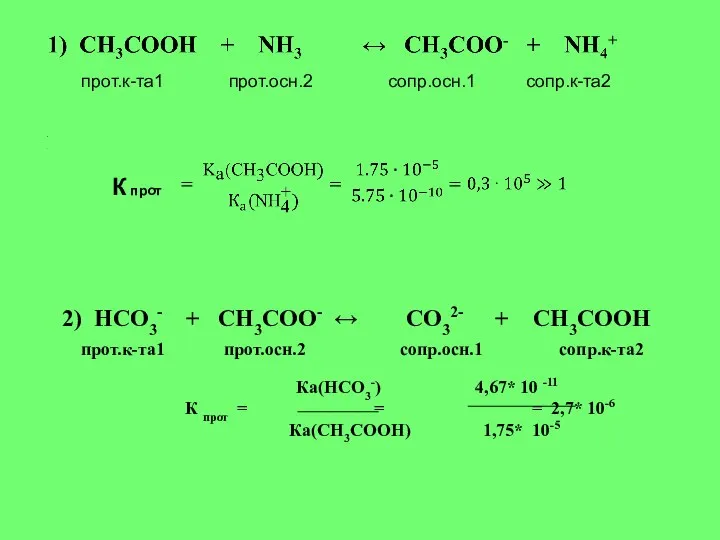
- 7. 2) НСО3- + СН3СОО- ↔ СО32- + СН3СООН прот.к-та1 прот.осн.2 сопр.осн.1 сопр.к-та2 Ка(НСО3-) 4,67* 10 -11
- 9. В результате жизнедеятельности в организме ежесуточно образуется : до 13 моль углекислоты; 0,03-0,08 моль нелетучих кислот:
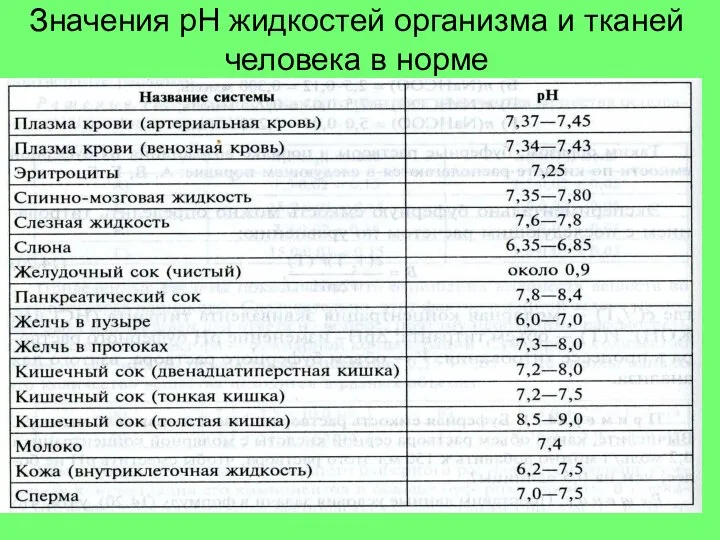
- 10. Значения рН жидкостей организма и тканей человека в норме
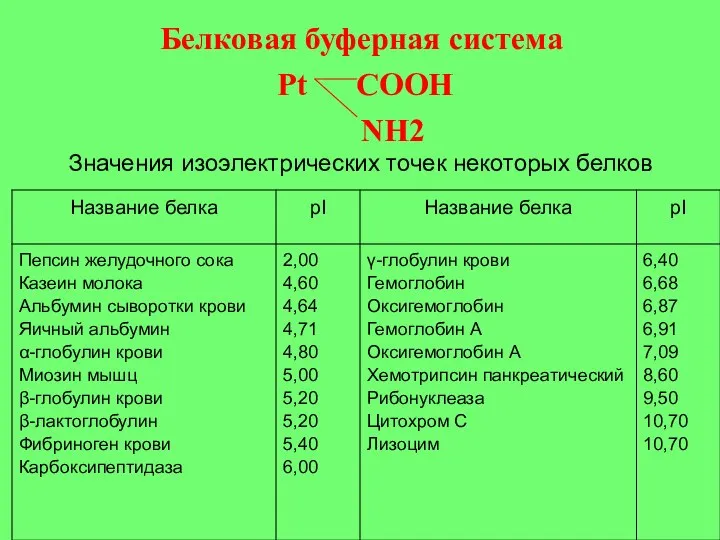
- 11. Буферные системы организма Гидрокарбонатная: H2CO3-NaHCO3 Гемоглобиновая: HHb-KHb Оксигемоглобиновая: HHbO2-KHbO2 Гидрофосфатная: NaH2PO4-Na2HPO4 Белковая: Pt-COOH-Pt-COONa Аммиачная: NH3 *H2O
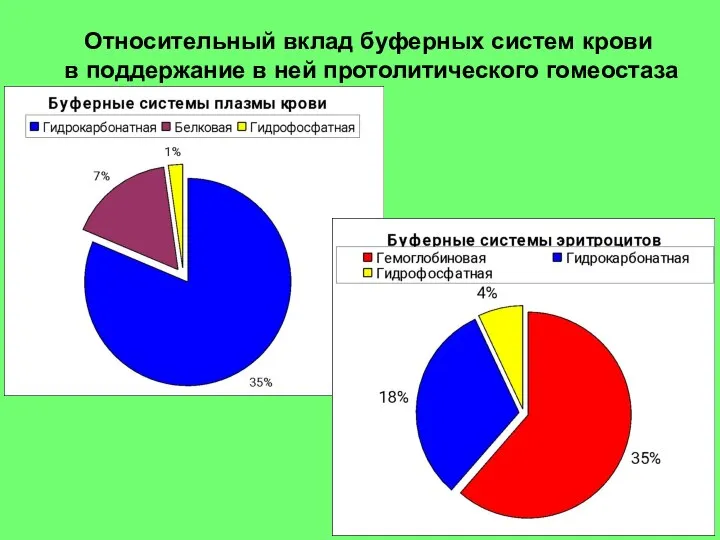
- 12. Относительный вклад буферных систем крови в поддержание в ней протолитического гомеостаза
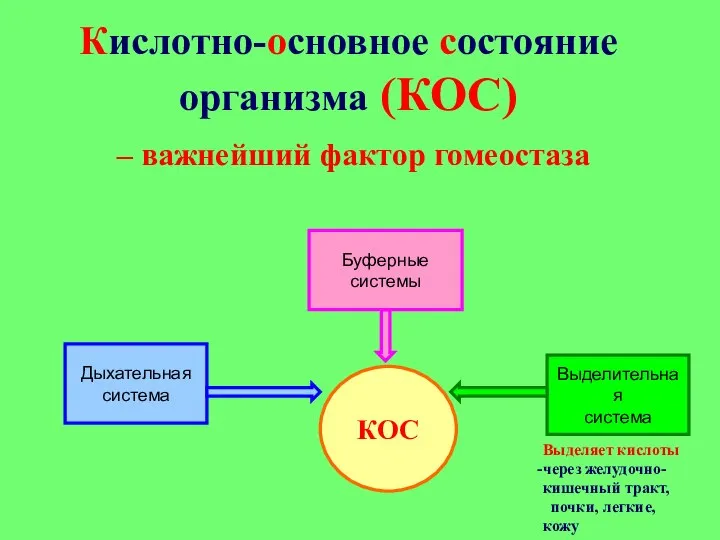
- 13. Кислотно-основное состояние организма (КОС) – важнейший фактор гомеостаза КОС Дыхательная система Буферные системы Выделительная система Выделяет
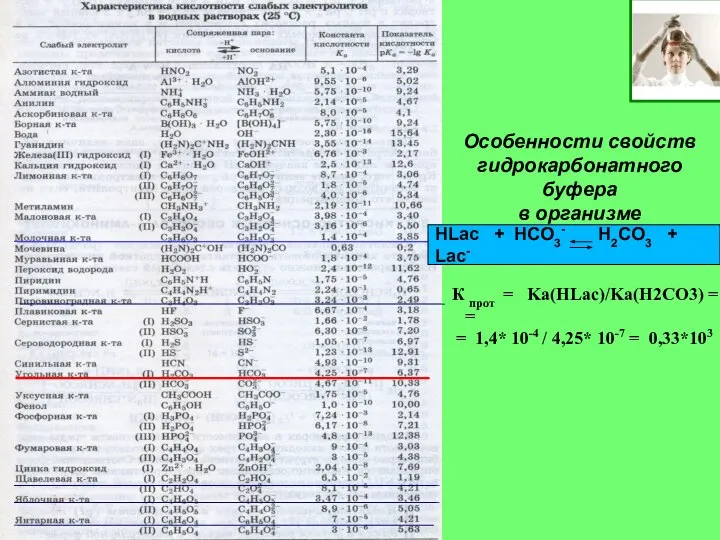
- 14. HLac + HCO3- H2CO3 + Lac- Особенности свойств гидрокарбонатного буфера в организме К прот = Ka(HLac)/Ka(H2СО3)
- 15. Гидрокарбонатный буфер (Н2СО3 – NaНCО3) pH = 6,1 + lg 27/1,35 = 7.4
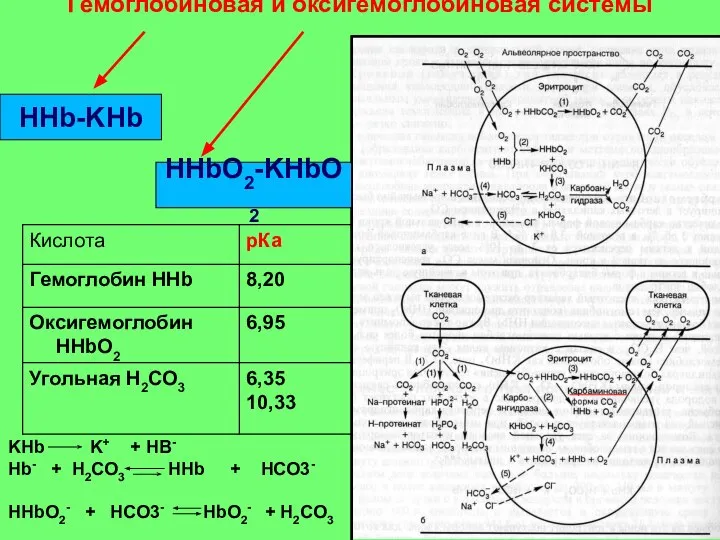
- 16. Гемоглобиновая и оксигемоглобиновая системы HHb-KHb HHbO2-KHbO2 KHb K+ + HB- Hb- + H2CO3 HHb + HCO3-
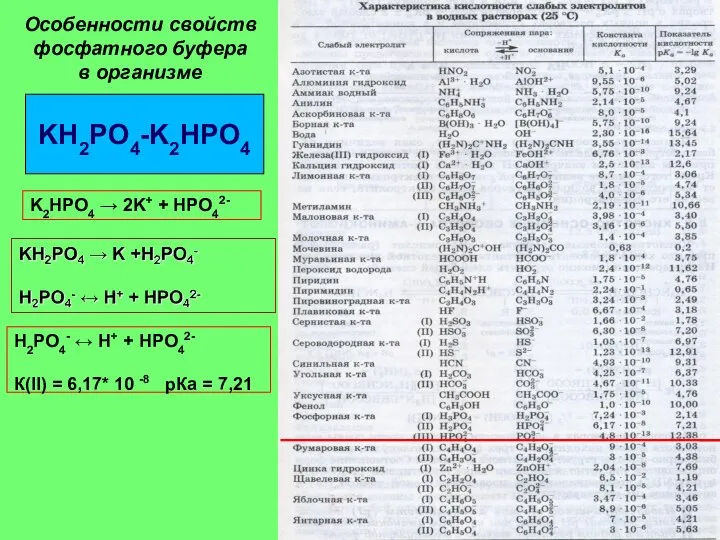
- 17. KH2PO4-K2HPO4 Особенности свойств фосфатного буфера в организме H2PO4- ↔ H+ + HPO42- К(II) = 6,17* 10
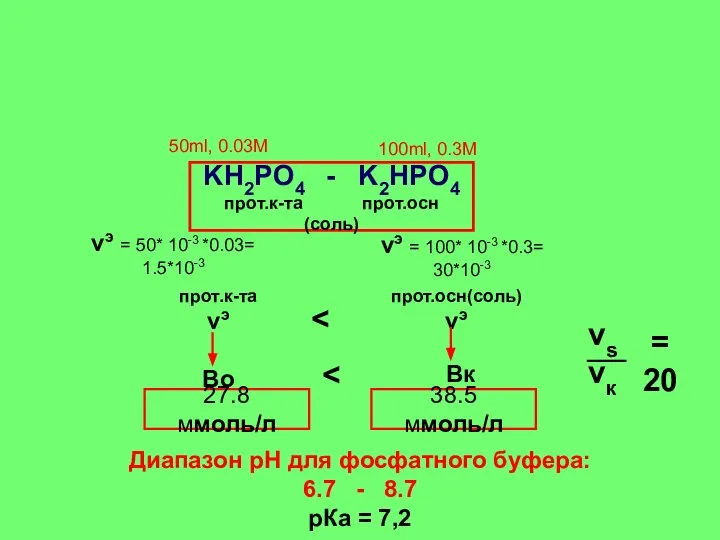
- 18. Задача 1 Рассчитайте рН фосфатной буферной системы, приготовленной из 100 мл 0,3М раствора гидрофосфата натрия и
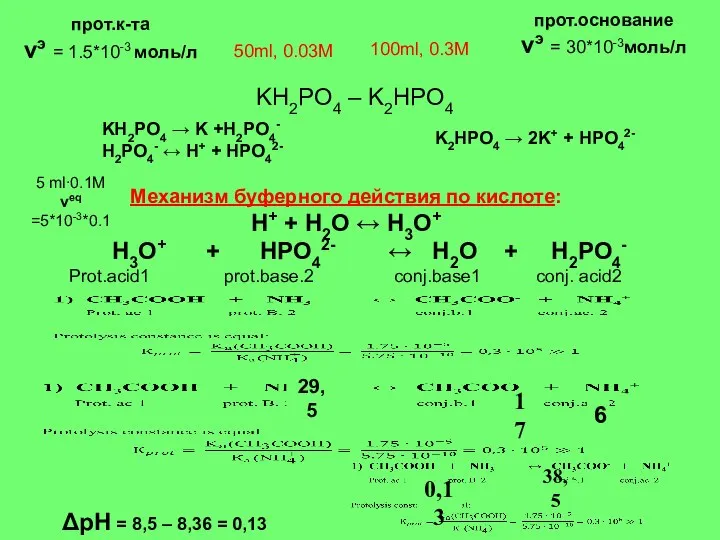
- 19. прот.к-та (prot. аcid) νэ = 50* 10-3 *0,03= 1.5*10-3 моль 50ml, 0.03М 100ml, 0.3М прот.основание (prot.
- 20. Механизм буферного действия по кислоте: Н+ + Н2О ↔ Н3О+ Н3О+ + HPO42- ↔ Н2О +
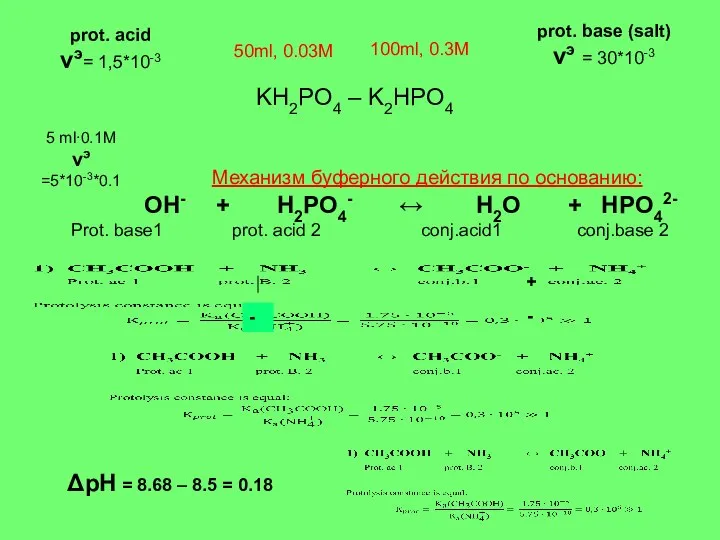
- 21. Механизм буферного действия по основанию: ОН- + H2PO4- ↔ Н2О + HPO42- Prot. base1 prot. acid
- 22. νэ = 50* 10-3 *0.03= 1.5*10-3 50ml, 0.03М 100ml, 0.3М νэ = 100* 10-3 *0.3= 30*10-3
- 23. Значения изоэлектрических точек некоторых белков Белковая буферная система Pt COOH NH2
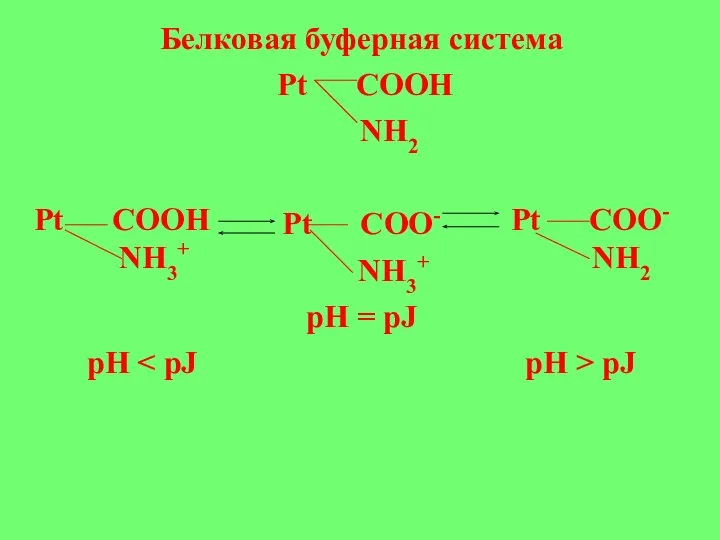
- 24. Белковая буферная система Pt COOH NH2 Pt COO- NH3+ pH = pJ pH pJ Pt COOH
- 25. Состав аммиачной буферной системы: NH4OH - NH4Cl прот.основание прот.кислота (соль)
- 26. Расчет рН буферных систем II типа ЗАДАЧА 3 Рассчитайте рН буферной системы, состоящей из 100 мл
- 27. Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и
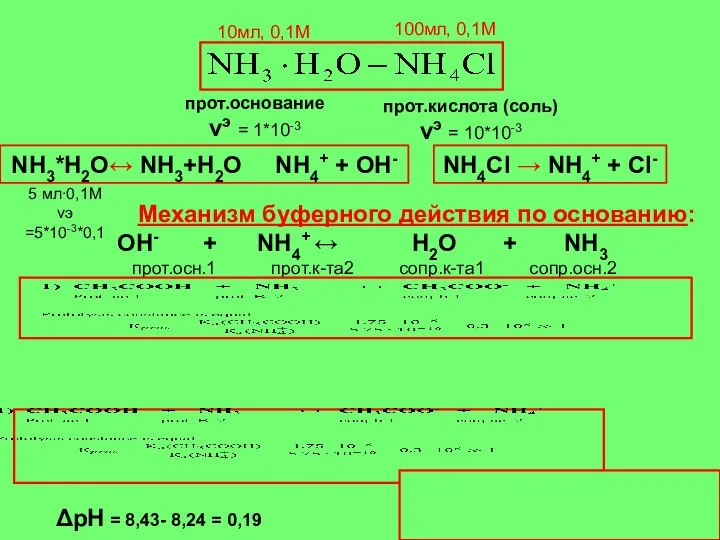
- 28. Механизм буферного действия по кислоте: Н+ + Н2О ↔ Н3О+ Н3О+ + NH3 ↔ Н2О +
- 29. Механизм буферного действия по основанию: ОН- + NH4+ ↔ Н2О + NH3 прот.осн.1 прот.к-та2 сопр.к-та1 сопр.осн.2
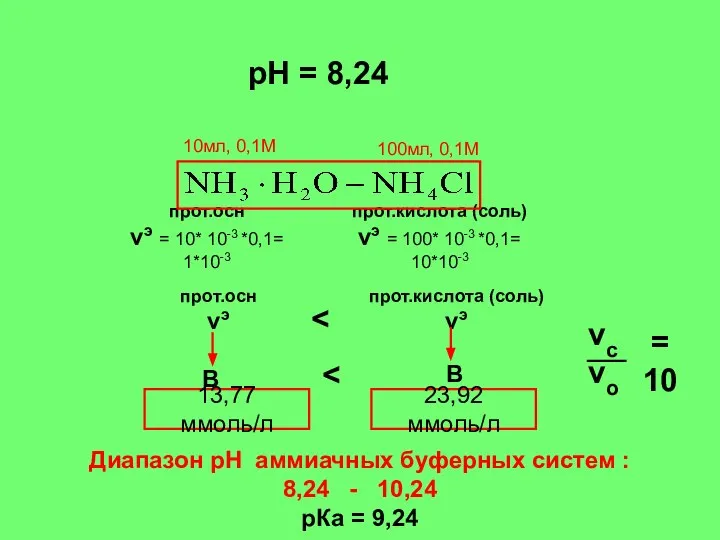
- 30. прот.осн νэ = 10* 10-3 *0,1= 1*10-3 10мл, 0,1М 100мл, 0,1М прот.кислота (соль) νэ = 100*
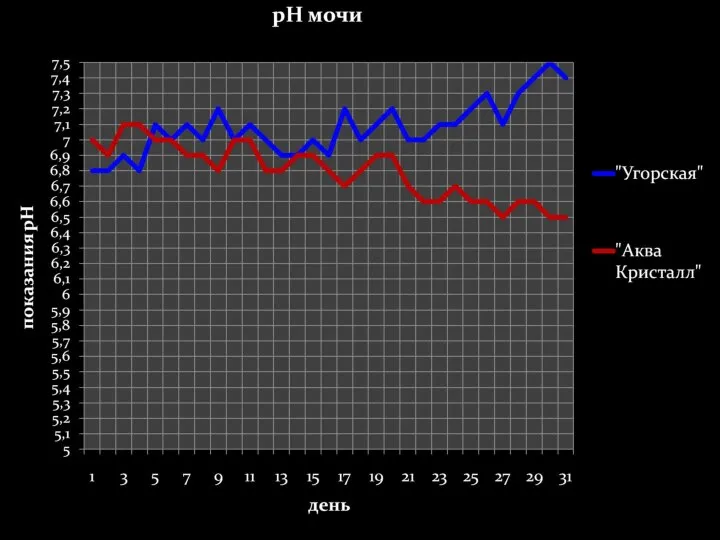
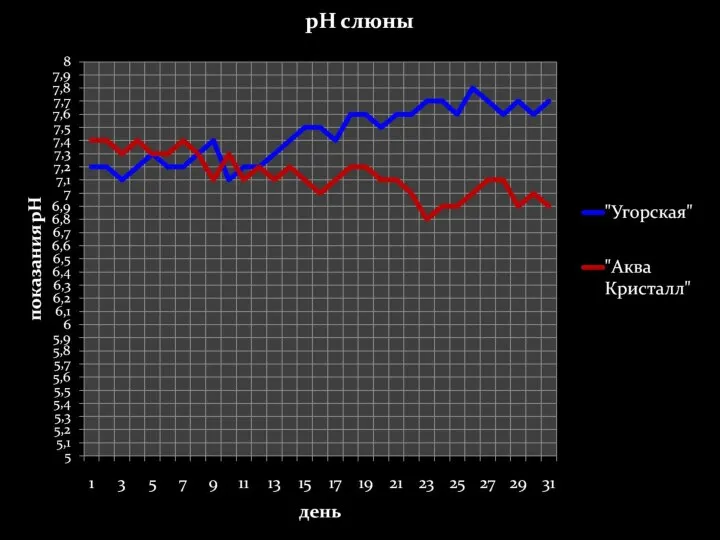
- 31. Задача 3 рН мочи в норме 4,7-6,5, а при нарушениях кислотно-щелочного равновесия может изменяться в пределах
- 32. рН = 6,2 + lg (Na2HPO4)/(NaH2PO4) 4,5 = 6,2 + lg Задача 3. рН мочи в
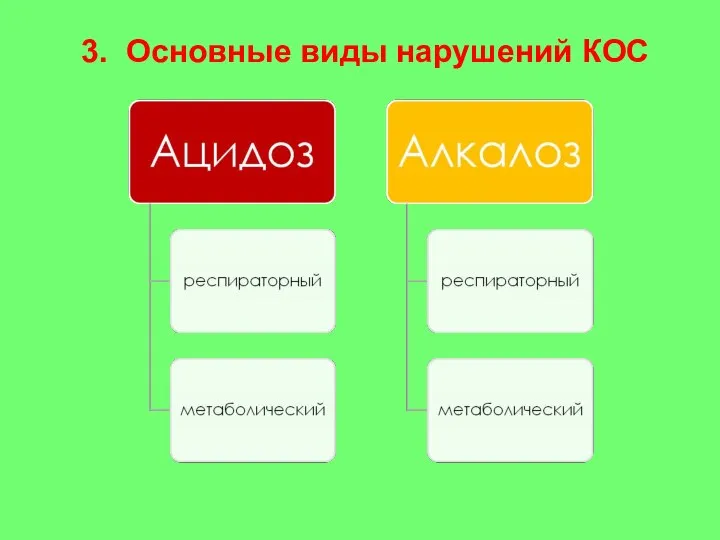
- 33. 3. Основные виды нарушений КОС
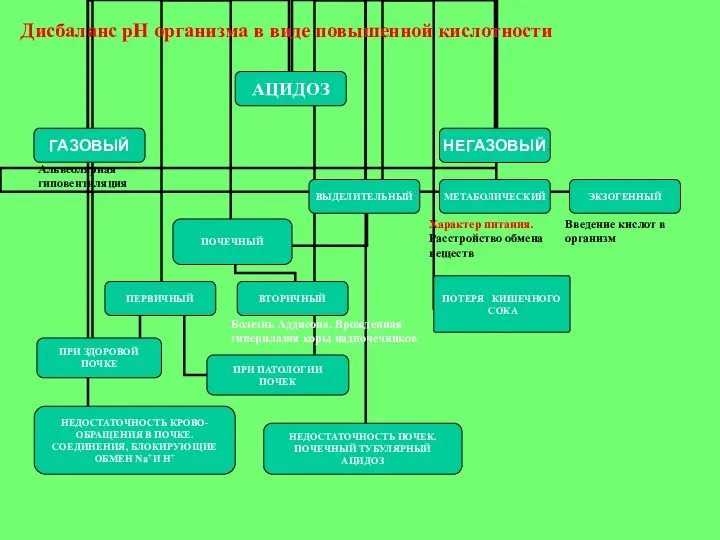
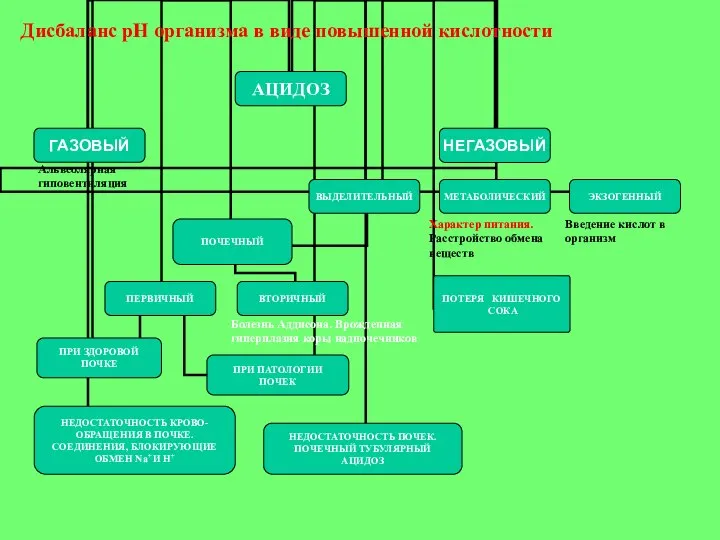
- 34. Альвеолярная гиповентиляция Характер питания. Расстройство обмена веществ Введение кислот в организм Дисбаланс рН организма в виде
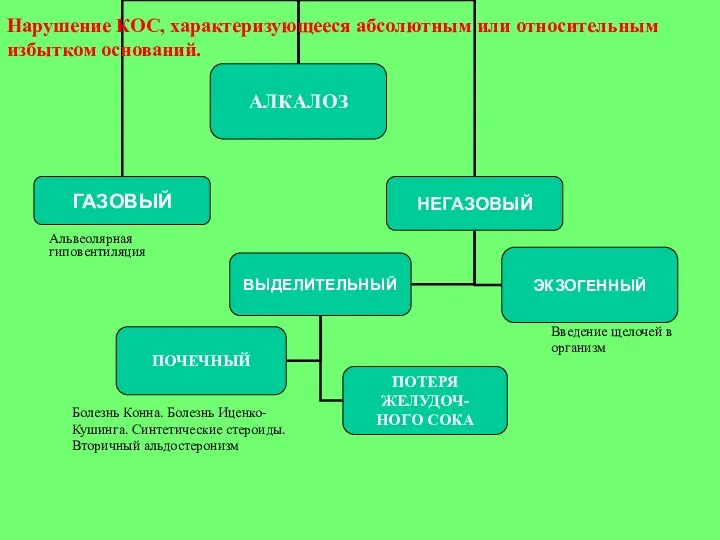
- 35. Альвеолярная гиповентиляция Введение щелочей в организм Болезнь Конна. Болезнь Иценко-Кушинга. Синтетические стероиды. Вторичный альдостеронизм Нарушение КОС,
- 36. Диагностика и корректировка КОС Основание Кислота Анализатор газов крови Серия ABL800 FLEX Измеряемые параметры: рН, рСО2,
- 37. Микро-метод Аструба(1962г.) Показатели КОС 1 , 8 - Дыхательный ацидоз 4, 5 - Дыхательный алкалоз 3,
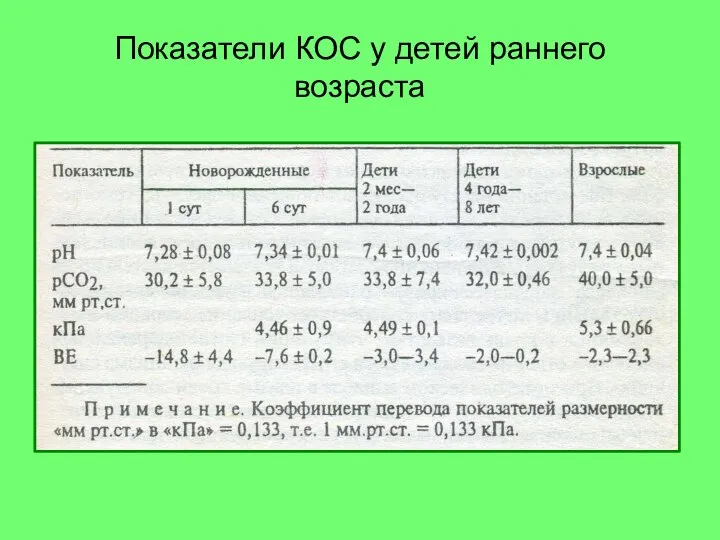
- 38. Показатели КОС у детей раннего возраста
- 39. Ацидоза: Бикарбонат натрия (4,5%) трисамин (3,66 %) 11 % раствор лактата натрия Алкалоза: 5 % растворы
- 40. Альвеолярная гиповентиляция Характер питания. Расстройство обмена веществ Введение кислот в организм Дисбаланс рН организма в виде
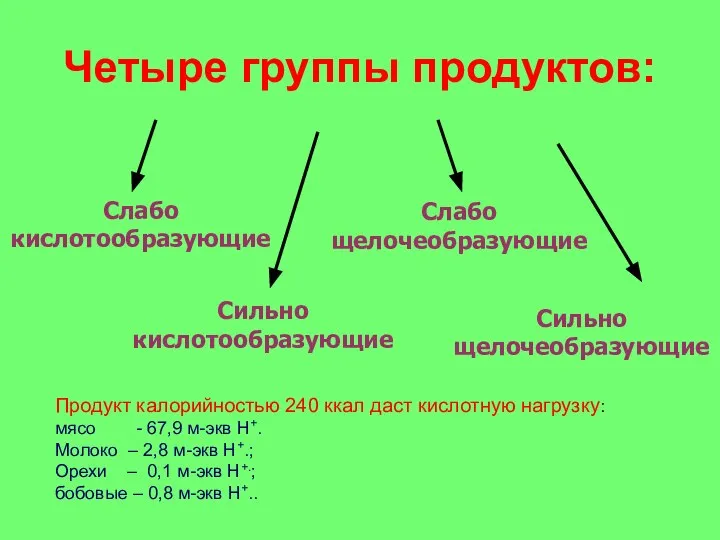
- 41. Четыре группы продуктов: Сильно кислотообразующие Слабо кислотообразующие Слабо щелочеобразующие Сильно щелочеобразующие Продукт калорийностью 240 ккал даст
- 42. Слабо кислотообразующие: творог, сметана, орехи и продукты из муки грубого помола
- 43. Сильно кислотообразующие: мясо, колбаса, рыба, яйца, сыр, сладости, продукты из белой муки, алкоголь и кофе
- 44. Слабо щелочеобразующие: сухие фрукты, сырое молоко и грибы
- 45. Сильно щелочеобразующие: овощи, свежие фрукты, картофель и зеленый салат
- 48. Минимальный промежуток времени, за который в нашем организме происходят изменения – 10-13 дней
- 49. Задача 1 Состав аммиачной буферной системы: NH4OH - NH4Cl 50мл 0,1М 50мл 0,2М Сравните буферную емкость
- 51. Скачать презентацию
























 Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Биологически активные вещества. Витамины. Ферменты. Гормоны
Биологически активные вещества. Витамины. Ферменты. Гормоны Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Что изучает химия
Что изучает химия Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_
Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_ Микроорганизмы и важнейшие химические факторы среды обитания
Микроорганизмы и важнейшие химические факторы среды обитания Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Голубое золото
Голубое золото Валентность химических элементов
Валентность химических элементов Релаксационные свойства полимеров
Релаксационные свойства полимеров Происхождение жизни на Земле
Происхождение жизни на Земле Подготовка учащихся к практическим турам олимпиад по химии
Подготовка учащихся к практическим турам олимпиад по химии Химические свойства солей. Генетическая связь неорганических соединений
Химические свойства солей. Генетическая связь неорганических соединений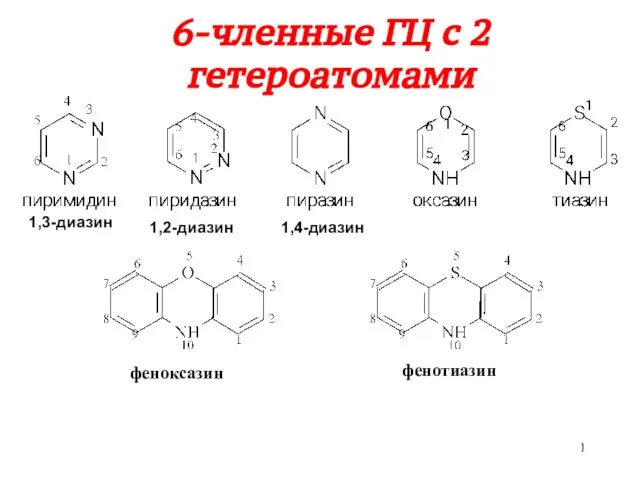 6-членные ГЦ с 2 гетероатомами
6-членные ГЦ с 2 гетероатомами Презентация по Химии "«Белки»" - скачать смотреть
Презентация по Химии "«Белки»" - скачать смотреть  Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат
Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат Урок химии на дне океана. Задача 13
Урок химии на дне океана. Задача 13 Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть
Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть  Углеводороды
Углеводороды Строение атома азота
Строение атома азота Полимеры и их использование
Полимеры и их использование Химическое равновесие. Термодинамика химического равновесия
Химическое равновесие. Термодинамика химического равновесия Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Альдегиды и кетоны
Альдегиды и кетоны Электролиз. Задание № 20
Электролиз. Задание № 20 Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы
Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы