Содержание
- 2. Оксиды. Определение, состав, номенклатура, классификация и структурные формулы Оксиды – это соединения, состоящие из атомов двух
- 3. Название оксидов В названиях оксидов вначале указывают слово оксид (в именительном падеже), а затем – в
- 4. ВНИМАНИЕ!!!!!!!!!!!!!! Постоянную валентность, которая не указывается в названии оксидов, имеют: - элементы I и II группы
- 5. Классификация По агрегатному состоянию оксиды неметаллов разделяются на: твердые – Р2О5, SiO2, N2O5 и др., газообразные
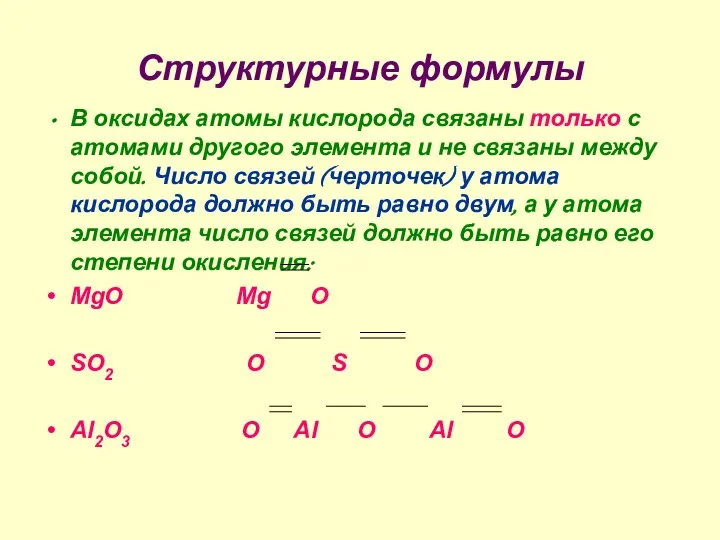
- 6. Структурные формулы В оксидах атомы кислорода связаны только с атомами другого элемента и не связаны между
- 7. Оксиды в природе
- 8. Вода Н2О – оксид водорода Агрегатные состояния: твёрдое — лед жидкое — вода газообразное — водяной
- 9. Углекислый газ (диоксид углерода) СО2 – оксид углерода (IV) Углекислый газ формируется при соединении двух элементов:
- 10. Оксид кремния (IV) SiО2 Диоксид кремния применяют в производстве стекла, керамики, бетонных изделий, для получения кремния,
- 11. Домашнее задание Не производя вычислений, скажите, в каком из оксидов массовая доля кислорода больше: 1) H2О;
- 13. Скачать презентацию









 Минерал гранат
Минерал гранат Radiation dosimetry
Radiation dosimetry Физико-химические свойства воды. Водные ресурсы Земли
Физико-химические свойства воды. Водные ресурсы Земли Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Вакуумное фильтрование
Вакуумное фильтрование Инфузионая терапия новорожденных
Инфузионая терапия новорожденных Защитные материалы
Защитные материалы Наука плазмохимия
Наука плазмохимия Фосфор. Получение. Химические свойства
Фосфор. Получение. Химические свойства Brain элементтері
Brain элементтері Аттестационная работа. Программа элективного курса по химии экологическая химия
Аттестационная работа. Программа элективного курса по химии экологическая химия Теоретические основы органической химии
Теоретические основы органической химии Свойства фенола
Свойства фенола Катализ. Влияние катализатора на скорость химической реакции
Катализ. Влияние катализатора на скорость химической реакции Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Дослідження достовірності реклами з погляду хімії
Дослідження достовірності реклами з погляду хімії Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Трансмиссионное масло ADDINOL Eco Gear GLS
Трансмиссионное масло ADDINOL Eco Gear GLS ГИА по химии
ГИА по химии Оксиди, їх склад, назви.
Оксиди, їх склад, назви.  Оксид кремния
Оксид кремния Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие ГИА-9 Химия. А4
ГИА-9 Химия. А4 Каталитический крекинг
Каталитический крекинг Свойства аммиачной селитры
Свойства аммиачной селитры Растворение, растворимость веществ в воде
Растворение, растворимость веществ в воде