Содержание
- 2. Задачи, решаемые экстракцией. Избирательное извлечение целевого компонента, даже при малых его концентрациях, при этом, регулируя соотношение
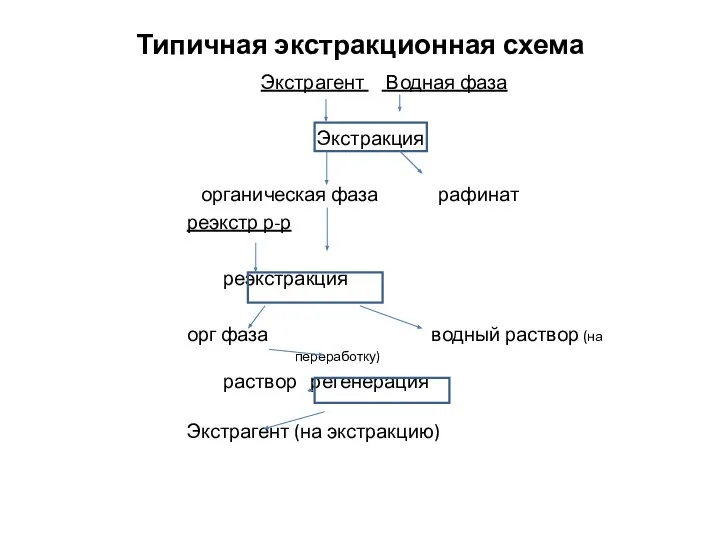
- 3. Типичная экстракционная схема Экстрагент Водная фаза Экстракция органическая фаза рафинат реэкстр р-р реэкстракция орг фаза водный
- 4. Основные понятия Экстрагент - органическое соединение способное образовывать с ценным компонентом комплексное соединение или сольват. Разбавитель
- 5. Количественные характеристики 1. Коэффициент распределения (D) - отношение аналитической концентрации распределяющегося вещества в органической фазе (у)
- 6. Основные принципы извлечения из водной фазы в органическую Заряженным ионам энергетически невыгоден переход из сильно полярной
- 7. высаливание ABв = Aв+ +Bв- Aв+ +Bв-= (AB)o k= aAB/aA·aB k=CAB·γAB/CA·γA ·CB·γB =y/x·x· γ0/γ2 D= y/x
- 8. высаливатель Действия одноименного иона Изменения коэффициентов активностей. Из уравнения видно, что введение высаливателя должно увеличить коэффициент
- 9. Типы экстрагентов и механизмы экстракции Нейтральные экстрагенты. Спирты CnH2n+1OH , где n = 7-9 Простые эфиры
- 10. Координационный механизм: ROоδ- + Kвn+ + Aвn- = [RO→K]Aо а) сольватный qROоδ- + Мвn+ + Aвn-
- 11. Сольватный механизм qROоδ- + Мвn+ + Aвn- = [М·qRО]Aо k = C [М·qRО]A /CROq·CM·CA D =
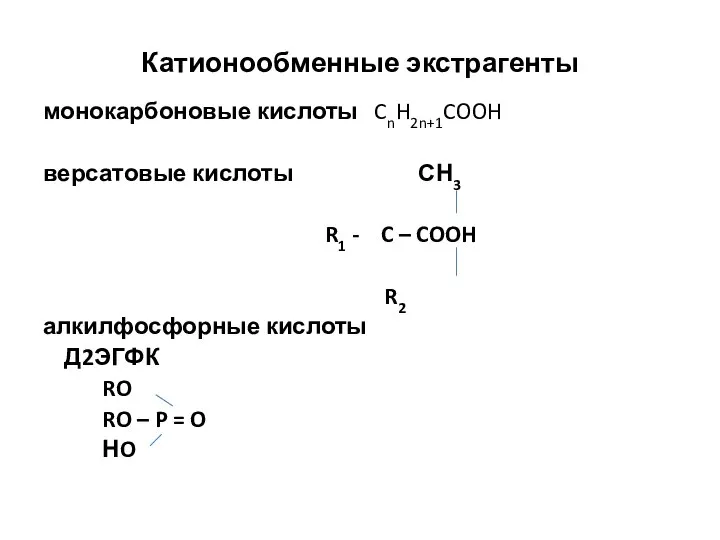
- 12. Катионообменные экстрагенты монокарбоновые кислоты CnH2n+1COOH версатовые кислоты СН3 R1 - C – COOH R2 алкилфосфорные кислоты
- 13. Катионообменный механизм Mn+ (B) + n/2(HR)2 (O) = MRn (O) + nH+ (B) lgD=lgk+n/2 lgCHR –nlgCH=
- 15. Скачать презентацию







![Координационный механизм: ROоδ- + Kвn+ + Aвn- = [RO→K]Aо а) сольватный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405794/slide-9.jpg)
![Сольватный механизм qROоδ- + Мвn+ + Aвn- = [М·qRО]Aо k =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405794/slide-10.jpg)

 Гипергенез и почвообразование
Гипергенез и почвообразование Трансформация соединений азота
Трансформация соединений азота Харчові добавки Виконала: Учениця 10-Б класу Єфіменко Злата
Харчові добавки Виконала: Учениця 10-Б класу Єфіменко Злата  Коррозия металлов
Коррозия металлов Анализ качества лекарственных средств, производных алифатических и ароматических аминов
Анализ качества лекарственных средств, производных алифатических и ароматических аминов Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Предельные одноатомные спирты. 10 класс
Предельные одноатомные спирты. 10 класс Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Разработка и исследование новых высокоэффективных адсорбентов-осушителей на основе оксида алюминия
Разработка и исследование новых высокоэффективных адсорбентов-осушителей на основе оксида алюминия Гидроксид калия KOH
Гидроксид калия KOH Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Химическая термодинамика. Основные понятия
Химическая термодинамика. Основные понятия Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Бетаин (триметилглицин)
Бетаин (триметилглицин) Использование ядерных излучений для получения химической информации. (Лекция 10)
Использование ядерных излучений для получения химической информации. (Лекция 10) Характеристика щелочных металлов 9 класс
Характеристика щелочных металлов 9 класс  Силикатная промышленность
Силикатная промышленность Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5
Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5 Химия – правая рука физики, а математика - ее глаза
Химия – правая рука физики, а математика - ее глаза Системы эвтектического типа
Системы эвтектического типа Природный каучук
Природный каучук Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Презентация по Химии "Цветная металлургия" - скачать смотреть
Презентация по Химии "Цветная металлургия" - скачать смотреть  Химические реакторы
Химические реакторы Презентация по Химии "исследование состава и свойств минеральной воды" - скачать смотреть
Презентация по Химии "исследование состава и свойств минеральной воды" - скачать смотреть  Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Презентація з хімії на тему:”Спирт.Загальні відомості про спирт” підготували: учениці 11-А класу Харківської ЗОШ І-ІІІ ступенів №102 Антіпова Марія і Уськіна Ольга
Презентація з хімії на тему:”Спирт.Загальні відомості про спирт” підготували: учениці 11-А класу Харківської ЗОШ І-ІІІ ступенів №102 Антіпова Марія і Уськіна Ольга