Содержание
- 2. Электрохимические процессы – это окислительно-восстановительные процессы, протекающие на границе раздела: электрод – раствор. Электрод представляет собой
- 3. Химическая активность металлов. Все МЕ имеют хорошую тепло- и электропроводность, ковкость, металлический блеск. Все это связано
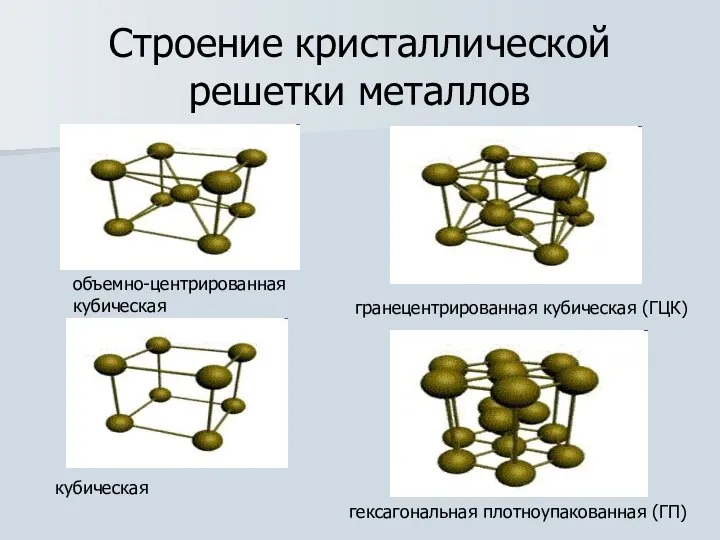
- 4. Строение кристаллической решетки металлов кубическая объемно-центрированная кубическая гранецентрированная кубическая (ГЦК) гексагональная плотноупакованная (ГП)
- 5. МЕ являются хорошими восстановителями, т.е. способны отдавать свои электроны и образовывать +q ионы. Основной характеристикой восстановительной
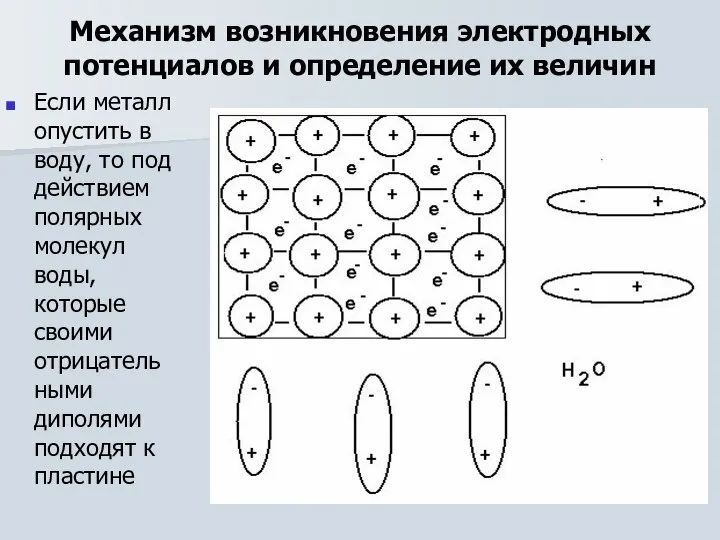
- 6. Механизм возникновения электродных потенциалов и определение их величин Если металл опустить в воду, то под действием
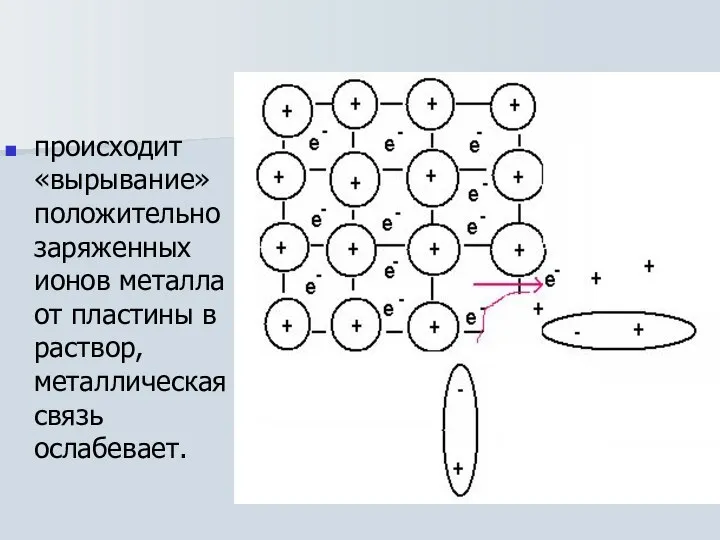
- 7. происходит «вырывание» положительно заряженных ионов металла от пластины в раствор, металлическая связь ослабевает.
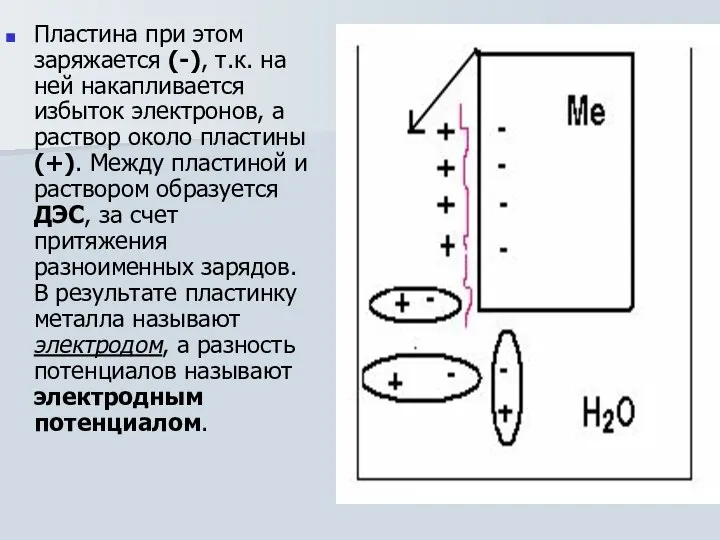
- 8. Пластина при этом заряжается (-), т.к. на ней накапливается избыток электронов, а раствор около пластины (+).
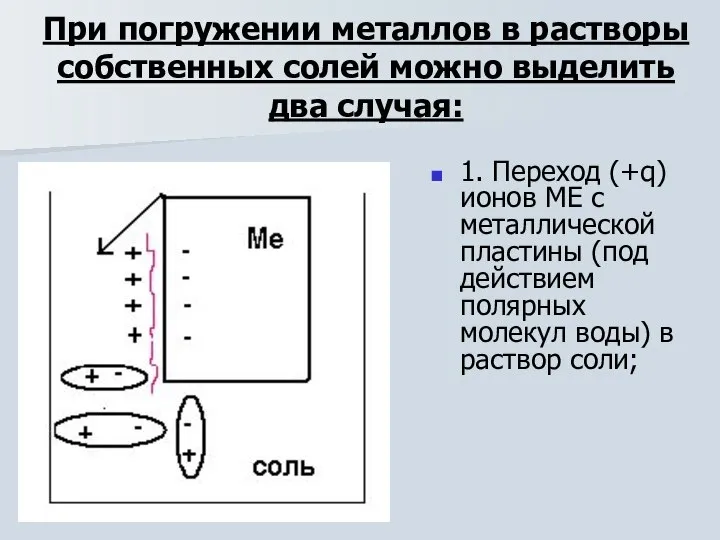
- 9. При погружении металлов в растворы собственных солей можно выделить два случая: 1. Переход (+q) ионов МЕ
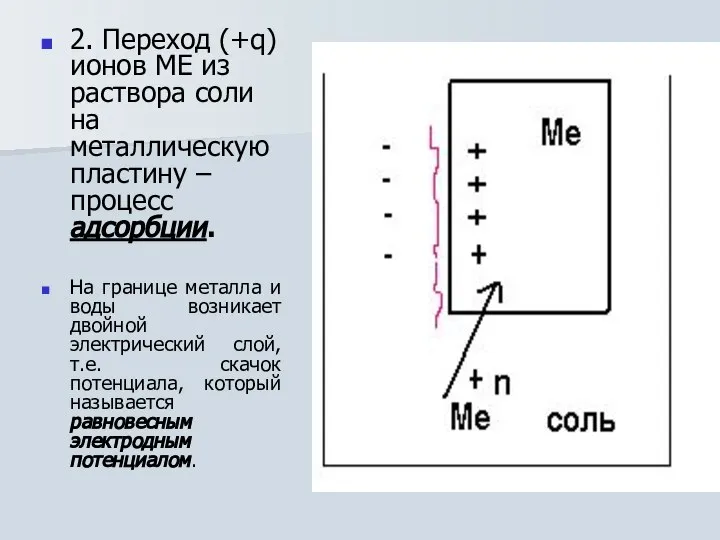
- 10. 2. Переход (+q) ионов МЕ из раствора соли на металлическую пластину – процесс адсорбции. На границе
- 11. Стандартный электродный потенциал Е0 – это электродный потенциал, измеренный при стандартных условиях: концентрация ионов металла равна
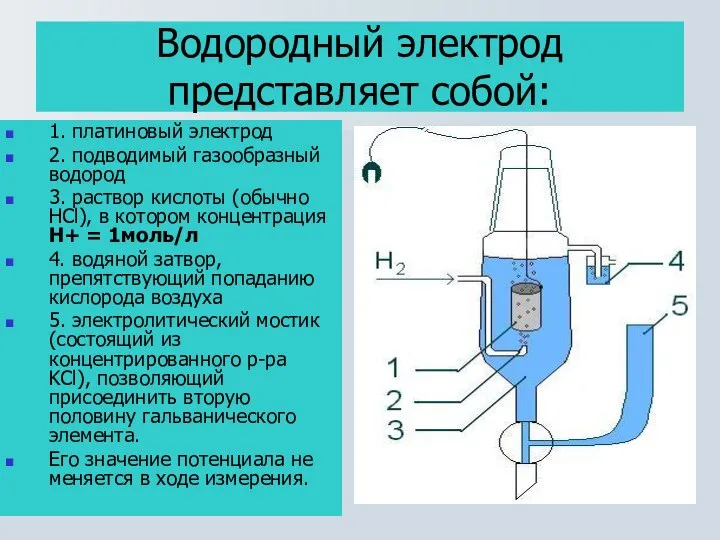
- 12. 1. платиновый электрод 2. подводимый газообразный водород 3. раствор кислоты (обычно HCl), в котором концентрация H+
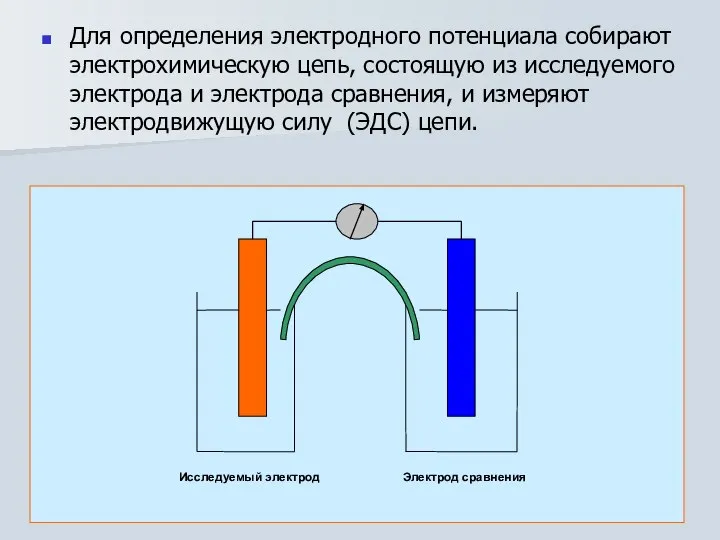
- 13. Для определения электродного потенциала собирают электрохимическую цепь, состоящую из исследуемого электрода и электрода сравнения, и измеряют
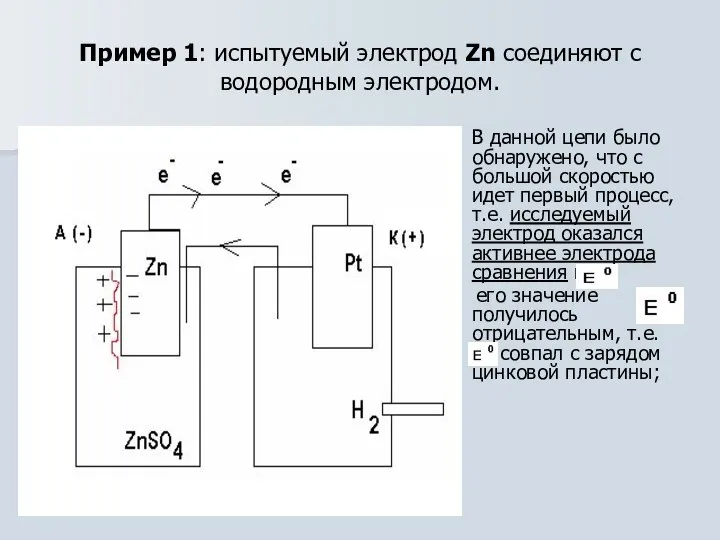
- 14. Пример 1: испытуемый электрод Zn соединяют с водородным электродом. В данной цепи было обнаружено, что с
- 15. Измеряют электродвижущую силу (ЭДС) полученной электрохимической цепи ЭДС = Екатода – Еанода, вычисляют потенциал исследуемого электрода
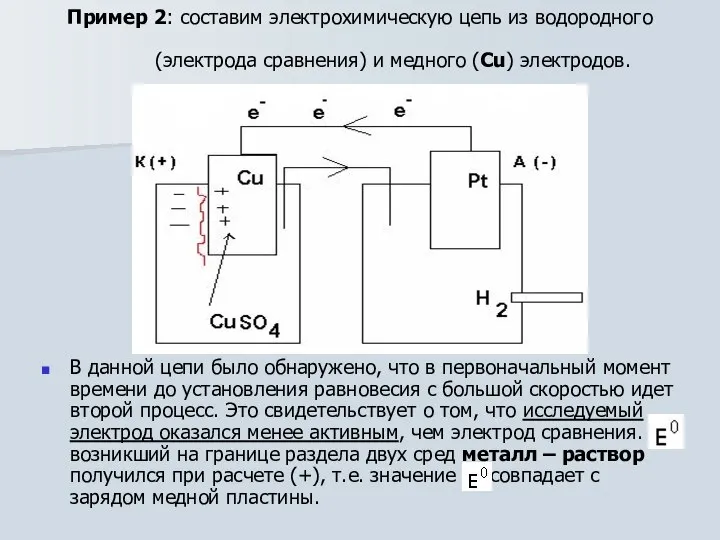
- 16. Пример 2: составим электрохимическую цепь из водородного (электрода сравнения) и медного (Cu) электродов. В данной цепи
- 17. Таким образом с помощью представленного метода были получены значения электродных потенциалов для различных металлов в стандартных
- 18. Стандартные электродные потенциалы всех металлов – это табличные данные.
- 19. Уравнение Нернста: где R = 8.31 Дж/моль⋅К, T = 298K, F = 96500 Кл, n –
- 20. Если в формулу подставить значения R, T, F и от ln→lg, то формула примет следующий вид:
- 21. Пример. Рассчитайте электродный потенциал цинкового электрода, если концентрация ионов цинка равна 0,1 моль/л. РЕШЕНИЕ:
- 22. Выводы из ряда напряжения: 1. Ме –это элементы, которые за счет отдачи электронов являются восстановителями. Восстановительная
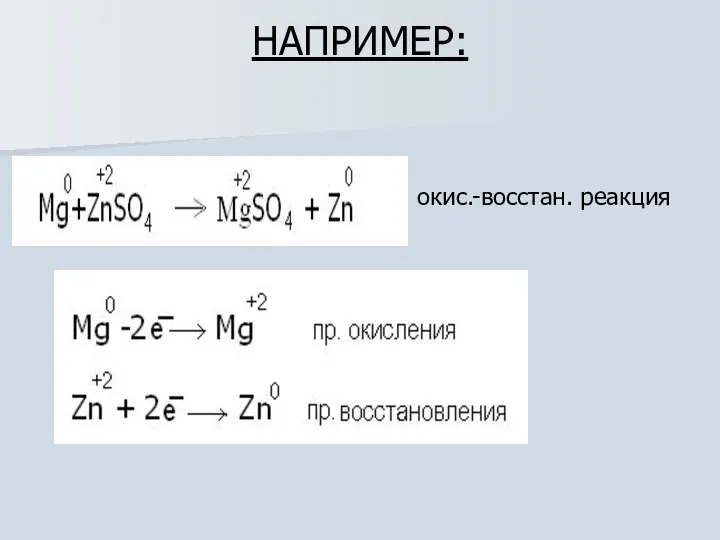
- 23. НАПРИМЕР: – окис.-восстан. реакция
- 24. 2. Ме стоящие в ряду активности левее (Н) способны восстановить (Н) из кислот (исключение: азотная и
- 26. Скачать презентацию












 Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Кислоты: классификация, реакции, применение
Кислоты: классификация, реакции, применение Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти
Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти  Общие способы получения металлов
Общие способы получения металлов Отчетная работа по элективному курсу «Истории открытий удивительных веществ» Выполнили ученики 9А класса ГОУ СОШ № 466 Бердников
Отчетная работа по элективному курсу «Истории открытий удивительных веществ» Выполнили ученики 9А класса ГОУ СОШ № 466 Бердников Алмази
Алмази  Спирты
Спирты Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Çoxkomponentli qarışığın birdəfəli qaynama başlanğıcı temperaturunun tədrici yaxınlaşma üsulu ilə təyini
Çoxkomponentli qarışığın birdəfəli qaynama başlanğıcı temperaturunun tədrici yaxınlaşma üsulu ilə təyini ЦЕЛЛЮЛОЗА (C6 H10 O5)n –[С6 Н7 О2 (OH)3]–
ЦЕЛЛЮЛОЗА (C6 H10 O5)n –[С6 Н7 О2 (OH)3]–  Презентация Проверим знания по теме «Кремний»
Презентация Проверим знания по теме «Кремний» Неметаллы Обобщение 9 класс
Неметаллы Обобщение 9 класс Качественный анализ
Качественный анализ Крахмал
Крахмал Геохимия редкоземельных элементов
Геохимия редкоземельных элементов Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров Реакционная способность углеводородов
Реакционная способность углеводородов Азот. Соединения азота
Азот. Соединения азота Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии
Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии  Общие свойства d-металлов
Общие свойства d-металлов Химия неметаллов
Химия неметаллов Презентация Характеристика щелочных металлов 9 класс
Презентация Характеристика щелочных металлов 9 класс  Фазовые диаграммы и статистическая термодинамика бинарных m-h систем
Фазовые диаграммы и статистическая термодинамика бинарных m-h систем КАРБОНАТНА КИСЛОТА. Солі карбонатної кислоти, їх поширення та застосування
КАРБОНАТНА КИСЛОТА. Солі карбонатної кислоти, їх поширення та застосування