Содержание
- 2. Кислоты Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация:
- 3. Классификация кислот По растворимости Растворимые Нерастворимые азотная кислота осадок кремниевой кислоты
- 4. Классификация кислот По наличию кислорода Кислородсодержащие Бескислородные уксусная кислота соляная кислота
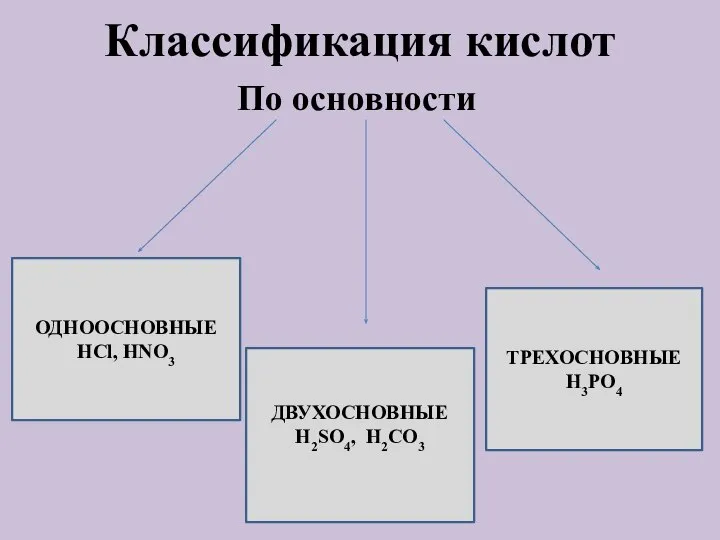
- 5. Классификация кислот По основности ОДНООСНОВНЫЕ НСl, HNO3 ДВУХОСНОВНЫЕ H2SO4, H2CO3 ТРЕХОСНОВНЫЕ H3PO4
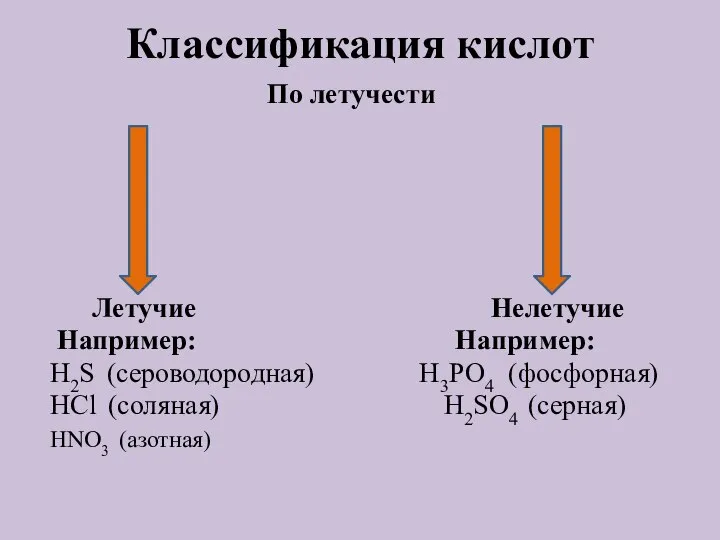
- 6. Классификация кислот По летучести Летучие Нелетучие Например: Например: H2S (сероводородная) H3PO4 (фосфорная) HCl (соляная) H2SO4 (серная)
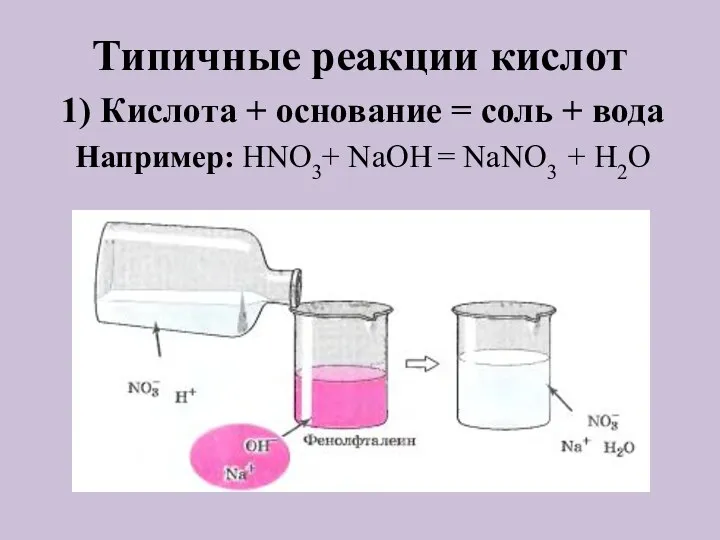
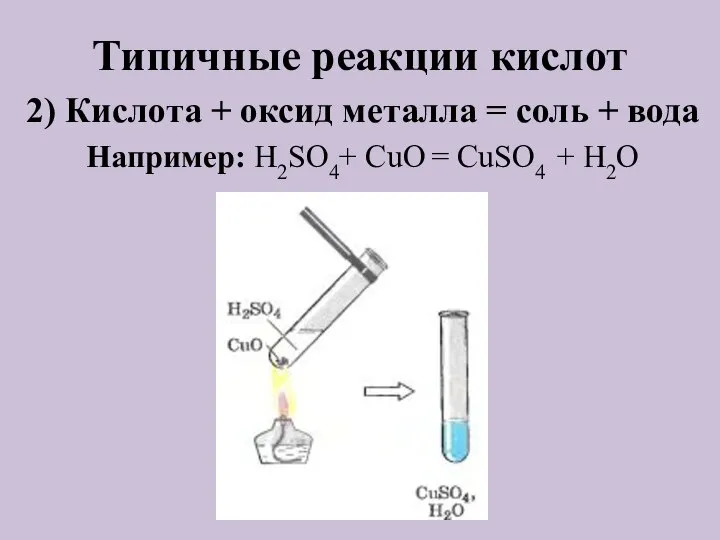
- 7. Типичные реакции кислот Кислота + основание = соль + вода 2) Кислота + оксид металла =
- 8. Типичные реакции кислот 1) Кислота + основание = соль + вода Например: HNO3+ NaOH = NaNO3
- 9. Типичные реакции кислот 2) Кислота + оксид металла = соль + вода Например: H2SO4+ CuO =
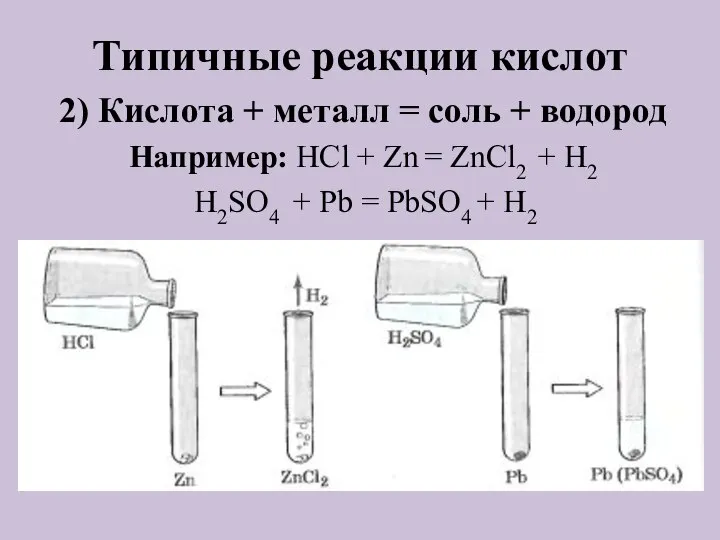
- 10. Типичные реакции кислот 2) Кислота + металл = соль + водород Например: HCl + Zn =
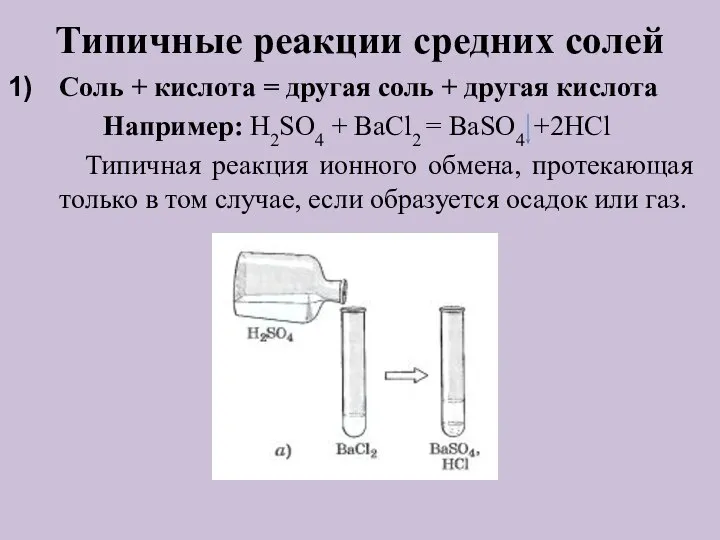
- 11. Типичные реакции средних солей Соль + кислота = другая соль + другая кислота Например: H2SO4 +
- 12. Практическое применение кислот Производство лекарств; химических продуктов и товаров; минеральных удобрений; красок; пластмасс и т.д.;
- 14. Скачать презентацию





 Альтернативні види палива
Альтернативні види палива  Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Основные классы неорганических соединений
Основные классы неорганических соединений Магний. Магний алудың электролиттік жолы. Магний алудың термиялық жолдары
Магний. Магний алудың электролиттік жолы. Магний алудың термиялық жолдары Теория химического строения органических соединений А.М. Бутлерова
Теория химического строения органических соединений А.М. Бутлерова Научно – исследовательская работа «Газированная вода - вред или польза?»
Научно – исследовательская работа «Газированная вода - вред или польза?» Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка
Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка  Жидкостная экстракция
Жидкостная экстракция Біографія Д. І. Менделєєва
Біографія Д. І. Менделєєва  Углерод и кремний
Углерод и кремний Поверхностные явления
Поверхностные явления Фосфор и его соединения
Фосфор и его соединения Специальный выпуск «Слово эксперту». Антиоксидантная защита от Орифлэйм
Специальный выпуск «Слово эксперту». Антиоксидантная защита от Орифлэйм Презентация по Химии "ПОКАЗАТЕЛИ ВОДЫ - ЕЁ ЖЕСТКОСТЬ И КИСЛОТНОСТЬ" - скачать смотреть бесплатно
Презентация по Химии "ПОКАЗАТЕЛИ ВОДЫ - ЕЁ ЖЕСТКОСТЬ И КИСЛОТНОСТЬ" - скачать смотреть бесплатно Соли и реакции ионного обмена
Соли и реакции ионного обмена Контрольная работа
Контрольная работа Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Гетероциклические соединения
Гетероциклические соединения Оксигенвмісні органічні сполуки. Лекція 12
Оксигенвмісні органічні сполуки. Лекція 12 Rectification. Difference between the rectification and distillation
Rectification. Difference between the rectification and distillation Различия в молекулярном строении газов, жидкостей и твердых тел
Различия в молекулярном строении газов, жидкостей и твердых тел Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Обобщение знаний по теме
Обобщение знаний по теме Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92»
Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92» Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Минеральные вещества. Микроэлементы и макроэлементы
Минеральные вещества. Микроэлементы и макроэлементы Классификация органических соединений. (10 класс)
Классификация органических соединений. (10 класс) Основы органической химии
Основы органической химии