Содержание
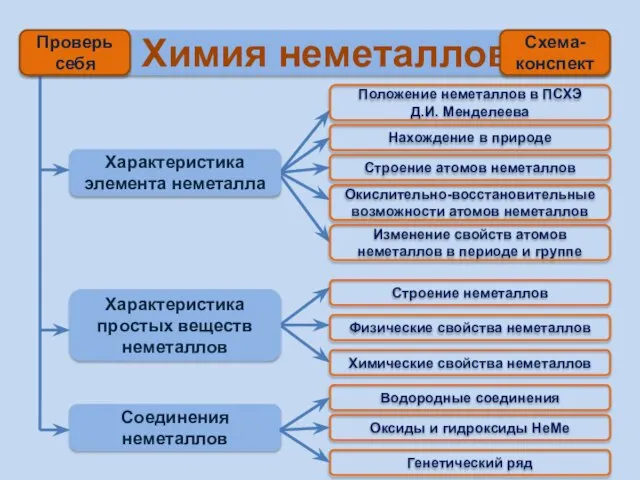
- 2. Химия неметаллов Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов Положение неметаллов в ПСХЭ Д.И.
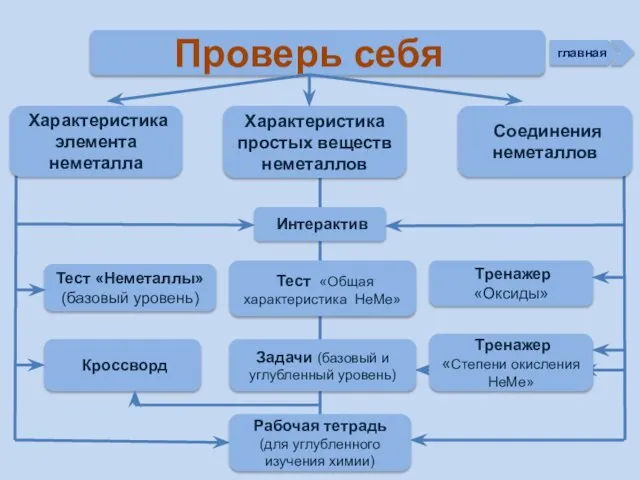
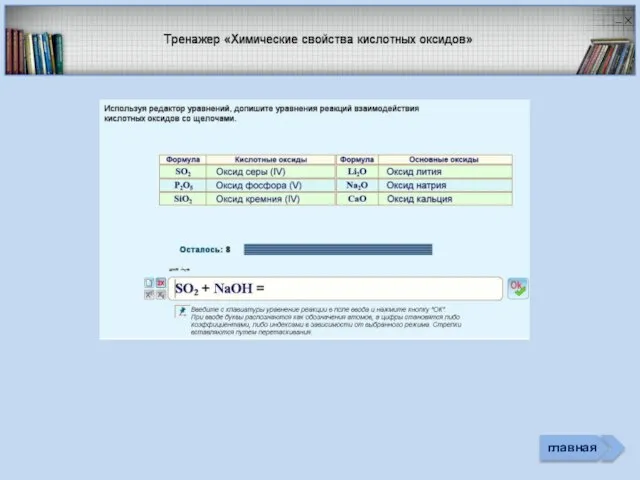
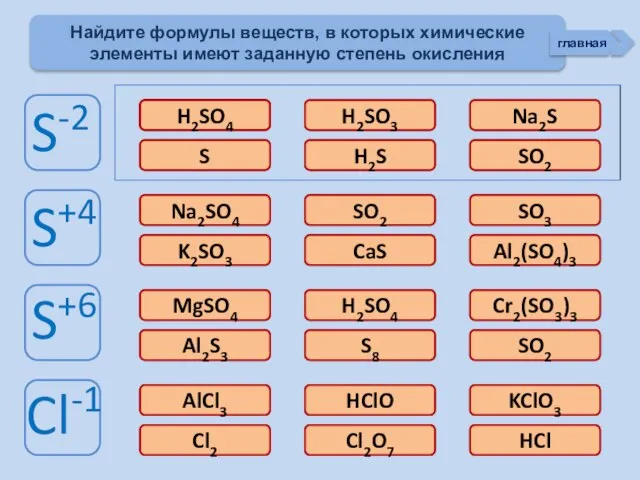
- 3. Проверь себя Характеристика простых веществ неметаллов Характеристика элемента неметалла Тест «Неметаллы» (базовый уровень) Соединения неметаллов Тренажер
- 4. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС Положение
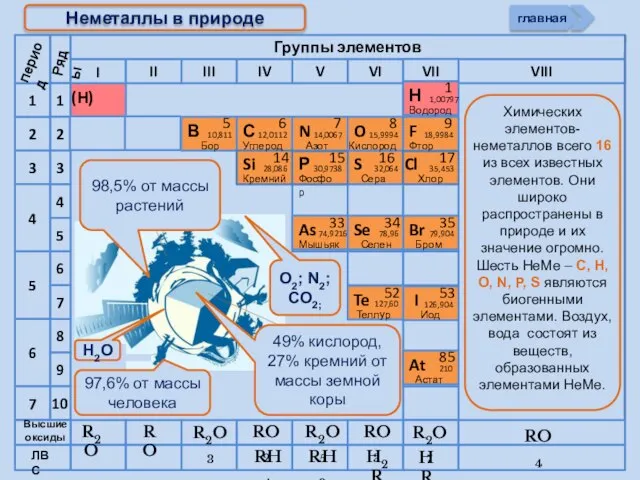
- 5. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RH4 RH3 H2R HR Высшие оксиды ЛВС Неметаллы в
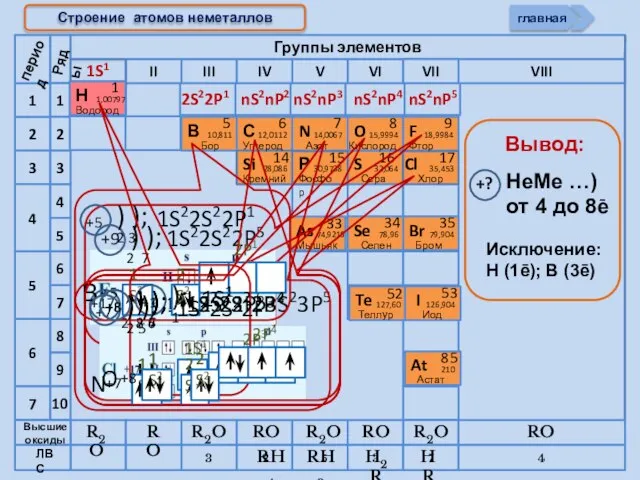
- 6. Cтроение атомов неметаллов 1S1 2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5 период
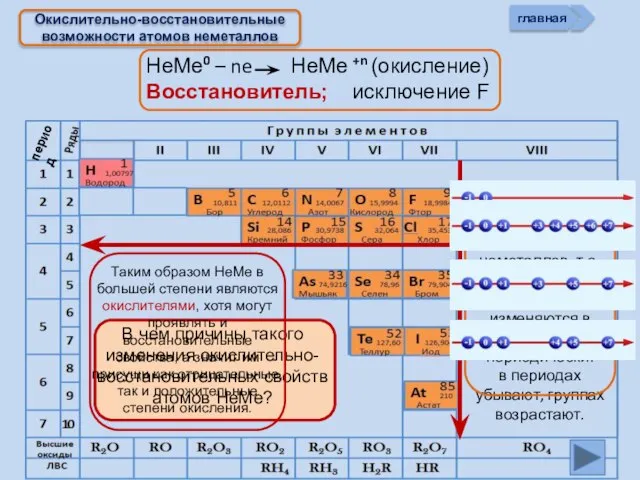
- 7. Окислительно-восстановительные возможности атомов неметаллов НеМе0 + (8 – n) e НеМе - (8 – n) (восстановление)
- 8. НеМе0 – ne НеМе +n (окисление) Восстановитель; исключение F Окислительно-восстановительные возможности атомов неметаллов главная период
- 9. главная период
- 10. главная период
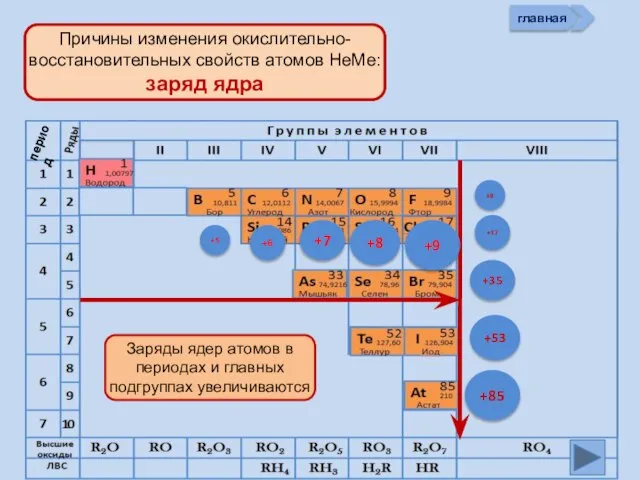
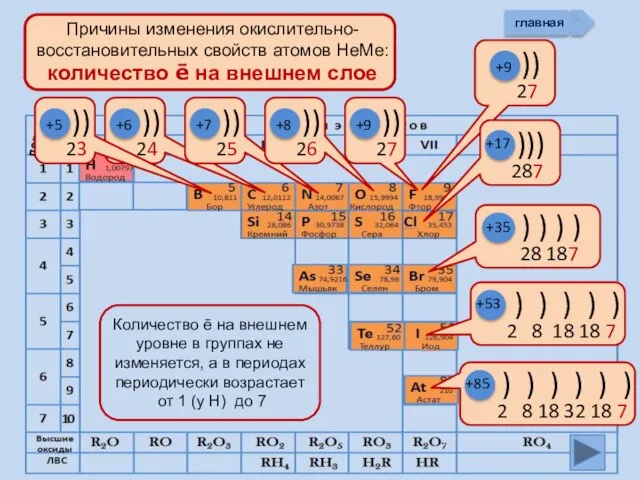
- 11. +5 +6 +7 +8 +9 +85 +17 +9 +53 +35 главная период
- 12. период
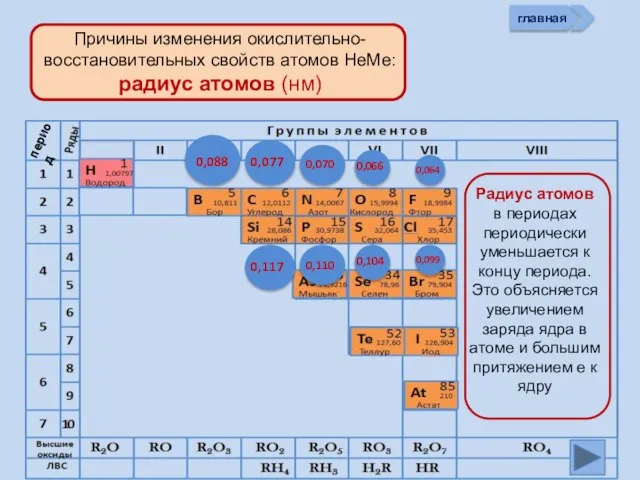
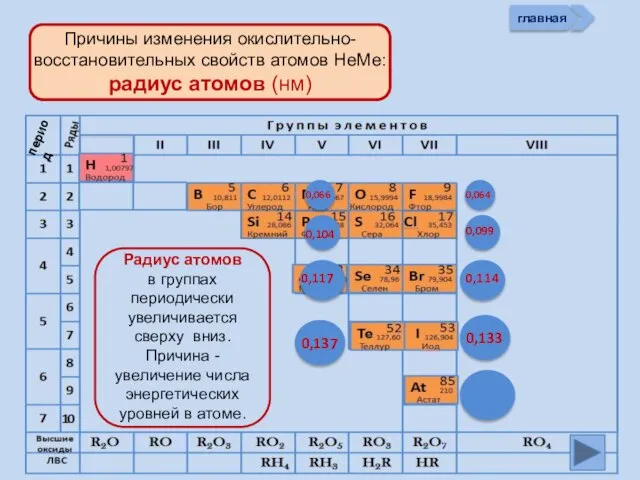
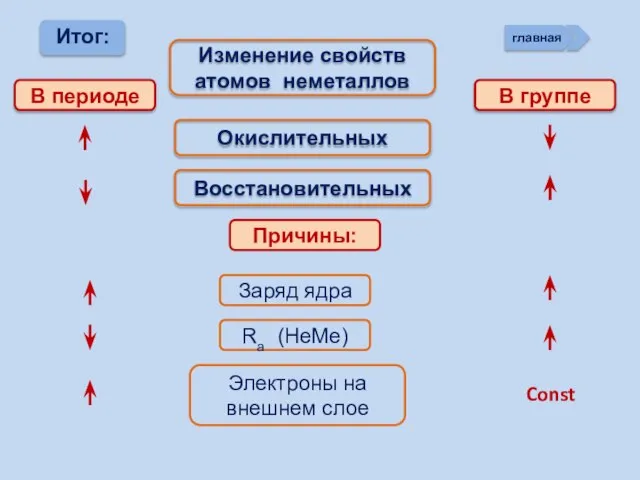
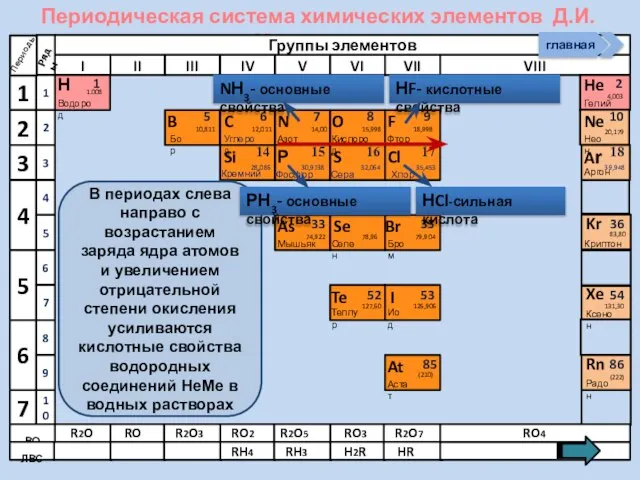
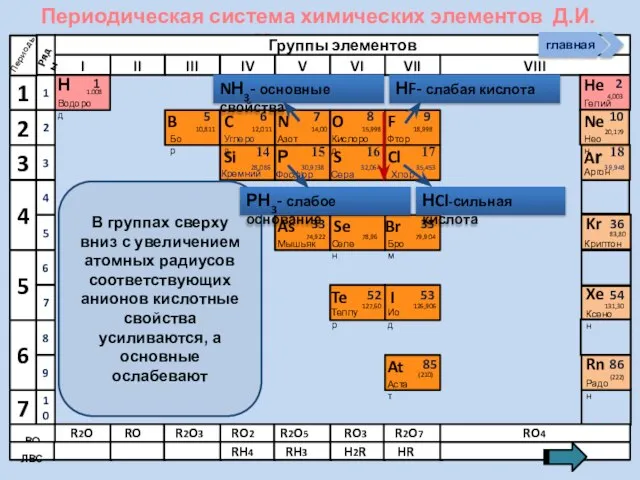
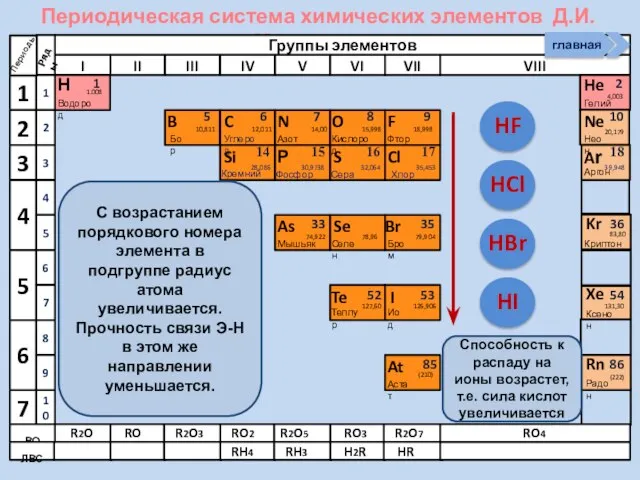
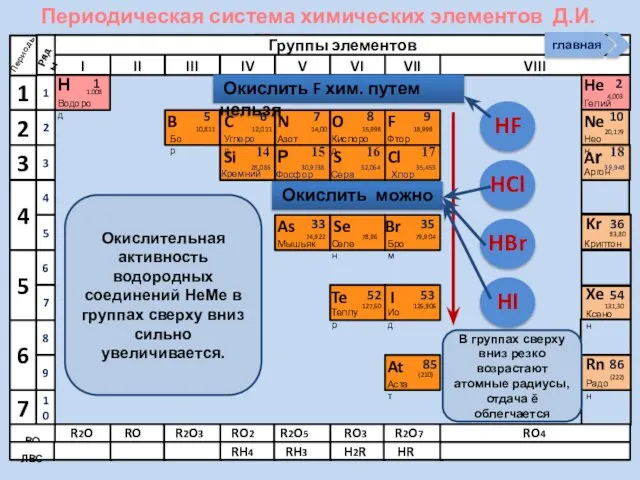
- 13. Изменение свойств атомов неметаллов В периоде В группе Окислительных Восстановительных Причины: Заряд ядра Ra (НеМе) Электроны
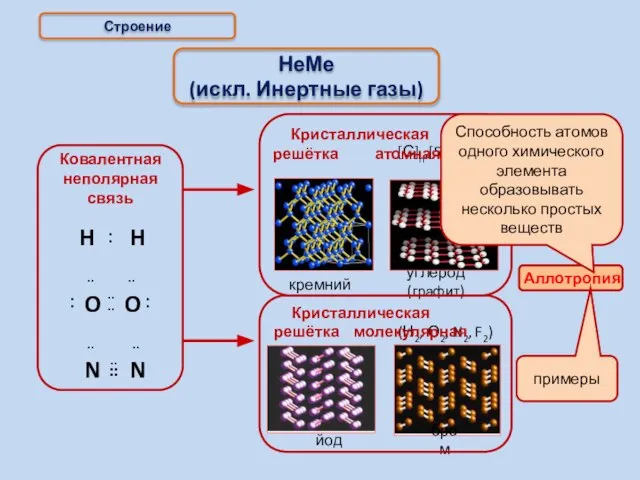
- 14. Строение НеМе (искл. Инертные газы) примеры (Н2, О2, N2, F2) йод бром Способность атомов одного химического
- 15. Аллотропия [Р]n а.кр.р. [Р]4 м.кр.р.
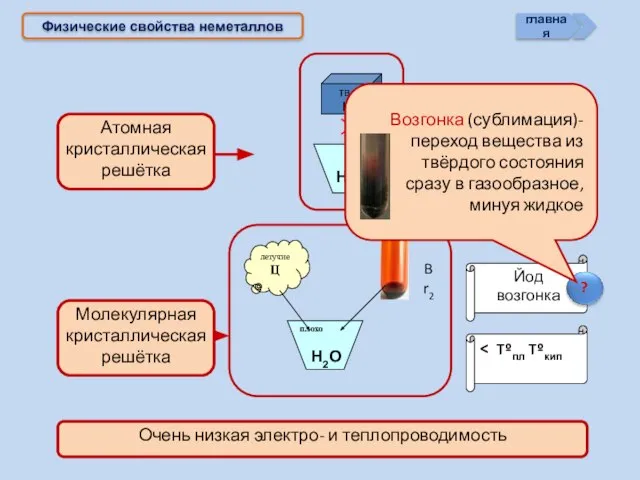
- 16. Физические свойства неметаллов > Tºпл Tºкип Йод возгонка Н2О Н2О
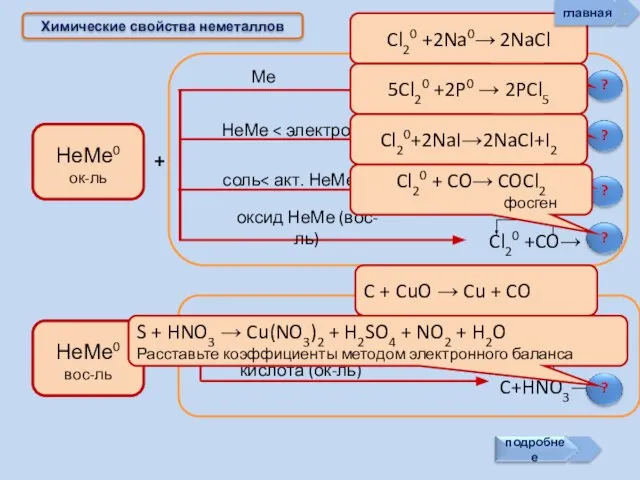
- 17. Химические свойства неметаллов + + Cl20 +2Na0→ 2NaCl 5Cl20 +2P0 → 2PCl5 Cl20+2NaI→2NaCl+I2 Cl20 + CO→
- 18. Химические свойства неметаллов Неметаллы могут: главная
- 19. ? Химические свойства неметаллов Неметаллы способны: Сl2 + Н2О = НСl + НСlO - 25 кДж.
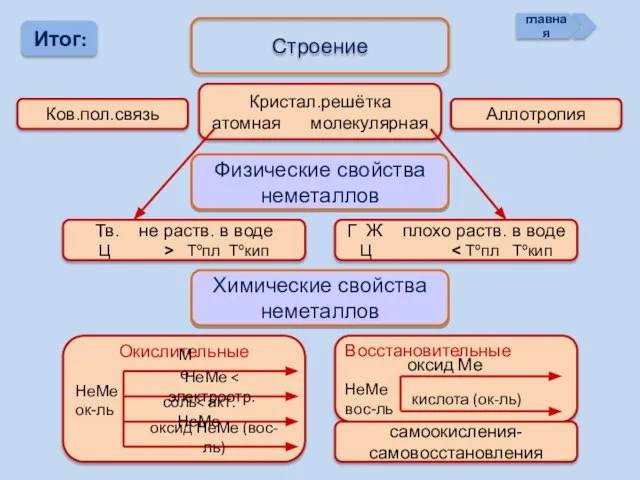
- 20. Итог: Строение Ков.пол.связь Кристал.решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. не раств. в воде Ц
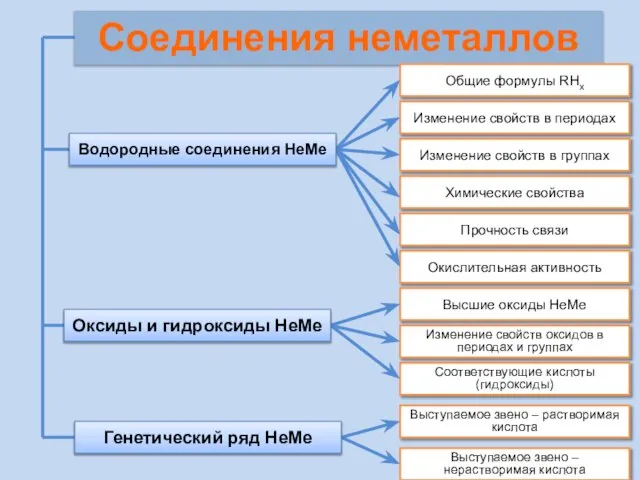
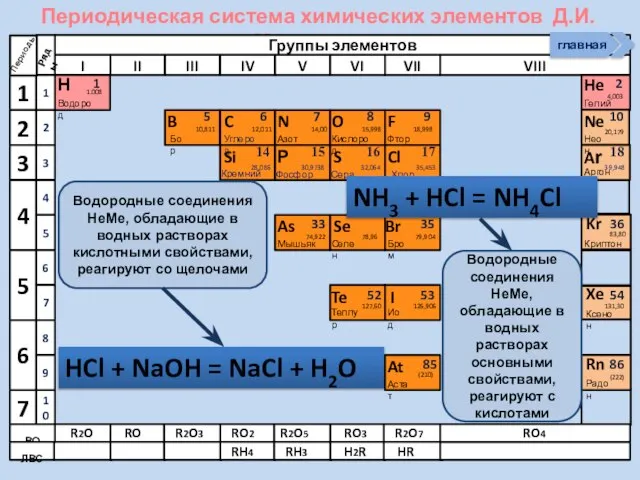
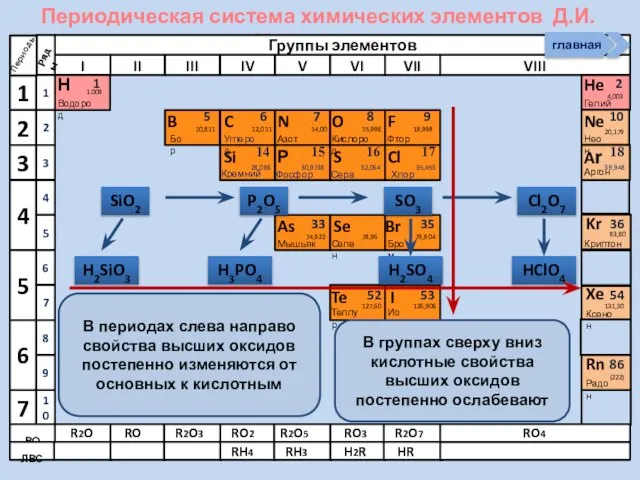
- 21. Соединения неметаллов Изменение свойств в периодах Изменение свойств в группах Общие формулы RHx Химические свойства Прочность
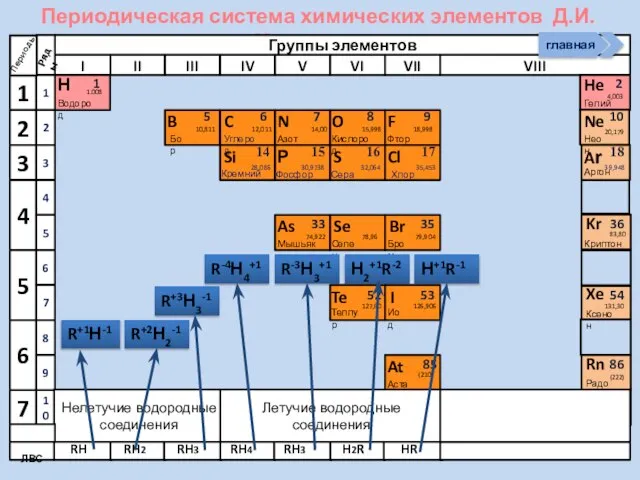
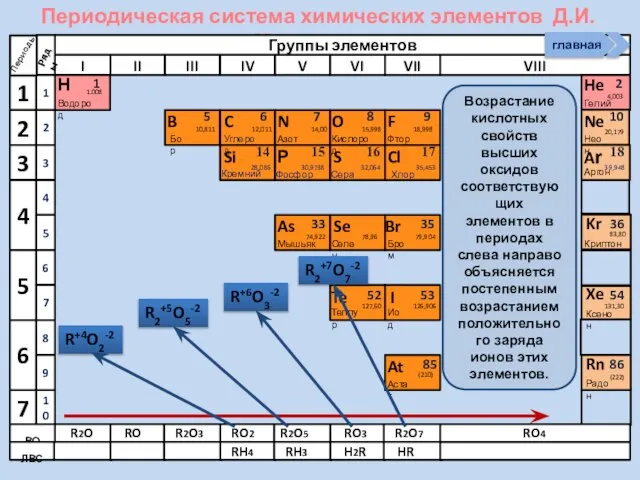
- 22. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 23. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
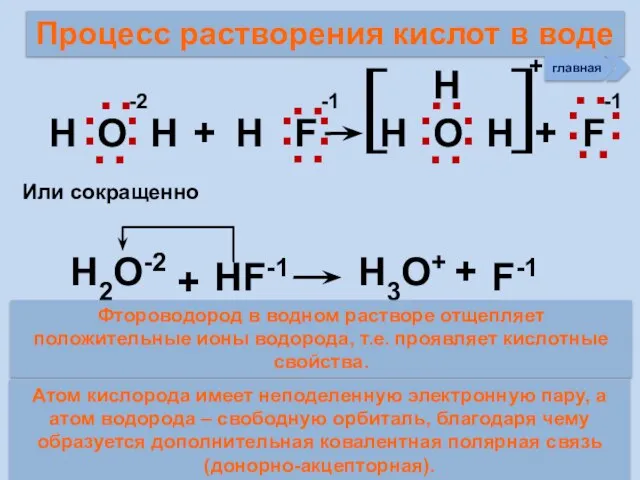
- 24. Процесс растворения кислот в воде Н О Н + Н F Н Н O Н +
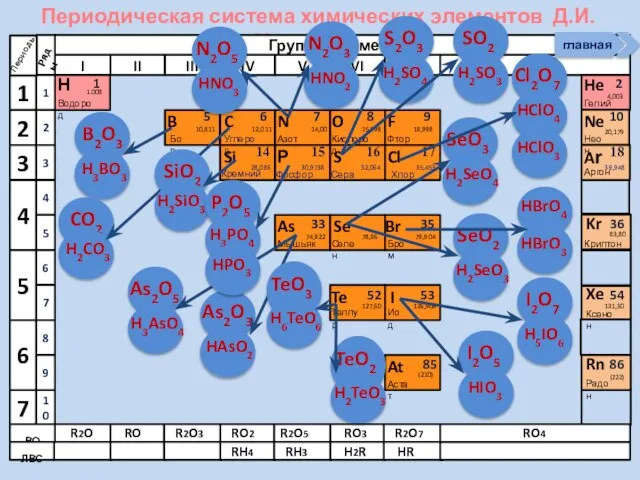
- 25. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
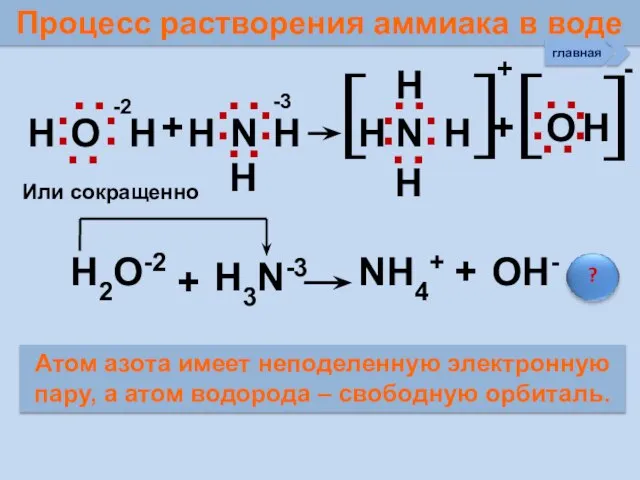
- 26. Процесс растворения аммиака в воде Н О Н + Н N Н Н N Н +
- 27. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 28. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 29. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 30. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 31. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 32. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
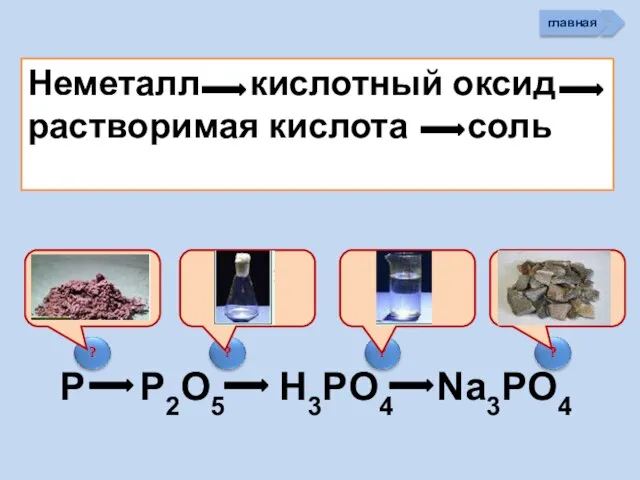
- 33. Неметалл кислотный оксид растворимая кислота cоль P P2O5 H3PO4 Na3PO4
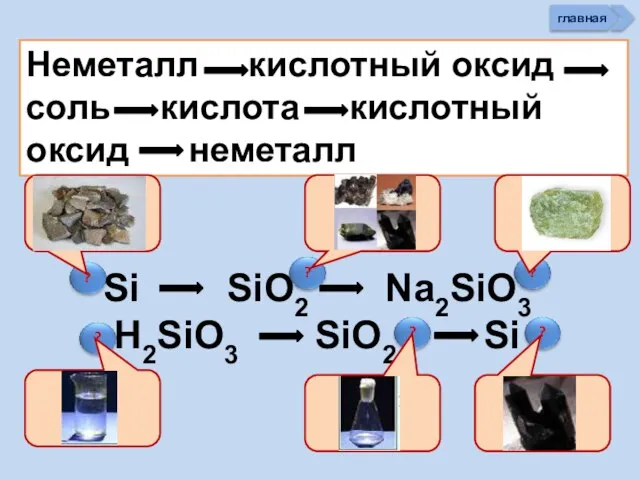
- 34. Неметалл кислотный оксид соль кислота кислотный оксид неметалл Si SiO2 Na2SiO3 H2SiO3 SiO2 Si
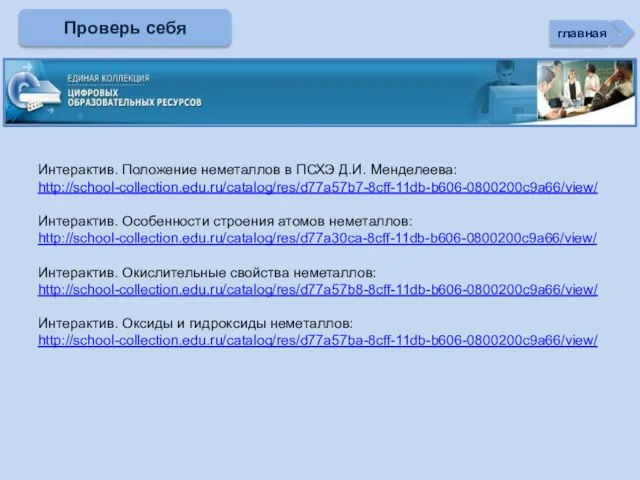
- 35. Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева: http://school-collection.edu.ru/catalog/res/d77a57b7-8cff-11db-b606-0800200c9a66/view/ Интерактив. Особенности строения атомов неметаллов: http://school-collection.edu.ru/catalog/res/d77a30ca-8cff-11db-b606-0800200c9a66/view/ Интерактив. Окислительные
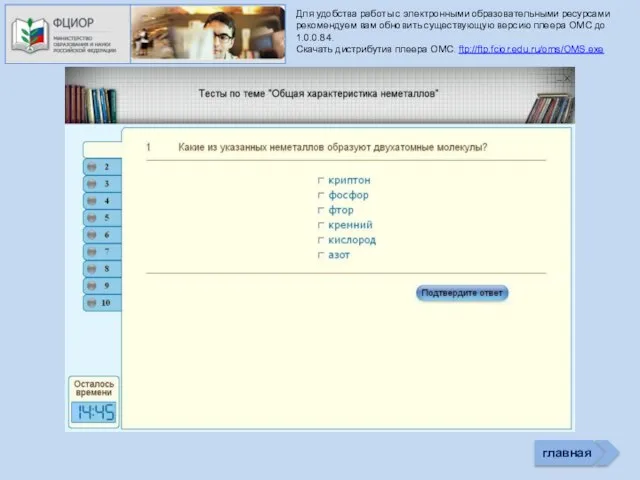
- 36. Для удобства работы с электронными образовательными ресурсами рекомендуем вам обновить существующую версию плеера ОМС до 1.0.0.84.
- 38. ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка
- 41. Скачать презентацию


![Аллотропия [Р]n а.кр.р. [Р]4 м.кр.р.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213447/slide-14.jpg)



 Презентация по Химии "Органическая химия" - скачать смотреть
Презентация по Химии "Органическая химия" - скачать смотреть  Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії, алотропні видозміни Оксигену і Буровые промывочные жидкости. Лекция 1
Буровые промывочные жидкости. Лекция 1 Гидроксид калия KOH
Гидроксид калия KOH Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна
Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна  Введение в химию гетероциклических соединений
Введение в химию гетероциклических соединений Кислород
Кислород Презентация по химии Чистые вещества и смеси
Презентация по химии Чистые вещества и смеси  Липидтердің алмасуы
Липидтердің алмасуы Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Алка́ны
Алка́ны Силикаты ленточного строения
Силикаты ленточного строения Визначення орбіталей та можливість їх існування
Визначення орбіталей та можливість їх існування АБС-пластик. Свойства
АБС-пластик. Свойства Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской области
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской области  Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Щелочные металлы
Щелочные металлы Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях А.М. Бутлеровтың химиялык кұрылыс теориясы
А.М. Бутлеровтың химиялык кұрылыс теориясы Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева Необычные минералы
Необычные минералы Цинк и его соединения
Цинк и его соединения Предельные углеводороды
Предельные углеводороды Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Получение водорода с использованием технологии газификации угля и отходов угольной промышленности
Получение водорода с использованием технологии газификации угля и отходов угольной промышленности Хімія в побуті Павлова Олена Дмитрівна, учитель хімії Мошнівської загальноосвітньої школи І-ІІІ ступенів Черкаської районної
Хімія в побуті Павлова Олена Дмитрівна, учитель хімії Мошнівської загальноосвітньої школи І-ІІІ ступенів Черкаської районної