Содержание
- 2. В периодической системе d-элементы или переходные металлы расположены в побочных подгруппах (или В подгруппах) всех восьми
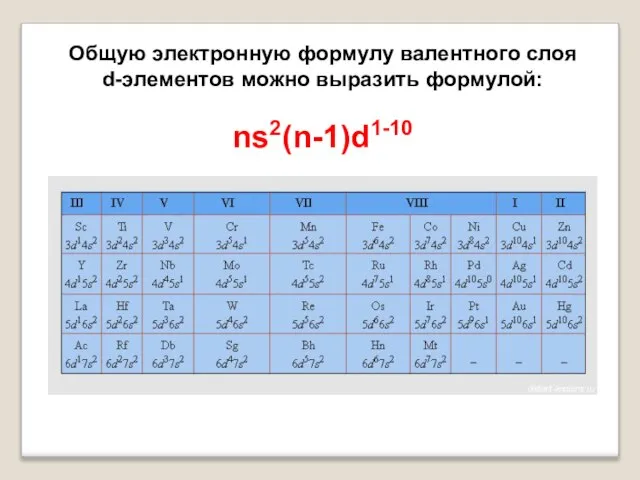
- 3. Общую электронную формулу валентного слоя d-элементов можно выразить формулой: ns2(n-1)d1-10
- 4. В периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено эффектом «d-сжатия», вызванного постепенным
- 5. У элементов IIIВ группы атомные радиусы возрастают, химическая активность увеличивается, благодаря чему они проявляют большее сходство
- 6. В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня. В
- 7. Таким образом, особенностями электронного строения d-элементов обусловлены и их свойства: а) большое разнообразие проявляемых валентностей и
- 8. Физические свойства d-металлов Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые
- 9. Химические свойства d-металлов Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается. Наиболее
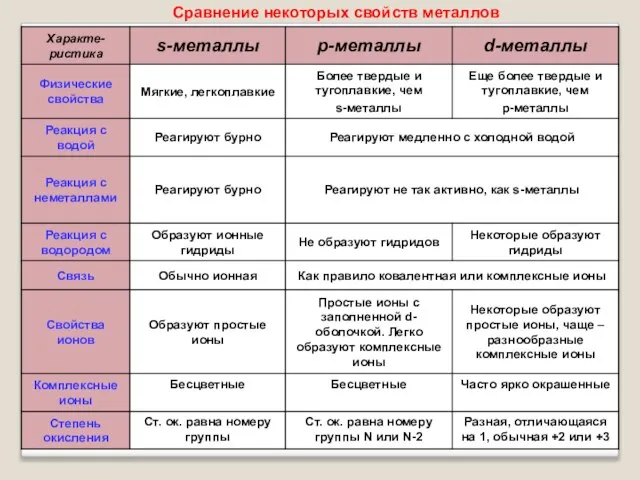
- 10. Сравнение некоторых свойств металлов
- 11. Строение и свойства соединений d-элементов зависят от степени окисления металла
- 12. Оксиды и гидроксиды d-элементов Переходные металлы реагируют с кислородом, образуя оксиды (искл. Ag, Au). Почти все
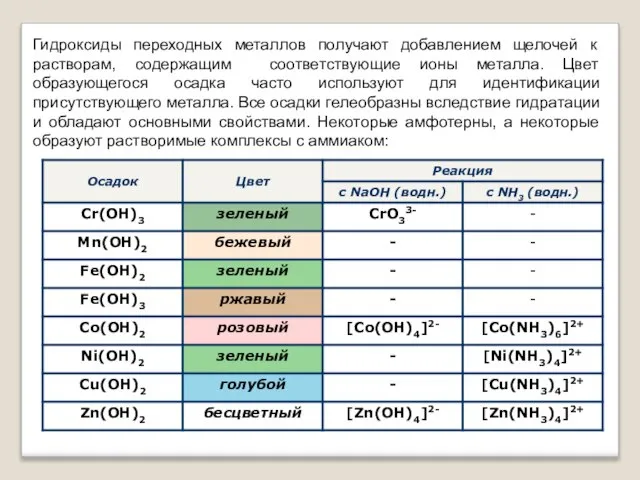
- 13. Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто
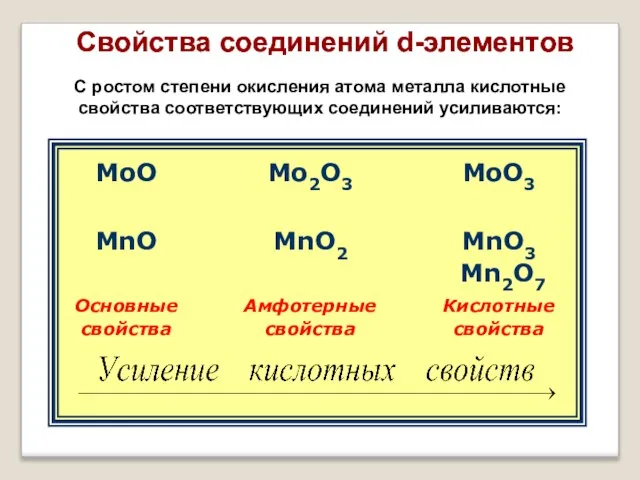
- 14. Свойства соединений d-элементов С ростом степени окисления атома металла кислотные свойства соответствующих соединений усиливаются: Свойства соединений
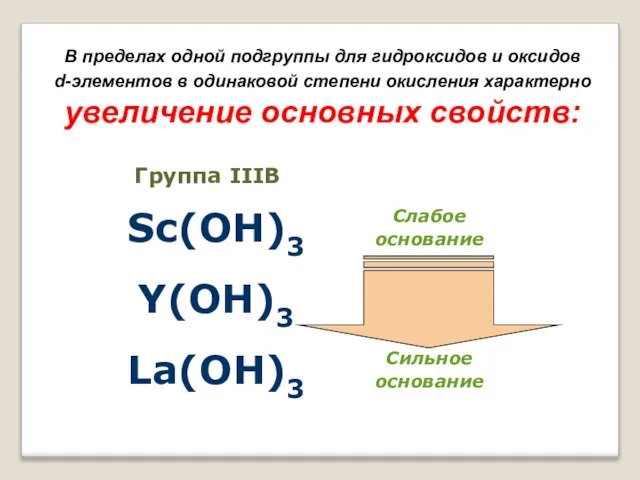
- 15. В пределах одной подгруппы для гидроксидов и оксидов d-элементов в одинаковой степени окисления характерно увеличение основных
- 16. В периоде кислотные свойства гидроксидов в высшей степени окисления металла усиливаются: Ti(OH)4 – HVO3 – H2CrO4
- 17. Общая электронная формула: […] ns 0÷2 (n–1)d 6÷10
- 18. Степени окисления
- 20. Скачать презентацию










![Общая электронная формула: […] ns 0÷2 (n–1)d 6÷10](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/557444/slide-16.jpg)

 Простой борный суперфосфат
Простой борный суперфосфат Алканы. Физические и химические свойства
Алканы. Физические и химические свойства Горение жидкостей
Горение жидкостей Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1 Масс-Спектроскопия
Масс-Спектроскопия Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Растворы. Определения и понятия
Растворы. Определения и понятия Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Застосування електролізу
Застосування електролізу Химический состав зеленого чая и его влияние на организм человека
Химический состав зеленого чая и его влияние на организм человека Дисперсные системы
Дисперсные системы Массообменные процессы
Массообменные процессы Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4)
Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4) Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Органические вяжущие. Битумы
Органические вяжущие. Битумы Электрохимия. Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции Експертиза коштовного каміння
Експертиза коштовного каміння Влияние кислотности среды на свойство белка
Влияние кислотности среды на свойство белка Тяжелые р – элементы -полуметаллы
Тяжелые р – элементы -полуметаллы Свойства неметаллов и их соединений. Практическая работа №4
Свойства неметаллов и их соединений. Практическая работа №4 Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Природній газ
Природній газ  Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Энергосиловое оборудование промышленных предприятий. Топливо и его виды
Энергосиловое оборудование промышленных предприятий. Топливо и его виды Алкины
Алкины Электролитическая диссоциация
Электролитическая диссоциация Класс «оксиды»
Класс «оксиды»