Содержание
- 2. РАСТВОРЫ Состоят из: - растворителя (компонент, присутствующий в растворе в преобладающем количестве или кристаллизующийся первым при
- 3. РАСТВОРЫ Состав растворов описывается с помощью концентрации - Молярная концентрация С – число молей растворенного вещества
- 4. РАСТВОРЫ Образование растворов - сложный физико-химический процесс Сопровождается: увеличением энтропии (S) системы; имеется тепловой эффект (ΔH).
- 5. РАСТВОРЫ Физическая теория растворов процесс растворения - распределение частиц растворенного вещества между частицами растворителя, при отсутствии
- 6. РАСТВОРЫ Химическая теория процесс растворения - образование смеси неустойчивых химических соединений переменного состава. Сопровождается тепловым эффектом
- 7. РАСТВОРЫ Современная теория При растворении - изменение свойств растворителя и растворенного вещества, что обусловлено взаимодействием частиц
- 8. РАСТВОРЫ Современная теория Процесс растворения – взаимодействие частиц разной полярности Полярность молекул – неравномерное распределение электрических
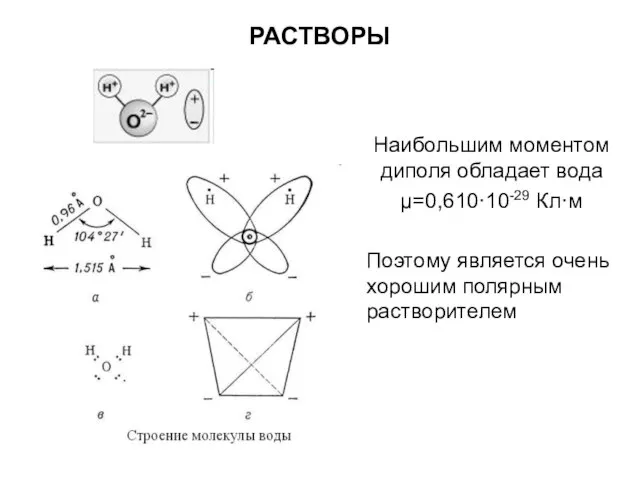
- 9. РАСТВОРЫ Наибольшим моментом диполя обладает вода μ=0,610·10-29 Кл·м Поэтому является очень хорошим полярным растворителем
- 10. РАСТВОРЫ Растворимость газов в газах Газообразное состояние характеризуется слабым взаимодействием между частицами и большими расстояниями между
- 11. РАСТВОРЫ Растворимость газов в жидкостях Зависит от: природы газа и жидкости, давления, температуры, концентрации растворенных в
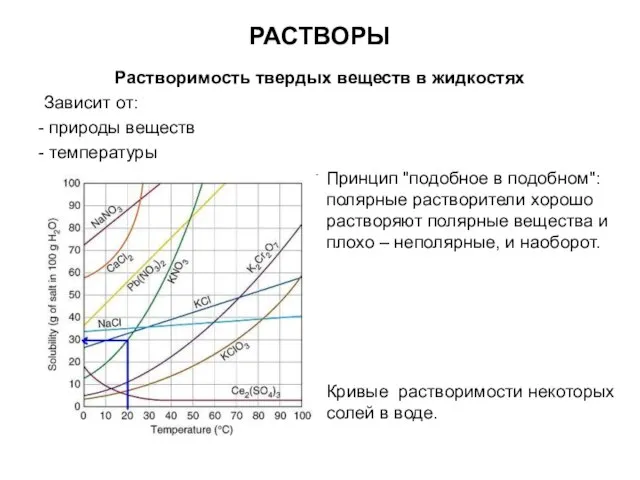
- 12. РАСТВОРЫ Растворимость твердых веществ в жидкостях Зависит от: природы веществ температуры Принцип "подобное в подобном": полярные
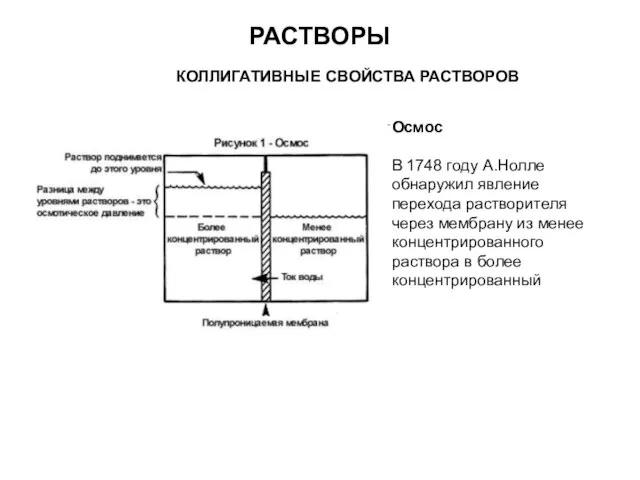
- 13. РАСТВОРЫ КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Осмос В 1748 году А.Нолле обнаружил явление перехода растворителя через мембрану из
- 14. РАСТВОРЫ КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Осмотическое давление разбавленных растворов Осмотическое давление π - давление, которое необходимо приложить
- 15. РАСТВОРЫ Значение осмоса Важную роль во многих биологических процессах при клеточных мембранах Участвует в переносе питательных
- 16. РАСТВОРЫ Первый закон Рауля: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в
- 17. РАСТВОРЫ Температура кристаллизации разбавленных растворов Температура начала кристаллизации - начало выделения кристаллов растворителя, при этом температура
- 18. РАСТВОРЫ Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же
- 20. Скачать презентацию














 Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Практическая работа по химии. Строение пламени
Практическая работа по химии. Строение пламени Кислоты
Кислоты Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Молярный объём
Молярный объём Псевдогалогены и их соединения
Псевдогалогены и их соединения Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС
Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич
Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови План розміщення добрив у польовій сівозміні. (Лабораторна робота 22)
План розміщення добрив у польовій сівозміні. (Лабораторна робота 22) Нанохімія та нанотехнології
Нанохімія та нанотехнології Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н.
Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н. МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ
МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ Ароматические системы
Ароматические системы Неорганические вещества
Неорганические вещества Буферные растворы
Буферные растворы Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Химические и физические явления
Химические и физические явления Отдельные классы дисперсных систем
Отдельные классы дисперсных систем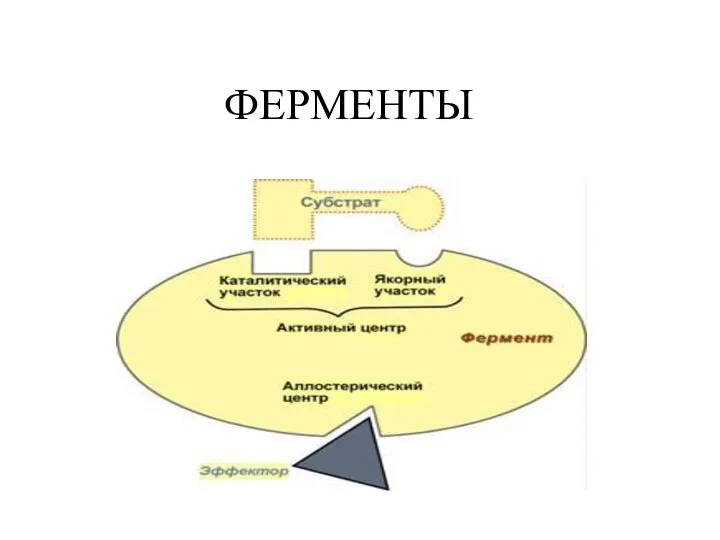 Ферменты. Значение ферментов
Ферменты. Значение ферментов Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Элементы 7 группы побочной подгруппы
Элементы 7 группы побочной подгруппы Современная система контроля и обеспечения качества лекарственных средств в Украине
Современная система контроля и обеспечения качества лекарственных средств в Украине Сложные эфиры
Сложные эфиры