Содержание
- 2. Электролиты - вещества, растворы или расплавы которых проводят электрический ток. К ним относятся вода, кислоты, основания
- 3. При растворении электролита диполи воды за счет ориентационного или ион-дипольного взаимодействия притягиваются к полярным молекулам или
- 4. Сильные и слабые электролиты Диссоциация может быть полной или частичной, что зависит от полярности связи в
- 5. Количественные характеристики электролитической диссоциации Степень диссоциации, α – это отношение числа молекул, распавшихся на ионы, к
- 7. Кислоты и основания в теории электролитической диссоциации Свойства водных растворов кислот и оснований определяются теми ионами,
- 8. Известны электролиты, которые при диссоциации образуют и ионы водорода, и гидроксид-ионы. Такие соединения называются амфотерными. Характер
- 9. Электролитическая диссоциация воды Вода – это слабый амфотерный электролит. Процесс диссоциации воды протекает с образованием ионов
- 10. Величина KW (H2O) позволяет рассчитывать характер среды в водных растворах. Для нейтральной среды [H+ ] =
- 11. Реакции в растворах электролитов Реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, называются
- 13. Скачать презентацию
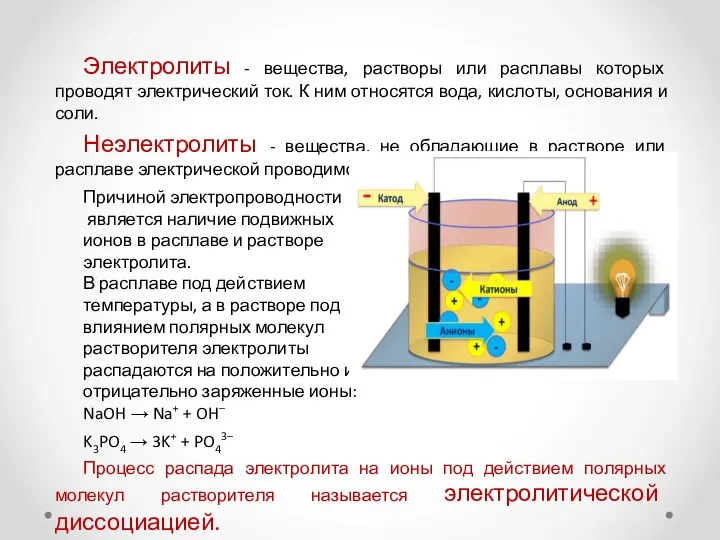
Электролиты - вещества, растворы или расплавы которых проводят электрический ток. К
Электролиты - вещества, растворы или расплавы которых проводят электрический ток. К
Неэлектролиты - вещества, не обладающие в растворе или расплаве электрической проводимостью.
Причиной электропроводности
является наличие подвижных
ионов в расплаве и растворе
электролита.
В расплаве под действием
температуры, а в растворе под
влиянием полярных молекул
растворителя электролиты
распадаются на положительно и
отрицательно заряженные ионы:
NaOH → Na+ + OH–
K3PO4 → 3K+ + PO43–
Процесс распада электролита на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
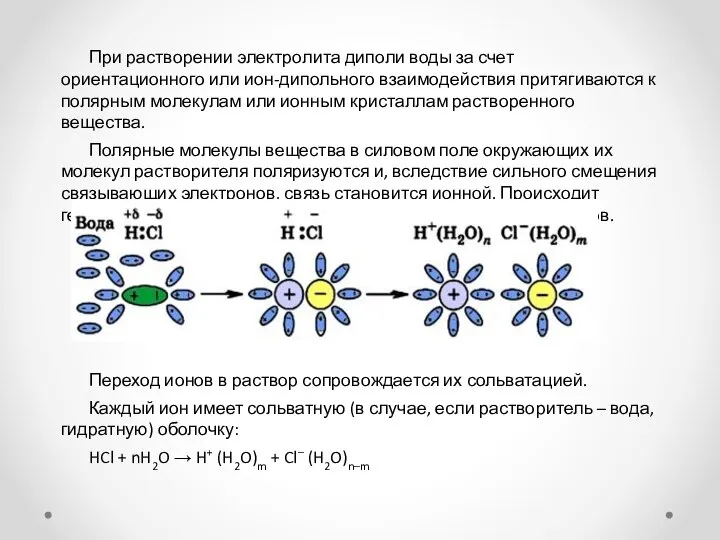
При растворении электролита диполи воды за счет ориентационного или ион-дипольного взаимодействия
При растворении электролита диполи воды за счет ориентационного или ион-дипольного взаимодействия
Полярные молекулы вещества в силовом поле окружающих их молекул растворителя поляризуются и, вследствие сильного смещения связывающих электронов, связь становится ионной. Происходит гетеролитический разрыв связи с образованием свободных ионов.
Переход ионов в раствор сопровождается их сольватацией.
Каждый ион имеет сольватную (в случае, если растворитель – вода, гидратную) оболочку:
HCl + nH2O → H+ (H2O)m + Cl– (H2O)n–m
Сильные и слабые электролиты
Диссоциация может быть полной или частичной, что
Сильные и слабые электролиты
Диссоциация может быть полной или частичной, что
Сильные электролиты в водном растворе полностью распадаются на ионы:
KА + nН2О → K+ (H2O)m + A- (H2O)n-m
К ним относятся вещества с ионной или сильнополярной связью:
многие неорганические кислоты – HCl, HNO3, H2SO4, HClO4 и др.,
гидроксиды щелочных и щелочноземельных металлов,
почти все соли.
Слабые электролиты частично диссоциируют на ионы при растворении в воде.
KА + nН2О → KA(H2O)m + K+ (H2O)k + A- (H2O)n-m-k
К ним относятся
вода,
почти все органические кислоты (СН3СООН, HCOOR, H2C2O4 и др.),
некоторые минеральные кислоты (HNO2, HCN, H2S, H2SiO3, H2CO3 и др.),
гидроксид аммония NH4OH,
все нерастворимые основания металлов,
некоторые соли – Mg(CN)2, HgCl2.
Количественные характеристики
электролитической диссоциации
Степень диссоциации, α – это отношение числа
Количественные характеристики
электролитической диссоциации
Степень диссоциации, α – это отношение числа
α= (Nдис./Nобщ.) × 100%
Степень диссоциации измеряется в процентах или долях единицы.
Если α = 0, то диссоциация отсутствует (неэлектролит),
если α = 1 или 100%, то диссоциация полная (сильный электролит).
Степень диссоциации зависит от природы растворителя, температуры, концентрации раствора.
При разбавлении раствора степень диссоциации возрастает.
При диссоциации слабых и средних электролитов в растворе устанавливается равновесие:
KА ⇄ K + + А–
где прямой процесс – диссоциация на ионы,
обратный процесс – ассоциация ионов в молекулы.
Кислоты и основания в теории электролитической диссоциации
Свойства водных растворов кислот
Кислоты и основания в теории электролитической диссоциации
Свойства водных растворов кислот
Кислоты можно определить как электролиты, образующие при диссоциации в водных растворах в качестве катионов только ионы водорода,
а основания – как электролиты, образующие в качестве анионов только гидроксид-ионы.
Многоосновные кислоты диссоциируют обычно постепенно (ступенчатая диссоциация):
H2SO3 ⇄ H + + HSO3 –
2. HSO3 - ⇄ H + + SO3 2- ,
причем по первой ступени степень диссоциации больше, чем по второй.
Ступенчатая диссоциация характерна и для оснований, содержащих несколько гидроксогрупп в молекуле:
1. Mg(OH)2 ⇄ MgOH+ + OH- ;
2. MgOH+ ⇄ Mg 2+ +OH- .
Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей.
Известны электролиты, которые при диссоциации образуют и ионы водорода, и гидроксид-ионы.
Известны электролиты, которые при диссоциации образуют и ионы водорода, и гидроксид-ионы.
Характер диссоциации гидроксидов Э-О-Н зависит от сравнительной степени полярности связей: Э–О и О–Н.
Если полярность связи Н–О больше полярности связи Э–О, гидроксид диссоциирует по кислотному типу, например: HOCl ⇄ H + + ClO- .
Если полярность связи Н–О меньше полярности связи Э–О, гидроксид диссоциирует по основному типу, например: NaOH ⇄ Na+ + OH- .
Если полярность связи Н–О примерно равна полярности связи Э–О, то гидроксид диссоциирует по амфотерному типу; например, простейшим амфотерным соединением является вода: H2O ⇄ H + + OH- .
Электролитическая диссоциация воды
Вода – это слабый амфотерный электролит.
Процесс диссоциации
Электролитическая диссоциация воды
Вода – это слабый амфотерный электролит.
Процесс диссоциации
Н2О ⇄ Н + + ОН–
и последующей гидратацией ионов водорода:
Н+ + Н2О → Н3О +
Вода является слабым электролитом, при 22 °С степень
диссоциации воды равна 1,8×10–9 ,
т.е. из 555 миллионов молекул диссоциирует только одна.
Применяя к процессу диссоциации воды закон
действующих масс, можно выразить КД воды:
Kд = [H +][OH−]/ [H2O]
При 22 °С КД = 1,8×10–16.
Так как степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул воды можно считать постоянной и равной: [H2O] = 1000/18,016 = 55,56 моль/л.
[H+ ][OH– ] = КД × [H2O] = 1,8×10–16 ×55,56 = 10–14 = KW H2O .
[H+ ][OH– ] = 10–14 = KW H2O
Таким образом, и для чистой воды и для водных растворов произведение концентрации ионов водорода и гидроксид-ионов величина постоянная и называется ионным произведением воды.
Величина KW (H2O) позволяет рассчитывать характер среды в водных растворах.
Для
Величина KW (H2O) позволяет рассчитывать характер среды в водных растворах.
Для
в кислой среде [H+ ] > 10–7 ,
а в щелочной среде [H+ ] < 10–7 .
Для удобства пользуются не величиной концентрации ионов водорода, а величиной водородного показателя, рН.
Он равен отрицательному десятичному логарифму концентрации ионов водорода: рH = -lg[H+ ].
В нейтральной среде рН = 7,
в кислой среде рН < 7,
в щелочной среде pH > 7.
Реакции в растворах электролитов
Реакции в растворах электролитов, при которых не
Реакции в растворах электролитов
Реакции в растворах электролитов, при которых не
Различают 4 типа ионообменных реакций в растворах электролитов, равновесие которых сильно смещено в сторону продуктов реакции.
Протекание таких реакций определяется правилом Бертолле –
реакции обмена в растворах электролитов идут практически необратимо и до конца, когда в качестве продуктов реакции образуется
либо малорастворимые вещества (осадки и газы),
либо малодиссоциированные соединения (слабые электролиты или комплексные ионы).








 Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Аналитическая химия
Аналитическая химия Rates of reaction
Rates of reaction Светоносный элемент
Светоносный элемент Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Сероводород. Сульфиды
Сероводород. Сульфиды Аммиак. Соли аммония. Методы получения
Аммиак. Соли аммония. Методы получения Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические «Природные источники углеводородов и их переработка»
«Природные источники углеводородов и их переработка» Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Металлы Общая характеристика
Металлы Общая характеристика Классификация веществ
Классификация веществ Кондуктометрия
Кондуктометрия Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Серебро. Химические свойства
Серебро. Химические свойства Химические свойства неорганических соединений
Химические свойства неорганических соединений Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Лекарственное растительное сырье, содержащее жиры
Лекарственное растительное сырье, содержащее жиры Алкалоидтар негіздік қасиеттері бар азотты органикалық қосылыстар
Алкалоидтар негіздік қасиеттері бар азотты органикалық қосылыстар Неметаллические материалы
Неметаллические материалы Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см
Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см Колообіг нітрогену в природі
Колообіг нітрогену в природі Методи очищення води в побуті
Методи очищення води в побуті Обмен углеводов. Углеводы как химические соединения. Функции углеводов
Обмен углеводов. Углеводы как химические соединения. Функции углеводов Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах
Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки
Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома
Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома