Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Содержание
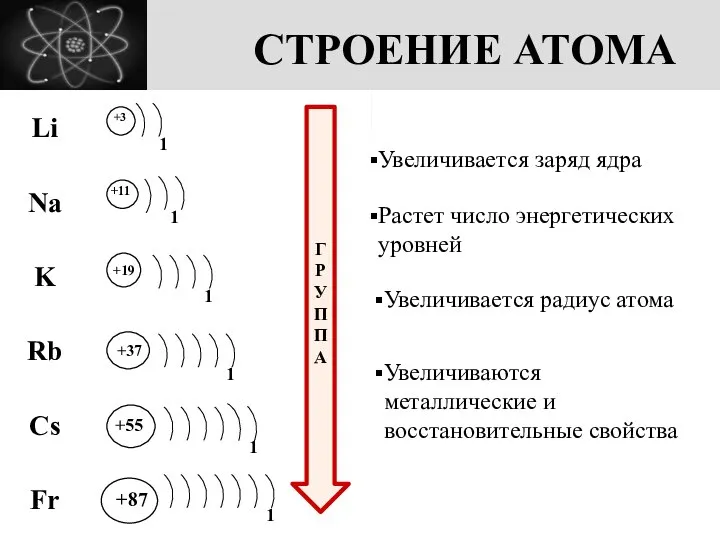
- 3. СТРОЕНИЕ АТОМА +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 ГРУППА Увеличивается
- 4. СТЕПЕНЬ ОКИСЛЕНИЯ +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 - 1
- 5. ЗАПОМНИ! Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1 NaOH, K2O,
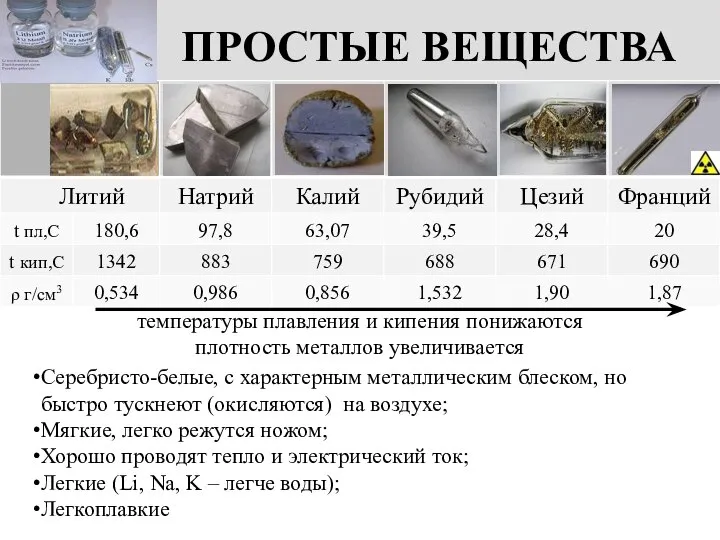
- 6. ПРОСТЫЕ ВЕЩЕСТВА Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе; Мягкие, легко режутся
- 7. ХИМИЧЕСКИЕ СВОЙСТВА Металлы I группы главной подгруппы – наиболее активные металлы, обладают высокой восстановительной способностью В
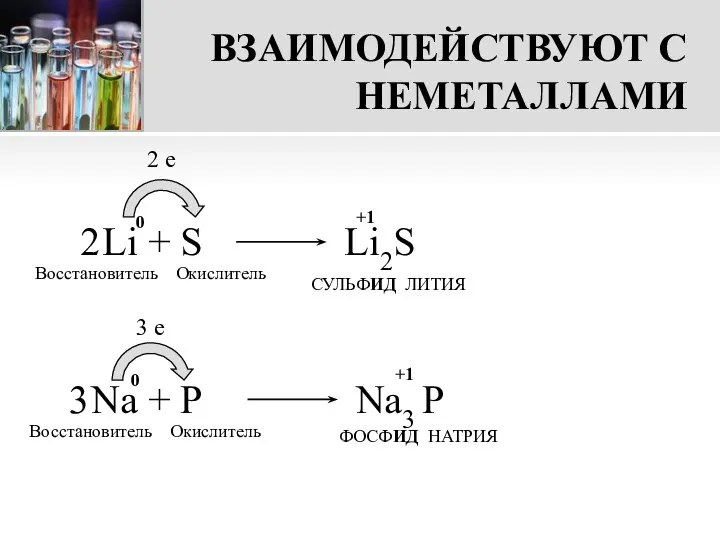
- 8. ВЗАИМОДЕЙСТВУЮТ С НЕМЕТАЛЛАМИ Li + S 2 e Восстановитель Окислитель СУЛЬФИД ЛИТИЯ Na + P 3
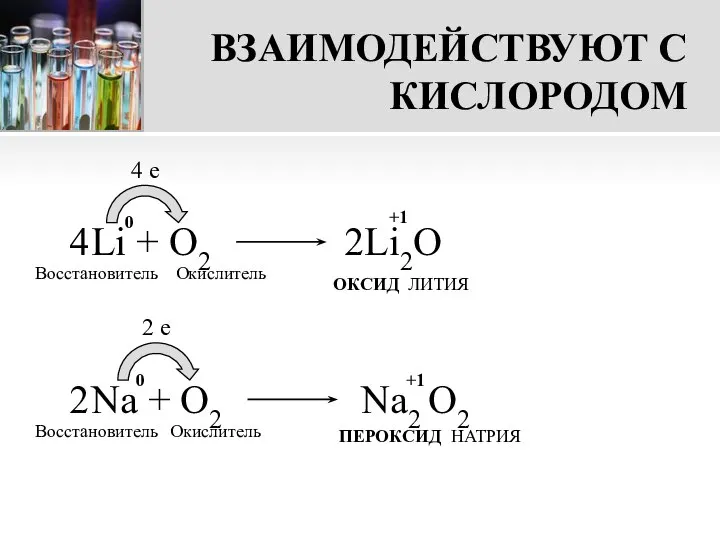
- 9. ВЗАИМОДЕЙСТВУЮТ С КИСЛОРОДОМ Li + О2 4 e Восстановитель Окислитель ОКСИД ЛИТИЯ Na + O2 2
- 10. ВНИМАНИЕ! При взаимодействии с кислородом только литий образует оксид. Другие металлы I группы главной подгруппы при
- 11. A ЗНАЕТЕ ЛИ ВЫ? При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию -
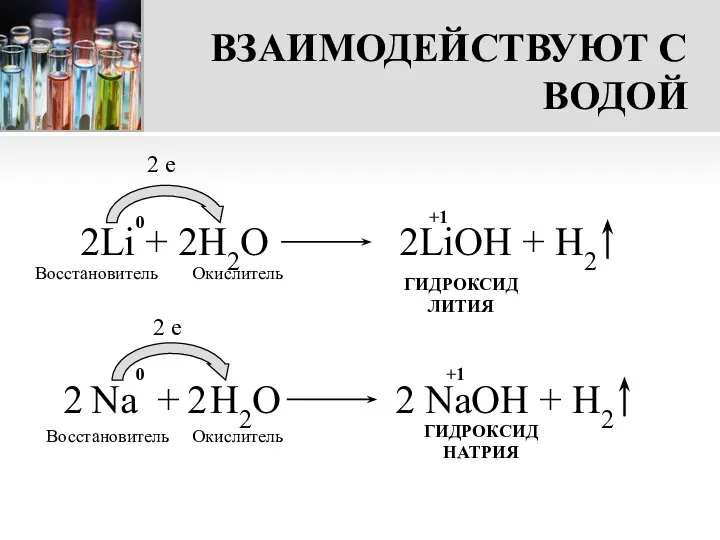
- 12. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В
- 13. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ 2Li + 2H2О 2LiOH + H2 2 e Восстановитель Окислитель ГИДРОКСИД ЛИТИЯ Восстановитель
- 14. ХРАНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят
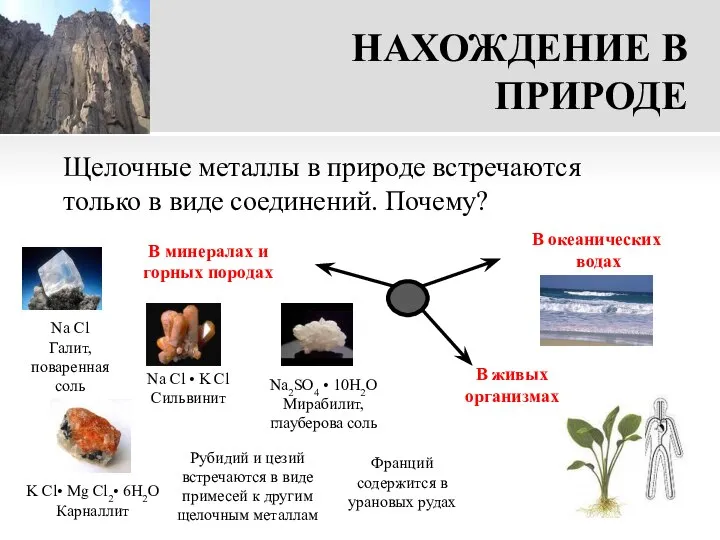
- 15. НАХОЖДЕНИЕ В ПРИРОДЕ Щелочные металлы в природе встречаются только в виде соединений. Почему? Na Cl Галит,
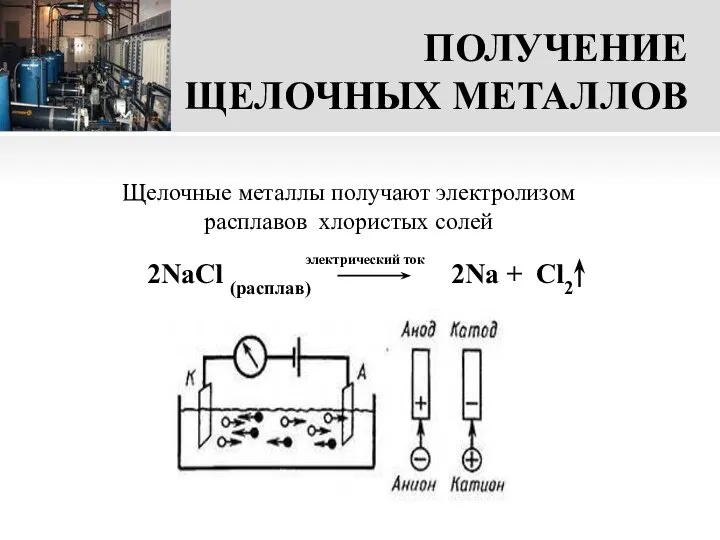
- 16. ПОЛУЧЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ 2NaCl (расплав) 2Na + Cl2 Щелочные металлы получают электролизом расплавов хлористых солей электрический
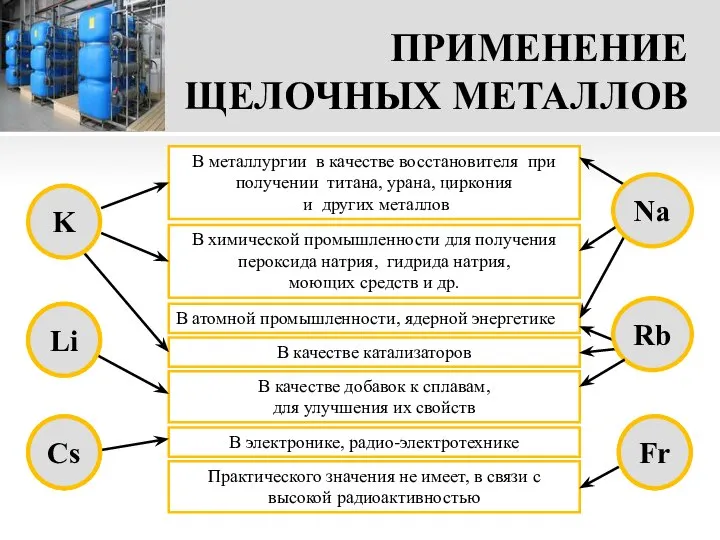
- 17. ПРИМЕНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ В металлургии в качестве восстановителя при получении титана, урана, циркония и других металлов
- 19. Скачать презентацию








 Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач
Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества
Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества Микроскопическая симметрия. Пространственные решетки. Решетки Бравэ
Микроскопическая симметрия. Пространственные решетки. Решетки Бравэ Характеристика дефектов. Растворы влияющие на степень износа тканей
Характеристика дефектов. Растворы влияющие на степень износа тканей Факторы почвообразования
Факторы почвообразования Золото и серебро
Золото и серебро ХТС производства азотной кислоты
ХТС производства азотной кислоты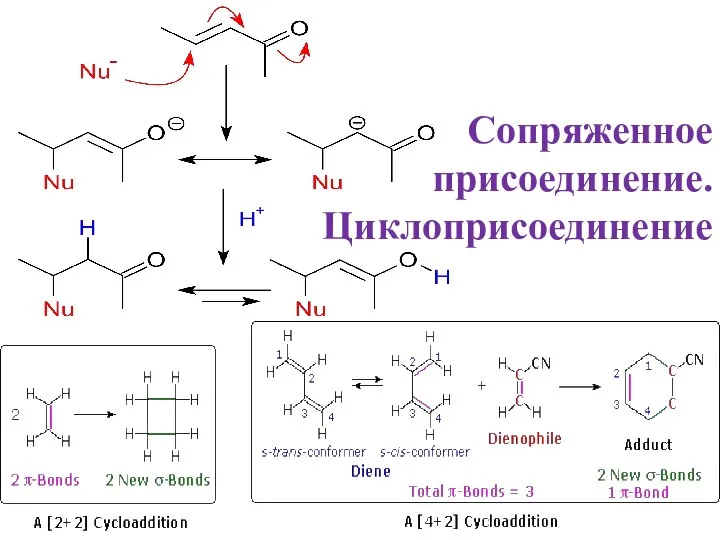 Сопряженное присоединение. Циклоприсоединениеie
Сопряженное присоединение. Циклоприсоединениеie Презентация Свойства черных и цветных металлов
Презентация Свойства черных и цветных металлов  Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы Макро, микро и ультрамикроэлементы. Их роль
Макро, микро и ультрамикроэлементы. Их роль Строение и функция белков
Строение и функция белков Предмет химии. Вещества. Изучаемые понятия: Вещество и тело. Атом и молекула. Свойства вещ
Предмет химии. Вещества. Изучаемые понятия: Вещество и тело. Атом и молекула. Свойства вещ Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі
Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі Горные породы, минералы, полезные ископаемые
Горные породы, минералы, полезные ископаемые Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Геологические условия формирования месторождений полезных ископаемых. (Лекция 3)
Геологические условия формирования месторождений полезных ископаемых. (Лекция 3) Полиакрилаты в медицине
Полиакрилаты в медицине Warm-Up
Warm-Up Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Микроудобрение для продуктивности выращивания сельскохозяйственных культур
Микроудобрение для продуктивности выращивания сельскохозяйственных культур Роль спиртов в жизни человека
Роль спиртов в жизни человека Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Биологическая коррозия и защита строительных материалов и конструкций от биоповреждений
Биологическая коррозия и защита строительных материалов и конструкций от биоповреждений Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии
Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии Органическая химия. Скорость химических реакций
Органическая химия. Скорость химических реакций Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) БЕЛКИ, ИХ СТРУКТУРА, СВОЙСТВА. БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ. Лепешенко Т.И. ГБОУ НПО РО ПУ № 61 Г. Новошахтинск Ростовской обла
БЕЛКИ, ИХ СТРУКТУРА, СВОЙСТВА. БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ. Лепешенко Т.И. ГБОУ НПО РО ПУ № 61 Г. Новошахтинск Ростовской обла