Содержание
- 2. задание № 1 Выбрать из данного перечня веществ электролиты и неэлектролиты: KCl, CuO, H2SO4, Cu(OH)2, BaSO4,
- 3. Фронтальный опрос: Какие вещества называются электролитами? Какие вещества к ним относятся? Что такое электролитическая диссоциация? Что
- 4. Реакции ионного обмена Цель: выяснить, какие реакции называются реакциями ионного обмена и научиться составлять ионные уравнения,
- 5. Три пути ведут к знанию: Путь размышления - это самый благородный; Путь подражания - это путь
- 6. Правила «выживания» в химической лаборатории 1.Выполнять только те опыты, которые указаны в инструкции. 2.Использовать растворы в
- 7. Слейте попарно растворы: А) сульфата меди и гидроксида натрия Б) карбоната калия и соляной кислоты В)
- 8. Алгоритм составления реакций ионного обмена. Записываем молекулярное уравнение, расставляем коэффициенты. FeCl3 + 3NaOH = Fe(OH)3 +3NaCl
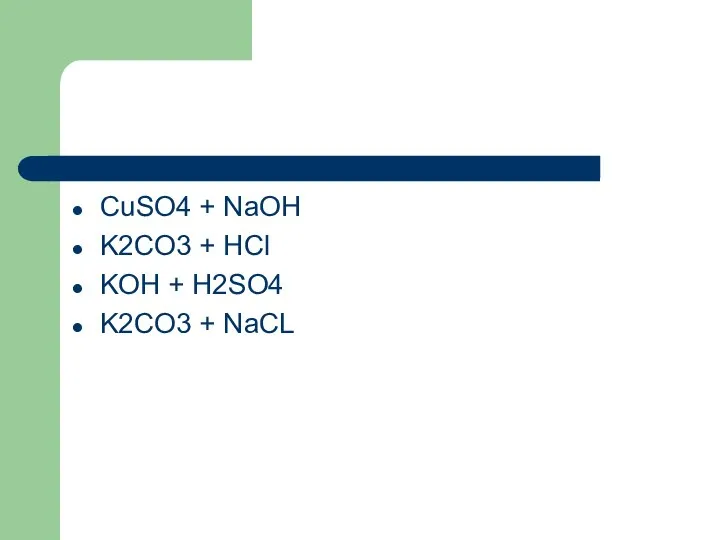
- 9. CuSO4 + NaOH K2CO3 + HCl KOH + H2SO4 K2CO3 + NaCL
- 10. Реакции ионного обмена - это реакции, протекающие между ионами в растворах электролитов.
- 11. Реакции ионного обмена протекают до конца, если: 1. выпадает осадок (↓) 2. выделяется газ (↑) 3.
- 12. Условия необратимого протекания реакций ионного обмена: Если выделится газ- это раз; И получится вода - это
- 13. Применение реакций ионного обмена Разрыхлители теста. Определение качества воды. Устранение жесткости воды. Определение качества продуктов питания.
- 14. Силу уму придают упражнения
- 15. 1. Реакции ионного обмена – это реакции: А. Разложения. В. Обмена Б. Замещения. Д. Соединения 2.
- 16. Проверка 1 – в 2 – в 3 – д 4 – в 5 – б
- 18. Скачать презентацию














 Підгрупа карбону
Підгрупа карбону Презентация по Химии "азотная кислота" - скачать смотреть бесплатно
Презентация по Химии "азотная кислота" - скачать смотреть бесплатно Вода и другие макронутриенты (органические кислоты, дубильные вещества, пигменты и фитонциды)
Вода и другие макронутриенты (органические кислоты, дубильные вещества, пигменты и фитонциды) Биологически важные химические элементы. Неорганические соединения
Биологически важные химические элементы. Неорганические соединения Твердые тела и их физические свойства
Твердые тела и их физические свойства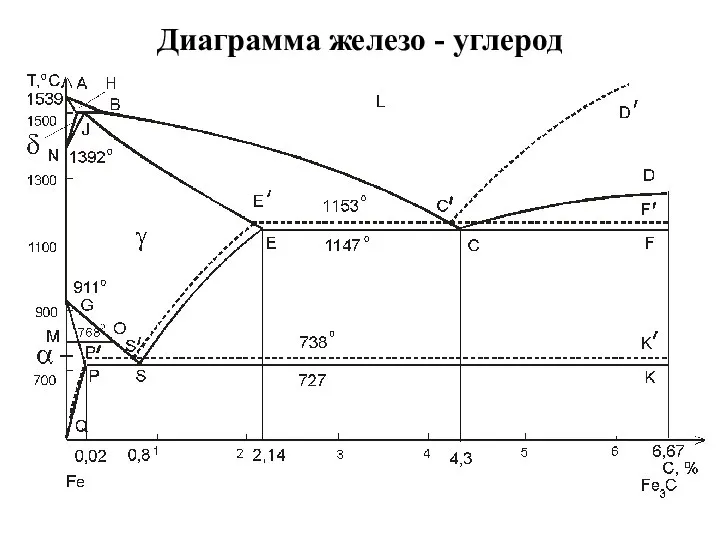 Диаграмма железо - углерод
Диаграмма железо - углерод Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Структурная и пространственная изомерия
Структурная и пространственная изомерия Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Презентация по Химии "d — элементы" - скачать смотреть
Презентация по Химии "d — элементы" - скачать смотреть  Химический состав клетки. Неорганические вещества клетки. Глава 1
Химический состав клетки. Неорганические вещества клетки. Глава 1 Теория строения химических веществ
Теория строения химических веществ Азот и его соединения Презентация учителя химии МОУ СОШ №1 г. Алексеевки Белгородской области Е.П. Харченко для 9 класса
Азот и его соединения Презентация учителя химии МОУ СОШ №1 г. Алексеевки Белгородской области Е.П. Харченко для 9 класса Влияние границы раздела с наполнителем на надмолекулярную структуру линейных и пространственных аморфных полимеров
Влияние границы раздела с наполнителем на надмолекулярную структуру линейных и пространственных аморфных полимеров Формулы солей
Формулы солей Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Карбоновые кислоты
Карбоновые кислоты Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия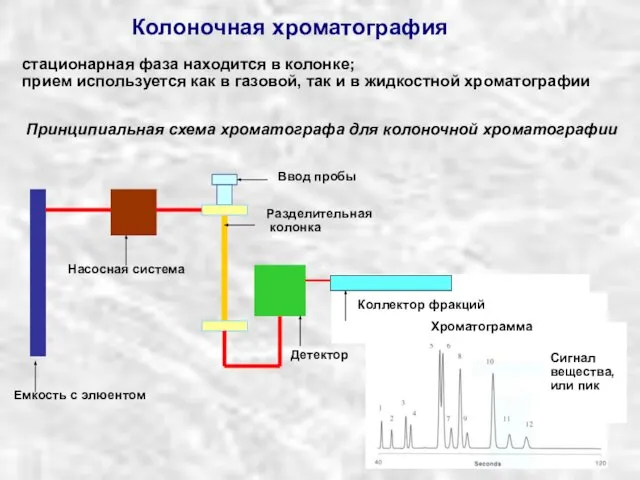 Колоночная хроматография
Колоночная хроматография Стеариновая кислота
Стеариновая кислота Презентация по Химии "Предмет химии. Вещества" - скачать смотреть
Презентация по Химии "Предмет химии. Вещества" - скачать смотреть  Периодический закон Д.И. Менделеева (8 класс)
Периодический закон Д.И. Менделеева (8 класс) Химический состав клетки
Химический состав клетки Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Свойства растворов ВМС: особенности растворения, реологические свойства, осмос. Устойчивость растворов ВМС
Свойства растворов ВМС: особенности растворения, реологические свойства, осмос. Устойчивость растворов ВМС Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров Химическая связь
Химическая связь