Содержание
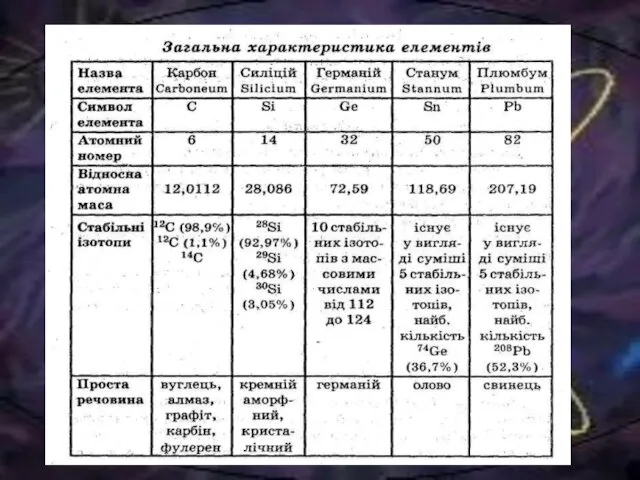
- 3. Для германія не характерне утворення рудних скупчень. У природі він зустрічається як елемент, що супроводжує силікати
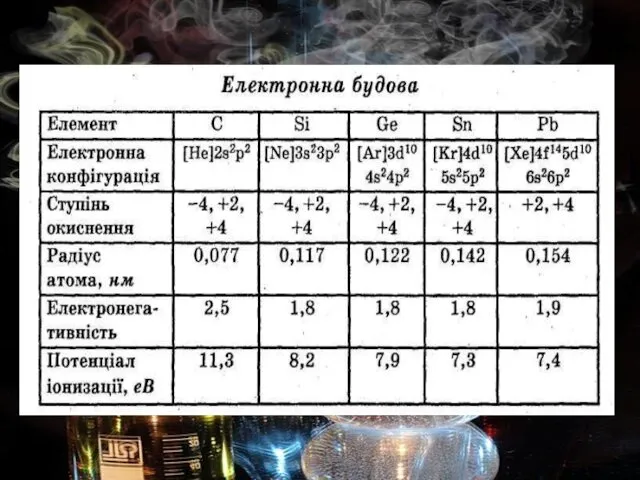
- 5. Розміри атомів у ряді С—Si—Ge—Sn—Pb зростають, що супроводжується посиленням металічних (відновних) і ослабленням неметалічних (окисних) властивостей.
- 7. Сполуки елементів з воднем мають загальну формулу ЕН4. їхня стійкість знижується в ряді СН4— SiH4—GeH4 —SnH4—
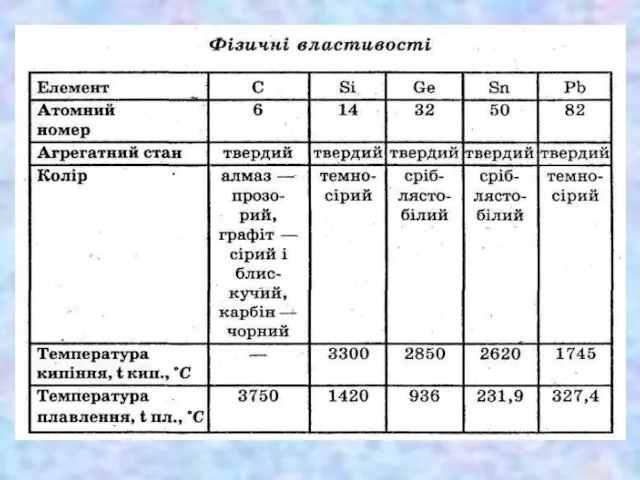
- 8. КАРБОН Фізичні властивості Вільний Карбон С може утворювати 4 основні алотропні модифікації: алмаз, графіт, карбін і
- 9. Фуллерен С60 Атоми Карбону утворюють замкнуті сітчасті структури – фуллерени. Найбільш відомий фуллерен із 60 атомів
- 10. Активні метали при взаємодії з вуглецем утворюють карбіди. У цьому випадку відновні властивості металів вище, ніж
- 11. Хімічні властивості Найбільшу хімічну активність мають природні вуглецеві матеріали, але незалежно від модифікації, Карбон є відновником.
- 12. Одержання CO утворюється при неповному згорянні вуглецю або вуглецевмісних сполук: У лабораторії CO одержують зневоднюванням мурашиної
- 13. Хімічні властивості Карбон (ІІ) оксид проявляє низьку хімічну активність, однак у реакціях, у яких СО бере
- 14. Сильною отруйною дією вирізняється й продукт взаємодії карбон (II) оксиду з аміаком (ціанідна кислота): CO +
- 15. В деяких місцях нашої планети СО2 виділяється із недрів землі постійно. Більше 2 тис. років людству
- 16. Одержання У природі СО2 утворюється в результаті дихання, а також окиснення різних органічних речовин (гниття тваринних
- 17. Хімічні властивості СО2 — типовий кислотний оксид, вступає у взаємодію з водою, основними й амфотерними оксидами,
- 18. Важливою реакцією є реакція взаємодії вуглекислого газу з аміаком, у результаті якої утворюється азотвмісне мінеральне добриво
- 19. В органічному синтезі СО2 дозволяє створювати інертну атмосферу. Твердий СО2 («сухий лід») застосовується для охолодження продуктів,
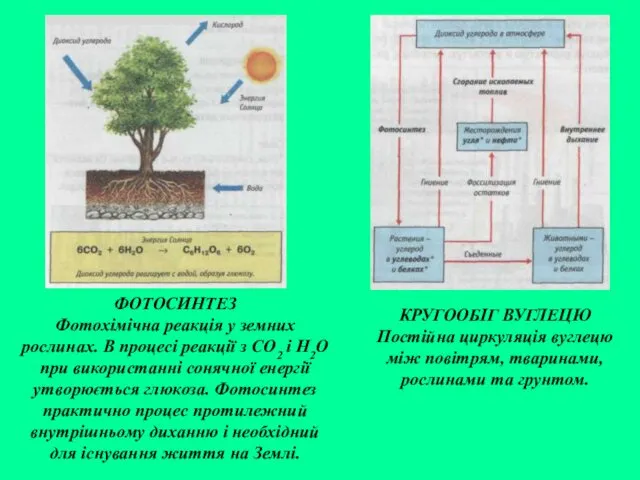
- 20. КРУГООБІГ ВУГЛЕЦЮ Постійна циркуляція вуглецю між повітрям, тваринами, рослинами та грунтом. ФОТОСИНТЕЗ Фотохімічна реакція у земних
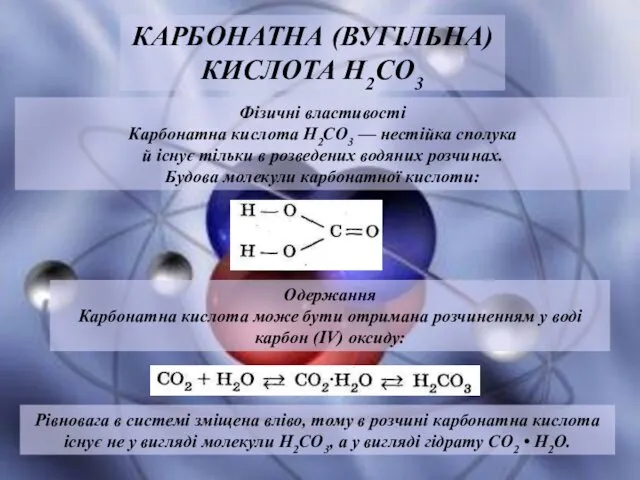
- 21. Фізичні властивості Карбонатна кислота Н2СО3 — нестійка сполука й існує тільки в розведених водяних розчинах. Будова
- 22. Хімічні властивості Карбонатна кислота слабка, у розчині дисоціює. Будучи двохосновною кислотою, вона дисоціює східчасто, причому процес
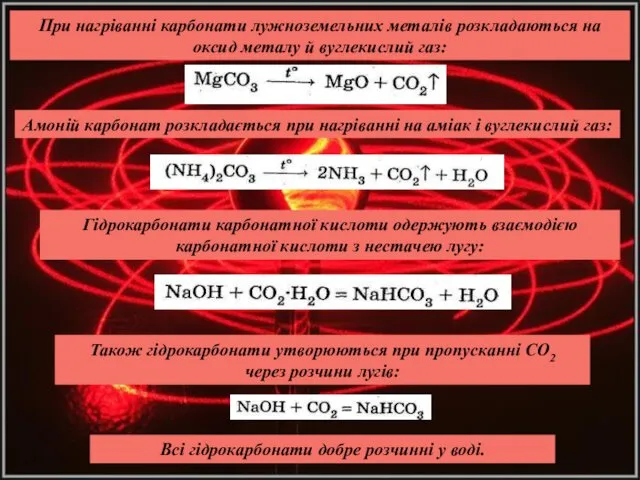
- 23. При нагріванні карбонати лужноземельних металів розкладаються на оксид металу й вуглекислий газ: Амоній карбонат розкладається при
- 24. При прожарюванні гідрокарбонати розкладаються: Зі слабкими основами карбонатна кислота утворює основні солі. Серед них широко відомий
- 25. Застосування Багато солей карбонатної кислоти мають важливе практичне значення. Натрій карбонат Na2CO3 (сода) може утворювати стійкий
- 26. Карбамід CO(NH2)2 (сечовина) — біла кристалічна речовина, добре розчинна у воді. Одержують сечовину взаємодією карбон (IV)
- 27. КАРБОНАТ БАРІЮ Карбонат барію забарвлює скло коричневим кольором КАРБОНАТ НАТРІЮ Карбонат натрію знижує температуру плавлення піску,
- 28. Фізичні властивості Кремній Si — кристалічна речовина темно-сірого кольору з характерним блиском; існувати в аморфному стані.
- 29. Отриманий таким способом кремній сильно забруднений домішками і його очищають перекристалізацією з розплавів металів. Кремній особливої
- 30. Зберігають галогеніди кремнію в запаяних або щільно закритих посудинах, оскільки на повітрі вони димлять. При значному
- 31. Одержання Силан утворюється при розкладанні силіцидів лужних, лужноземельних металів і Мg водою, лугами або розведеними кислотами:
- 32. Хімічні властивості Силан дуже горючий, на повітрі самозаймається: Під дією води й лугів силан розкладається з
- 33. Фізичні властивості Силіцій (IV) оксид SiO2 — тверда кристалічна речовина, тугоплавка (tпл. = 1713 °С, tкип.
- 34. При кип'ятінні SiO2 реагує з лугами: Кислоти не діють на SiO2, він розчиняється тільки в плавиковій
- 35. Фізичні властивості Силікатна кислота Н4SiO3 — драглиста речовина, погано розчинна у воді. У пересичених водяних розчинах
- 36. Природне скло вулканічного походження. Воно утворюється при сплавлянні силіцій оксиду зі склотвірними природними матеріалами в умовах
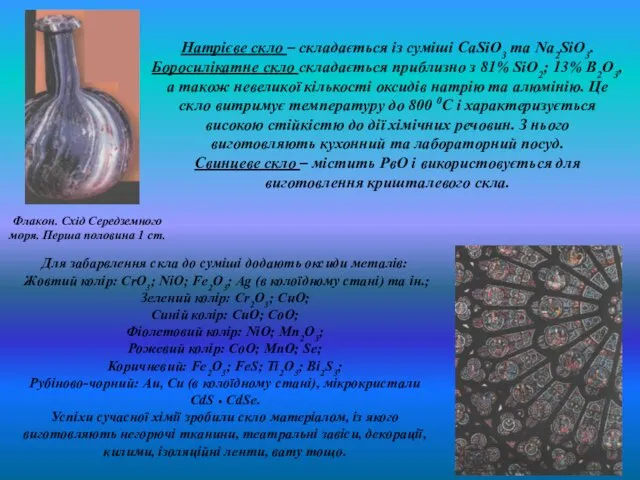
- 37. Скло – отримують із розплавленого піску який складається в основному із кварцу. Для пониження температури плавлення
- 38. Для забарвлення скла до суміші додають оксиди металів: Жовтий колір: CrO3; NiO; Fe2O3; Ag (в колоїдному
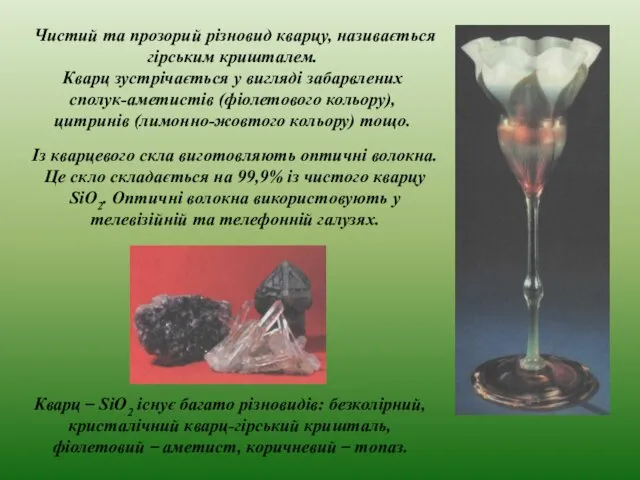
- 39. Чистий та прозорий різновид кварцу, називається гірським кришталем. Кварц зустрічається у вигляді забарвлених сполук-аметистів (фіолетового кольору),
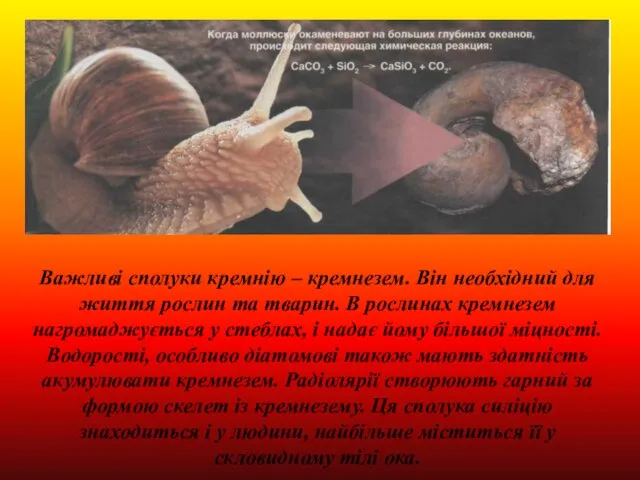
- 40. Важливі сполуки кремнію – кремнезем. Він необхідний для життя рослин та тварин. В рослинах кремнезем нагромаджується
- 42. Скачать презентацию






























 Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.
Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.  Мыс. Мыс көзі
Мыс. Мыс көзі Какое свойство кожуры апельсина помогает держать его на поверхности воды
Какое свойство кожуры апельсина помогает держать его на поверхности воды Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Порфирины. Производные порфина. (Лекция 14)
Порфирины. Производные порфина. (Лекция 14) Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна
Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна  Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура
Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура Презентация по Химии "Химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Химическая связь" - скачать смотреть бесплатно Хімічні методи підвищення продуктивності свердловини
Хімічні методи підвищення продуктивності свердловини Введение. Теория строения органических соединений А.М.Бутлерова. Лекция 1-2
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция 1-2 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Простые вещества - металлы
Простые вещества - металлы Дисперсная система
Дисперсная система Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Химия и биохимия игристых вин
Химия и биохимия игристых вин Истрия развития химии
Истрия развития химии Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Введение в экологическую токсикологию
Введение в экологическую токсикологию Физическая и коллоидная химия
Физическая и коллоидная химия Геология полезных ископаемых
Геология полезных ископаемых Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Предельные углеводороды
Предельные углеводороды Гліцерин. Загальні відомості про гліцерин
Гліцерин. Загальні відомості про гліцерин Определение валентности элементов
Определение валентности элементов Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють
Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють Подготовила воспитанница 11 «А» класса Кулишова Валерия
Подготовила воспитанница 11 «А» класса Кулишова Валерия