Содержание
- 2. Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ,
- 3. Мнемоническое правило Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило: У анода
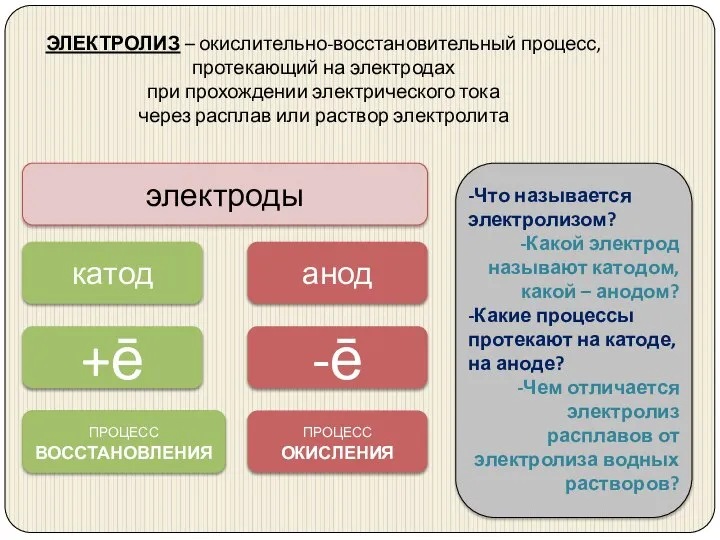
- 4. ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита
- 5. Электролиз в газах Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них
- 9. Шкала активности ионов
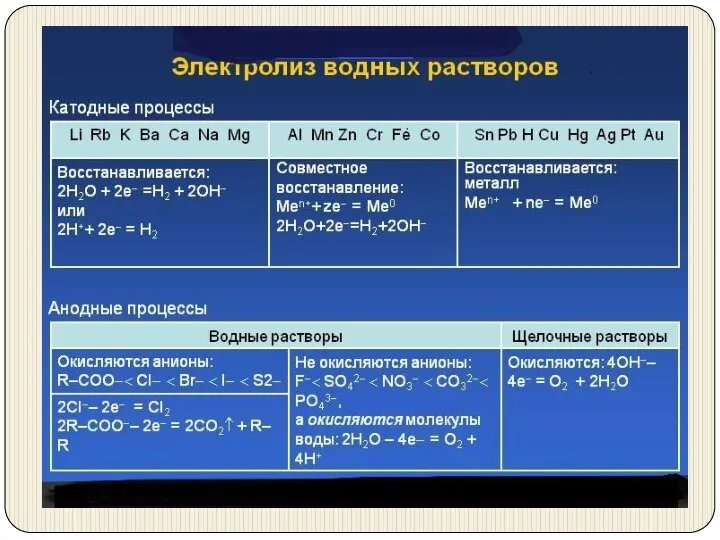
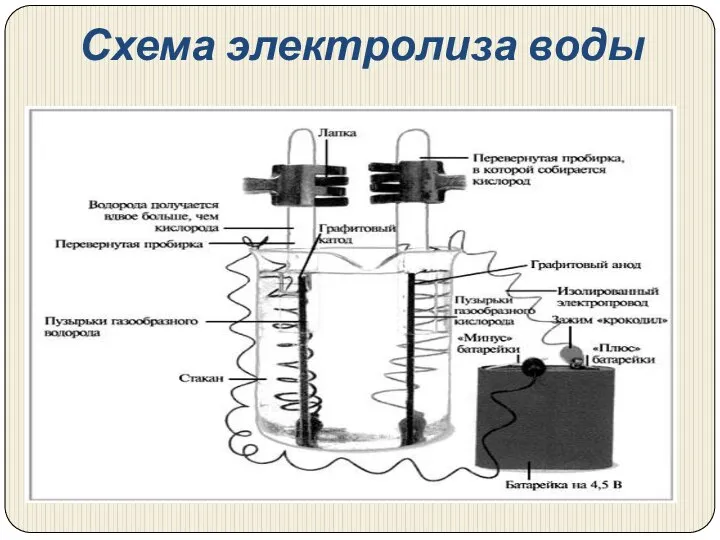
- 13. Схема электролиза воды
- 14. Электролиз расплава хлорида натрия: NaCl Na+ + Cl–; катод (–) (Na+): Na+ + е = Na0,
- 15. Растворы Активные металлы Соль активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl− K"катод"(-): 2H2O
- 16. Менее активные металлы Соль менее активного металла и бескислородной кислоты ZnCl2 ↔ Zn2+ + 2Cl− K"катод"(-):
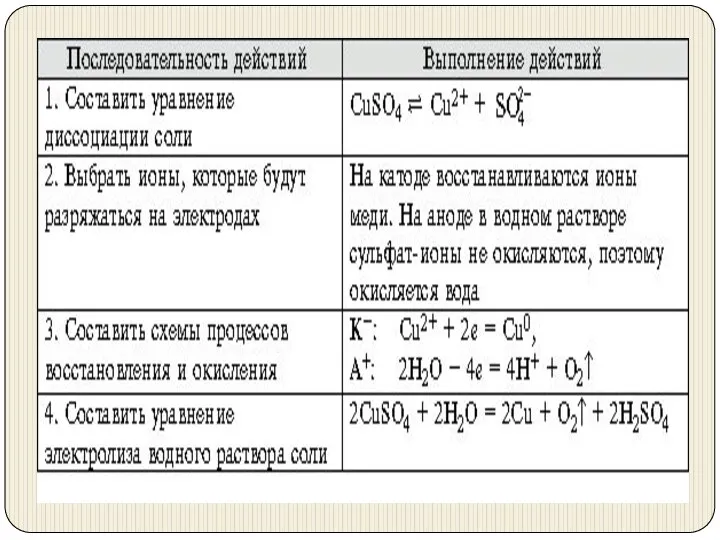
- 17. Соль менее активного металла и кислородсодержащей кислоты ZnSO4 ↔ Zn2++SO42− K(-): Zn2+ + 2e = Zn0
- 18. Соль активного металла и кислородсодержащей кислоты Na2SO4↔2Na++SO42− K(-): 2H2O + 2e = H2 + 2OH− A(+):
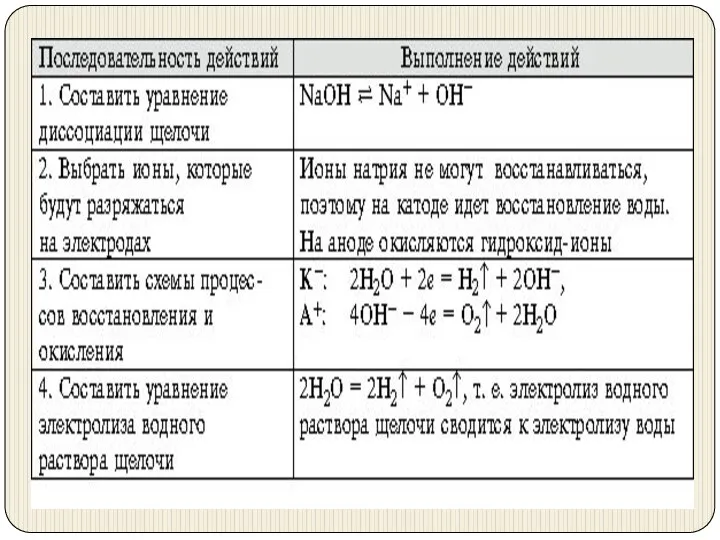
- 19. Гидроксид: активный металл и гидроксид-ион NaOH ↔ Na+ + OH− K(-): 2H2O + 2e = H2
- 20. Расплавы Активные металлы Соль активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl− K"катод"(-): Na+
- 22. Соль активного металла и кислородосодержащей кислоты Na2SO4↔2Na++SO42− K(-): 2Na+ +2e =2Na0 A(+): 2SO42− −4e =2SO3+O2 Вывод:
- 23. Применение электролиза Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов
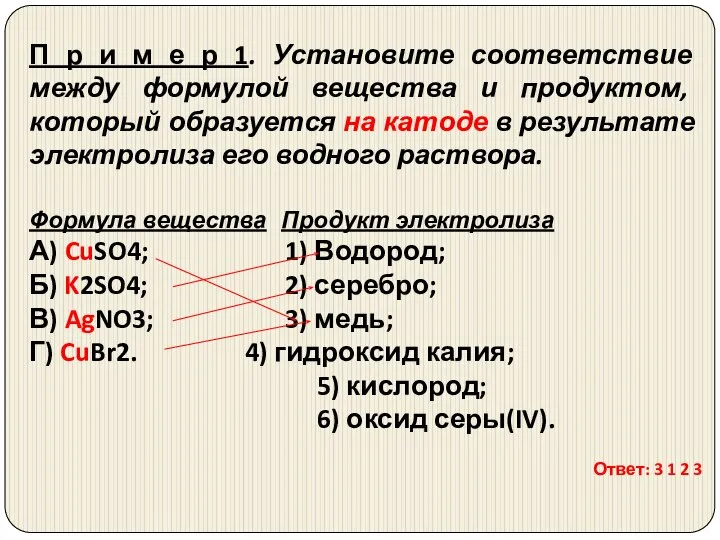
- 24. П р и м е р 1. Установите соответствие между формулой вещества и продуктом, который образуется
- 25. Выбери правильный ответ 1. При электролизе раствора гидроксида калия на катоде выделяется: а) водород; б) кислород;
- 26. Ответы Вопрос 1 -а Вопрос 2-б Вопрос 3-б Вопрос 4-а Вопрос 5-б
- 27. Использованная литература: Химия: основы общей химии: учеб. для 11 кл. ОУ: базовый уровень/Г.Е. Рудзитис, Ф.Г. Фельдман
- 29. Скачать презентацию




















 Презентация по химии Ферменты
Презентация по химии Ферменты  Органическая химия. Лекция 12
Органическая химия. Лекция 12 Металеві властивості феруму
Металеві властивості феруму Матеріальний баланс процесу горіння
Матеріальний баланс процесу горіння Методические рекомендации по подготовке учащихся к выполнению заданий повышенного и высокого уровней сложности ЕГЭ по химии
Методические рекомендации по подготовке учащихся к выполнению заданий повышенного и высокого уровней сложности ЕГЭ по химии Термопластичні Термореактивні
Термопластичні Термореактивні  Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Классификация кислых пород
Классификация кислых пород Растворы. Концентрации растворов
Растворы. Концентрации растворов Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Минералдар. Минералдардын жіктелуі
Минералдар. Минералдардын жіктелуі Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат
Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат Презентация по Химии "«Чайная презентация»" - скачать смотреть бесплатно
Презентация по Химии "«Чайная презентация»" - скачать смотреть бесплатно Твердые растворы Zn1,92-2хMg0,08Mn2xSiO4 и Zn1,76-2хMg0,24Mn2xSiO4: синтез и спектроскопические свойства
Твердые растворы Zn1,92-2хMg0,08Mn2xSiO4 и Zn1,76-2хMg0,24Mn2xSiO4: синтез и спектроскопические свойства Наглядное пособие «Динамические модели». Химическое равновесие в растворах
Наглядное пособие «Динамические модели». Химическое равновесие в растворах Поверхностные явления. Адсорбция. (Лекция 1)
Поверхностные явления. Адсорбция. (Лекция 1) Оптимизация хроматографического процесса
Оптимизация хроматографического процесса Роль химии в жизни человека
Роль химии в жизни человека Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы
Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010
Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010 Скорость химической реакции (химическая кинетика )
Скорость химической реакции (химическая кинетика ) Алкены. Строение, номенклатура, изомерия, физические и химические свойства алкенов
Алкены. Строение, номенклатура, изомерия, физические и химические свойства алкенов Аварії з викидом хімічних небезпечних речовин та їх класифікація
Аварії з викидом хімічних небезпечних речовин та їх класифікація Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Сера. Аллотропия серы. Физические и химические свойства серы. Применение Органічні речовини в живій природі. Рівні структурної організації органічних речовин
Органічні речовини в живій природі. Рівні структурної організації органічних речовин Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть
Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть  Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение