Содержание
- 2. Введение в общую химию Основные понятия химии
- 3. Структура дисциплины Общее количество часов 48 Аудиторные занятия – 10 часов В том числе практическое занятие
- 4. Содержание дисциплины Основные законы химии Химические реакции Химическая кинетика Растворы. Способы выражения концентрации растворов Метода качественного
- 5. Химия – это наука о веществах, их свойствах и превращениях, а также о явлениях, которые сопровождают
- 6. Атомно – молекулярное учение 1. Большинство известных в настоящее время веществ состоят из молекул. Молекула –
- 7. 2. Молекулы состоят из атомов. Атом – электронейтральная динамическая система, состоящая из ядра, образованного протонами и
- 9. 3. Молекулы и атомы находятся в непрерывном движении. 4. При протекании химических реакций из одних веществ
- 10. Химический элемент – совокупность атомов с одинаковым положительным зарядом ядра. Например, элемент «сера» включает атомы S,
- 11. Вещество – совокупность атомов, ионов или молекул, состоящее из одного или нескольких химических элементов.
- 12. Вещества Простые – образованы атомами одного химического элемента (O2,N2); Сложные – образованы атомами разных химических элементов
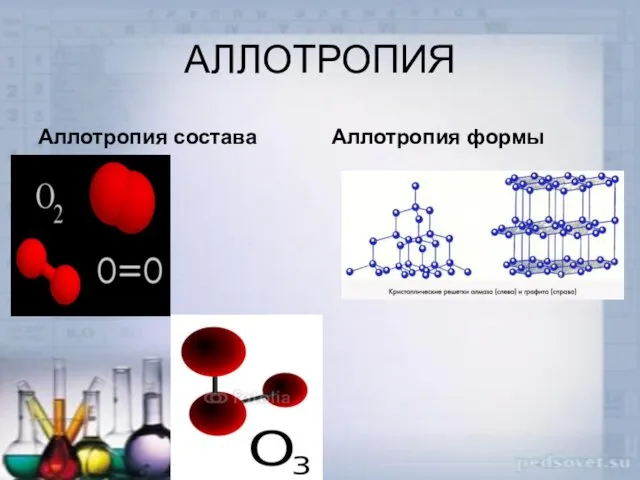
- 13. Аллотропия Существование двух и более простых веществ одного и того же химического элемента, различных по строению
- 14. АЛЛОТРОПИЯ Аллотропия состава Аллотропия формы
- 15. Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы
- 16. Относительная молекулярная масса (Mr) - безразмерная величина, равная отношению массы молекулы к 1/12 массы атома углерода
- 17. Например Рассчитаем относительную молекулярную массу молекулы серной кислоты: Мr (H2SO4) = 2Ar H + 1Ar S
- 18. Выполним задания Рассчитайте Mr молекулы уксусной кислоты (CH3COOH) Рассчитайте истинную массу молекулы фосфорной кислоты (H3PO4) Рассчитайте
- 19. Количество вещества. Моль. Молярная масса Моль – единица количества вещества. Моль – это количество вещества, содержащее
- 20. 1 моль любого вещества содержит 6,02*1023 структурных единиц 6,02*1023 - ПОСТОЯННАЯ АВОГАДРО (NA) Размерность моль -1
- 21. Масса одного моля вещества (молярная масса М), выраженная в граммах, численно равна относительной молекулярной массе. Единица
- 22. Например Mr (H2SO4) = 98, М = 98 г/моль
- 23. Количество вещества (n) n = N/NA где N – общее число структурных единиц, NA – число
- 24. Решим задачи Вычислите количество вещества цинка в образце массой 2,6 г. Вычислите количество вещества магния в
- 25. Вычислите количество вещества цинка в образце массой 2,6 г. Дано: m (Zn) = 2,6г Решение: Записываем
- 26. Рассчитайте число молекул Br2 в броме массой 6,4г. Дано: M (Br2) = 6,4г N = ?
- 27. Химическая формула – условная запись состава вещества с помощью химических знаков и индексов Химическая формула показывает
- 29. Скачать презентацию

























 Альдегиды. (10 класс)
Альдегиды. (10 класс) Кислоты
Кислоты История развития химии
История развития химии Тайна снежинки. Что такое снег. Как же образуются снежинки
Тайна снежинки. Что такое снег. Как же образуются снежинки Презентация КАЛЬЦИЙ Ca 9 класс
Презентация КАЛЬЦИЙ Ca 9 класс  Теория переходного состояния. Эйринг, Эванс, Поляни. (Лекция 5)
Теория переходного состояния. Эйринг, Эванс, Поляни. (Лекция 5) Синтетические красители
Синтетические красители Производные карбиновой, тио- и дитиокарбаминовой кислот (карбаматы)
Производные карбиновой, тио- и дитиокарбаминовой кислот (карбаматы) Сера, ее физические и химические свойства
Сера, ее физические и химические свойства Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 Презентация по Химии "портфоліо" - скачать смотреть
Презентация по Химии "портфоліо" - скачать смотреть  Значення хімічних процесів у природі
Значення хімічних процесів у природі Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Природный газ
Природный газ  Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву
Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву Игра - викторина
Игра - викторина Непредельные углеводороды: алкены
Непредельные углеводороды: алкены Аргентум, или серебро
Аргентум, или серебро Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой
Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой Устойчивость и коагуляция коллоидных систем
Устойчивость и коагуляция коллоидных систем Строение атома
Строение атома Вода та її властивості
Вода та її властивості SVOJSTVA (1)
SVOJSTVA (1) Свинец. Строение атома свинца
Свинец. Строение атома свинца Презентация Водород
Презентация Водород Ионные кристаллы
Ионные кристаллы  Физические свойства потребительских товаров
Физические свойства потребительских товаров Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона