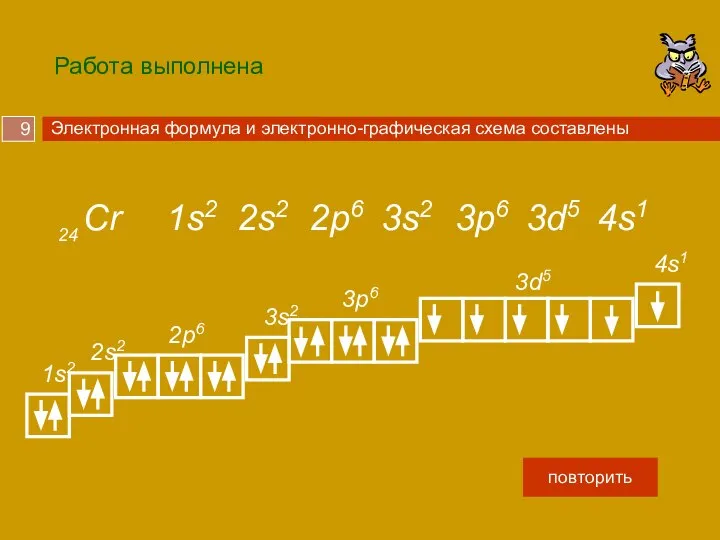
У хрома 24 электрона , запишем это число на черновике.
Первым в
атоме заполняется 1s подуровень
На нем максимально может быть 2 электрона, отметим их и вычтем из 24.
Осталось разместить 22 электрона. Заполняется следующий 2s подуровень, на нем может быть 2 электрона. Проделаем аналогичные операции.
Дошли до 3d подуровня, на нем максимально может быть 10 электронов, но осталось только 4, их и помещаем.
Порядок заполнения энергетических уровней в атоме.
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4р6 …
1s
2. По образцу составь электронную формулу.
Эту часть выполнили идем дальше
22
24
- 2 =
Cr
24
2
2
2
2
6
6
3s
2s
4s
2p
3p
3d
- 2 =
- 6 =
- 2 =
- 6 =
- 2 =
20
14
12
6
4







 Вещественный состав магматических горных пород
Вещественный состав магматических горных пород Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Вирощування кристалів солей
Вирощування кристалів солей Адсорбция
Адсорбция Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика Комплексные соединения
Комплексные соединения Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Решение экспериментальных задач по неорганической химии. Практическая работа
Решение экспериментальных задач по неорганической химии. Практическая работа Состав вещества
Состав вещества Свойства серной кислоты и солей
Свойства серной кислоты и солей Хімічнi елементи
Хімічнi елементи Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Катионы IV аналитической группы
Катионы IV аналитической группы Электрокинетические явления
Электрокинетические явления Подагра
Подагра Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Аттестационная работа. Образовательная программа внеурочной деятельности «Химия красок»
Аттестационная работа. Образовательная программа внеурочной деятельности «Химия красок» Вещества
Вещества Свойства и классификация нефти
Свойства и классификация нефти Биосинтез кортикостероидов из ацетил КоА и ХС
Биосинтез кортикостероидов из ацетил КоА и ХС Задачи на смеси (задание № 33)
Задачи на смеси (задание № 33) Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Решение задач с использованием понятия «количество вещества»
Решение задач с использованием понятия «количество вещества» Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Альдегидная функциональная группа
Альдегидная функциональная группа Презентация по Химии "Изотопы" - скачать смотреть
Презентация по Химии "Изотопы" - скачать смотреть