Содержание
- 2. Основные понятия и определения Хим. термодинамика – Термодинамическая система (ТДC) – Открытая ТДС – Закрытая ТДС
- 3. Основные понятия и определения Химический компонент – Различают: одно-, двух-, многокомпонентные системы. Фаза – Гомогенная система
- 4. Основные понятия и определения Параметры состояния – Изотермические процессы: Т = const Изобарные: Р = const
- 5. Внутренняя энергия Внутренняя Е - это Абсолютное значение внутренней Е измерить невозможно. ΔU – изменение внутренней
- 6. Первый закон термодинамики Теплота (Q), полученная ТДС, расходуется на изменение её внутренней Е (ΔU) и совершение
- 7. Энтальпия ΔH = ΔU + p·ΔV Изменение энтальпии равно изменению внутренней Е ТДС и совершению работы
- 8. Стандартная энтальпия Стандартная энтальпия (ΔHо) – изменение энтальпии реакции в стандартных условиях. Стандартные условия Давление 1,013·105
- 9. Стандартная энтальпия образования вещества ΔfHо – [ΔfHо] = кДж/моль ΔfHо простых в-в в термодинамически устойчивом состоянии
- 10. Термохимические уравнения Хим. уравнение реакции: 2Н2 + О2 = 2Н2О Термохимическое урав-ие р-ции: Н2(г) + 1/2О2(г)
- 11. Закон Гесса Энтальпия химической реакции 1840 г. Г.И. Гесс Тепловой эффект хим. р-ции (энтальпия р-ции) не
- 12. Второй закон термодинамики В изолированной системе любой самопроизвольный процесс протекает в направлении, при котором система переходит
- 13. Третий закон термодинамики Энтропия правильного кристалла стремится к 0 по мере приближения температуры к абсолютному 0.
- 14. Энтропия В изолированной системе S является критерием самопроизвольности протекания процесса. Процессы протекают самопр-но в направлении ув-ия
- 15. Направление протекания химических процессов. ΔG = ΔH - ТΔS ΔG – энергия Гиббса - функция состояния
- 17. Скачать презентацию







![Стандартная энтальпия образования вещества ΔfHо – [ΔfHо] = кДж/моль ΔfHо простых](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407858/slide-8.jpg)






 Solutions. Acid–base equilibrium in biological systems
Solutions. Acid–base equilibrium in biological systems Презентация по Химии "Продукти харчування" - скачать смотреть бесплатно
Презентация по Химии "Продукти харчування" - скачать смотреть бесплатно Валентные возможности атомов
Валентные возможности атомов Ароматические эфирные масла и их использование
Ароматические эфирные масла и их использование Закономерности биохимии, токсикологии, изолирования и анализа «металлических» ядов. Первая помощь при отравлении
Закономерности биохимии, токсикологии, изолирования и анализа «металлических» ядов. Первая помощь при отравлении Гормоны. Механизм действия гормонов
Гормоны. Механизм действия гормонов Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии
Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии Спирттер мен фенолдар
Спирттер мен фенолдар Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Органические и неорганические вещества
Органические и неорганические вещества Обобщение и систематизация знаний по теме Химические реакции
Обобщение и систематизация знаний по теме Химические реакции Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Йодиметрия и йодометрия. (Лекция 9)
Йодиметрия и йодометрия. (Лекция 9) Масс-спектрометрия в органической химии
Масс-спектрометрия в органической химии Электродные потенциалы. Гальванические элементы. ЭДС
Электродные потенциалы. Гальванические элементы. ЭДС Состояние и свойства воды
Состояние и свойства воды Сложные эфиры в природе и их применение
Сложные эфиры в природе и их применение Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Структуры в сталях
Структуры в сталях ХИМИЯ – ЭТО ОБЛАСТЬ ЧУДЕС. О, сколько нам, открытий чудных, готовит просвещенья дух, и опыт сын, ошибок трудных, и гений парадо
ХИМИЯ – ЭТО ОБЛАСТЬ ЧУДЕС. О, сколько нам, открытий чудных, готовит просвещенья дух, и опыт сын, ошибок трудных, и гений парадо Общая характеристика углерода
Общая характеристика углерода Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A
Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A Вода. Свойства воды
Вода. Свойства воды Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений
Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения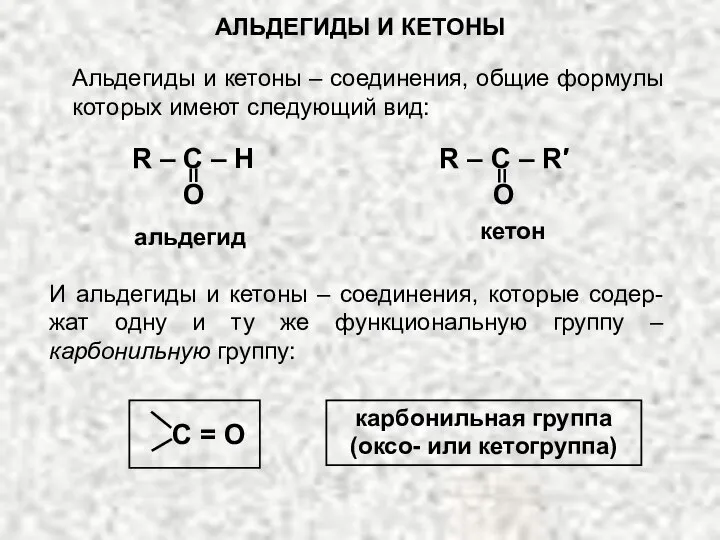 Альдегиды и кетоны
Альдегиды и кетоны Кадмий
Кадмий