Содержание
- 2. План Сущность броматометрии Индикаторы метода броматометрии Применение броматометрии Бромометрия Нитритометрия Условия реакции диазотирования Определение КТТ в
- 3. BrO3- + 6 H+ + 6ē ⇆ Br - + 3 H2O = 1,44 B
- 4. Стандартизацию раствора КBrO3 проводят по As2O3, Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, [H2N-NH2]∙H2SO4
- 5. После ТЭ BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3 H2O
- 6. Применение броматометрии восстановители способом прямого титрования: As(III), Sb(III), Fe(II), H2O2, N2H4, а также некоторые фармацевтические препараты;
- 7. Определение оксида мышьяка(III) As2O3 + 6 OH- ⇆ 2 AsO33- + 3 H2O AsO33- + 3
- 8. Определение сурьмы(III) 3 H2[SbCl5] + Cl- – 2ē ⇆ H[SbCl6] + H+ 1 BrO3- + 6
- 9. Бромометрия Br2 + 2ē ⇆ 2 Br - BrO3- + 5 Br - + 6 H+
- 10. Br2 + 2 I- ⇆ I2 + 2 Br -
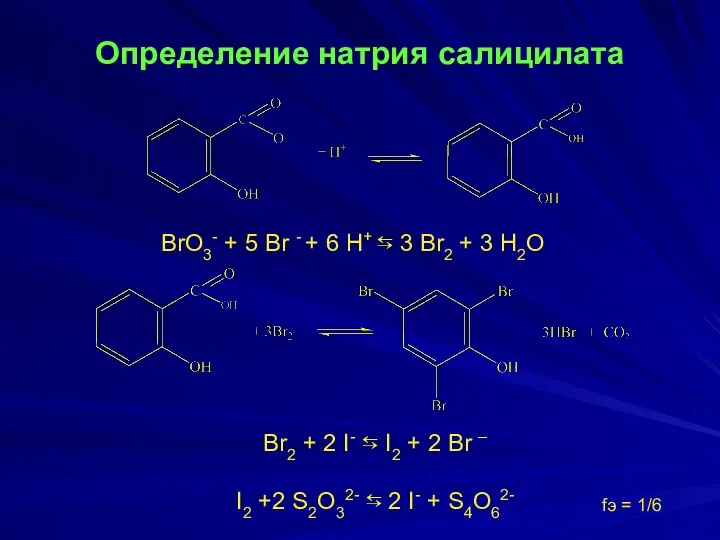
- 11. Определение натрия салицилата BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 + 3
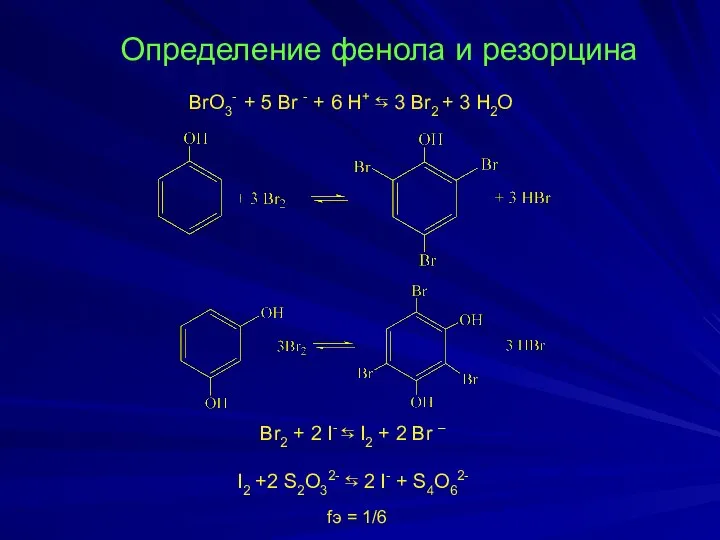
- 12. Определение фенола и резорцина BrO3- + 5 Br - + 6 H+ ⇆ 3 Br2 +
- 13. Определение катионов металлов, осаждающихся 8-оксихинолином Mg2+ + 2 HOxin + 2 NH3 ⇆ Mg(Oxin)2↓ + 2
- 14. Нитритометрия
- 15. Как окислитель нитрит натрия используют для определения восстановителей Sn2+, Fe2+, As2O3, N2H4 HNO2 + H+ +
- 16. Реакция диазотирования протекает с первичными ароматическими аминами в кислой среде Ar – NH2 + NaNO2 +
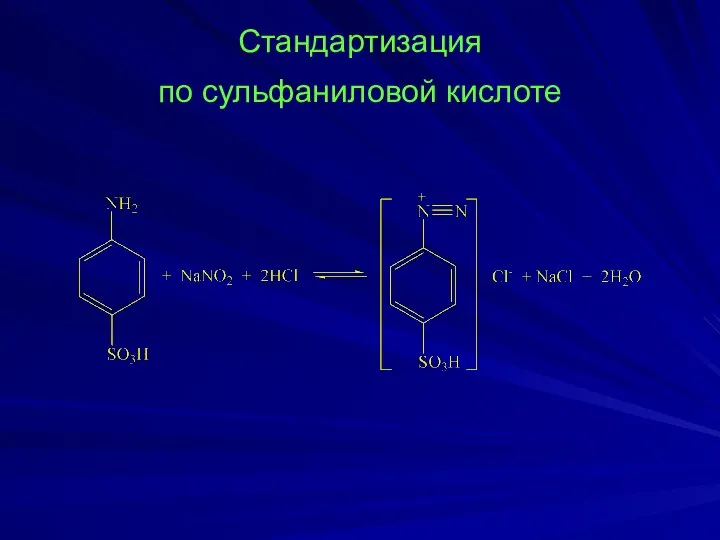
- 17. Стандартизация по сульфаниловой кислоте
- 19. Скачать презентацию


![Стандартизацию раствора КBrO3 проводят по As2O3, Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, [H2N-NH2]∙H2SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407690/slide-3.jpg)



![Определение сурьмы(III) 3 H2[SbCl5] + Cl- – 2ē ⇆ H[SbCl6] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407690/slide-7.jpg)






 Презентация по химии Химия
Презентация по химии Химия Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Детонаційна стійкість бензину
Детонаційна стійкість бензину Технологія жирів і жирозамінників
Технологія жирів і жирозамінників Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов
Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов The study of adsorption-desorption interaction of amino acids with calcium phosphates
The study of adsorption-desorption interaction of amino acids with calcium phosphates Решение задач. Органическая химия
Решение задач. Органическая химия Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки Кальций
Кальций Органикалық химия
Органикалық химия Polymerase chain reaction
Polymerase chain reaction Творческий проект учащихся 7 класса Совхозной СОШ . Руководитель: учитель технологии Фотеева О.И.
Творческий проект учащихся 7 класса Совхозной СОШ . Руководитель: учитель технологии Фотеева О.И.  Неорганическая химия Сероводород
Неорганическая химия Сероводород  ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АРЕНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АРЕНОВ Презентация по Химии "Гигиенические аспекты загрязнения пищевых продуктов чужеродными в-ми и меры профилактики" - скачать см
Презентация по Химии "Гигиенические аспекты загрязнения пищевых продуктов чужеродными в-ми и меры профилактики" - скачать см Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое
Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое Теория электрической диссоциации
Теория электрической диссоциации Яблоки и здоровье человека
Яблоки и здоровье человека Периодический закон и периодическая система химических элементов (турнир знатоков химии)
Периодический закон и периодическая система химических элементов (турнир знатоков химии) Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари
Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск
Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск  Типы кристаллических решёток
Типы кристаллических решёток Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Противомикробное средство растительного происхождения, хлорофиллипт
Противомикробное средство растительного происхождения, хлорофиллипт Вклад ученых Казахстана в развитие органической химии
Вклад ученых Казахстана в развитие органической химии Степень окисления. Ряд напряжений. (Лекция 2.1)
Степень окисления. Ряд напряжений. (Лекция 2.1) Расчеты по уравнениям химической реакции
Расчеты по уравнениям химической реакции Аттестационная работа. Разработка урока химии в 9 классе Исследовательская деятельность при решении экспериментальных задач
Аттестационная работа. Разработка урока химии в 9 классе Исследовательская деятельность при решении экспериментальных задач